Введение
Общепризнанно, что хронический гломерулонефрит (ХГН), характеризующийся длительно персистирующим и/или часто рецидивирующим нефротическим синдромом (НС), который приводит к прогрессирующему ухудшению фильтрационной функции почек, является одной из наиболее прогностически неблагоприятных форм [1]. Наряду с возрастом пациентов, морфологическим вариантом ХГН, степенью поражения почечного тубулоинтерстиция, своевременно начатой адекватной терапией [2] именно ответ на патогенетическое лечение во многом отражает риск развития терминальной почечной недостаточности. Так, показано, что у 2/3 больных НС, резистентным к терапии глюкокортикостероидами (ГКС), поражение почек прогрессирует до стадии необратимой почечной недостаточности в течение 5–10 лет, в то время как у больных, ответивших на лечение, частота ее развития не превышает 3–5 % [3].
Изучение закономерностей формирования резистентности к общепринятым протоколам иммуносупрессивной терапии при ХГН с НС у взрослых представляет существенный интерес с точки зрения оптимизации лечения этой категории пациентов, направленной на совершенствование подходов к торможению прогрессирования хронической почечной недостаточности и снижению числа нежелательных явлений, связанных с применением ГКС и цитостатиков.
Совершенствование молекулярно-генетических методов исследований позволило выявить новые особенности в структуре и функции щелевой диафрагмы подоцитов. В связи с этим среди причин резистентности ХГН с НС к патогенетической терапии, в т.ч. ГКС, обсуждается роль генетически детерминированных дефектов подоцитарных белков. У детей именно они лежат в основе почти трети всех случаев НС [4]. В настоящее время идентифицирован ряд мутаций генов, кодирующих мембранные белки подоцитов – молекул, четко ассоциированных с формированием НС, в т.ч. и в качестве его единственной детерминанты [5].
Подоцин, кодируемый геном NPHS2, является одним из основных компонентов щелевой диафрагмы [6] и представляет собой интегральный белок, экспрессирующийся в подоцитах, направленный обоими своими концами в интрацеллюлярное пространство. Этот белок взаимодействует с интрацеллюлярными доменами нефрина, семейством белков NEPH и CD2AP, в связи с чем нарушения, лежащие в основе NPHS2-нефропатии, приводят к дефекту функции щелевой диафрагмы. Мутации могут быть причиной отсутствия подоцина, перенацеливания нефрина в фильтрационной функции или нарушения сигнальных путей, что приводит в конечном итоге к формированию генетически детерминированного структурного и функционального повреждения подоцитарного барьера (подоцитопатии). Именно подоцитопатию сегодня рассматривают как основную причину появления и нарастания протеинурии при диабетической нефропатии и ХГН, как первичном, так и в рамках системных заболеваний [7–10].
Поскольку многие варианты НС у детей связаны с мутациями гена подоцина (как это было показано нами ранее [11]), можно предполагать, что определенная часть случаев ХГН с НС у взрослых также может быть обусловлена носительством мутантных форм гена, кодирующего подоцин [12]. Поиск мутаций гена подоцина у взрослых пациентов со стероидрезистентным НС будет способствовать более детальному пониманию механизмов прогрессирования почечного поражения. В свою очередь уточнение патогенетической и прогностической роли этих мутаций позволит оптимизировать тактику обследования больных ХГН с НС, не уступающим стандартным схемам иммуносупрессивной терапии, и совершенствовать в перспективе подходы к преодолению терапевтической резистентности.
Материал и методы
В исследование ретроспективно и проспективно включались больные ХГН с НС, наблюдавшиеся в клинике нефрологии, внутренних и профессиональных заболеваний им. Е.М. Тареева (УКБ № 3) ГБОУ ВПО «Первый МГМУ им. И.М. Сеченова» Минздрава России и в ФГБУ НЦЗД РАМН с 2006 по 2012 г.
Обследованы 54 пациента с ХГН и НС: 23 – женского и 31 – мужского пола в возрасте от 13 до 69 лет (средний возраст составил 34 года). Всем пациентам диагноз был подтвержден морфологически: у 7 – выявлена болезнь минимальных изменений, у 9 – мембранозная нефропатия, у 23 – мезангиопролиферативный гломерулонефрит, у 15 – фокально-сегментарный гломерулосклероз.
В зависимости от ответа на проводимую стандартную иммуносупрессивную терапию преднизолоном или преднизолоном в сочетании с циклофосфамидом больные были разделены на 2 группы. Все задачи исследования решались при сопоставлении двух выделенных групп пациентов.
I группу составили 27 пациентов с установленным диагнозом ХГН и НС, не ответивших на стандартную иммуносупрессивную терапию (пациенты с сохраняющимся или постоянно рецидивирующим НС и/или с прогрессирующим ухудшением функции почек) – 17 мужчин, 10-женщин в возрасте от 13 до 52 лет (в среднем 27 лет). По данным морфологического исследования тканей биоптатов почек, 3 пациента страдали болезнью минимальных изменений, 4 – мембранозной нефропатией, 9 – мезангиопролиферативным и 11 – фокально-сегментарным гломерулосклерозом.

II группу составили 27 пациентов с установленным диагнозом ХГН и НС, ответившим на стандартную иммуносупрессивную терапию (полная или частичная ремиссия [снижение протеинурии более чем на 50 %], а также стабильная функция почек) – 14 мужчин, 13 женщин в возрасте от 17 до 69 лет (в среднем 42 года). По данным морфологического исследования тканей биоптатов почек, у 4 пациентов выявлена болезнь минимальных изменений, у 5 – мембранозная нефропатия, у 14 – мезангиопролиферативный, у 4 – фокально-сегментарный гломерулосклероз.
Клинические анализы крови, мочи, определение суточной протеинурии (СПУ), биохимические исследования крови и мочи с определением уровня креатинина, общего белка, альбумина, показателей липидного обмена, электролитов и др. проводились в межклинической биохимической лаборатории ГБОУ ВПО «Первый МГМУ им. И.М. Сеченова» Минздрава России и в ФГБУ НЦЗД РАМН, скорость клубочковой фильтрации (СКФ) рассчитывалась по формуле MDRD для пациентов старше 18 лет и по формуле Шварца для пациентов моложе 18 лет.
Для выделения геномной ДНК из лейкоцитов венозной крови использовали набор реактивов «Wizard Genomic DNA Purification Kit» фирмы «Promega» (США) в соответствии с протоколом производителя. Хранение выделенной ДНК осуществляли при -20°С. Все исследуемые фрагменты ДНК амплифицировали методом ПЦР на программируемом термоциклере «DNA Engine thermal cyclers» (Bio-Rad). Дизайн праймеров для амплификации и секвенирования осуществлялся на основании данных GeneBank c использованием программ «Vector NTI Suite 8» и «Oligo 6.31». Для разделения и детекции продуктов амплификации и ферментативного гидролиза использовали горизонтальный электрофорез в агарозном геле. Визуализацию результатов электрофореза проводили в УФ-свете на приборе гель-документации Gel Doc XR (Bio-Rad). Нуклеотидную последовательность гена подоцина (NPHS2) определяли на генетическом анализаторе Applied Biosystems 3130. Секвенирование проводили в двух направлениях – как с прямого, так и с обратного праймеров. Для сиквенсовой реакции использовали те же праймеры, что и для постановки ПЦР, а также наборы BigDye Terminator v 3.1 Cycle Sequencing Kit (Applied Biosystems). Для разделения продуктов сиквенсовой реакции использовали полимер POP7 (Applied Biosystems). Полученные нуклеотидные последовательности гена NPHS2 выравнивали с известной нуклеотидной последовательностью с помощью утилиты SeqMan из пакета программ Lasergene. Анализ результатов сиквенирования проводили в программе Chromas.
Для статистического анализа полученных данных применяли пакет прикладных программ STATISTICA 6,0 и SPSS 11.5. С использованием критериев Шапиро–Вилка и χ2 Пирсона были проверены гипотезы о нормальности распределений исследуемых показателей. При сравнении параметров, имевших ненормальное распределение, использовали критерий Манна–Уитни или критерий Крускала–Уоллиса. Критический уровень значимости для всех статистических критериев принимали равным 0,05. При анализе данных оценивали медиану, разброс величин по отношению к медиане по показателю интерквартильного размаха (25, 75 процентилей). В тексте работы все значения представлены в виде медианы, в квадратных скобках указан интерквартильный размах.
Результаты
1. Объем проведенной терапии в группах пациентов
Всем пациентам назначалось лечение ГКС внутрь. Дополнительно к этому в 1-й группе проводилась пульс-терапия ГКС 21 пациенту, во 2-й – 19.
При сравнении двух групп больных ХГН с НС не получено достоверных отличий в дозах ГКС внутрь (средняя доза – 40 [30–60] и 40 мг [30–60] в группах 1 и 2 соответственно). Кроме того, не отмечено достоверных различий в длительности терапии ГКС (средняя длительность – 24 [12–24] и 18 месяцев [12–30] в группах 1 и 2 соответственно), а также в суммарной дозе ГКС, полученной при внутривенных введениях (средняя суммарная доза – 4000 [1500–13000] и 3200 мг [0–10000]).
Терапию циклофосфамидом получали 15 человек 1-й группы и 17 – 2-й. Средняя суммарная доза составила 800 мг в первой группе и 1600 мг во второй без достоверного различия между группами.
Кроме стандартной иммуносупрессивной терапии (преднизолон или преднизолон в сочетании с циклофосфамидом) часть пациентов получала альтернативную иммуносупрессивную терапию одним из следующих препаратов: азатиоприн, мофетил микофенолат, циклоспорин А, такролимус. Отмечено, что в группе пациентов, резистентных к стандартной иммуносупрессивной терапии, достоверно чаще назначалась альтернативная терапия (16 пациентов из 27 [59 %]) и, несмотря на это, ответ на лечение не был достигнут. В то же время в группе 2 для достижения полной или частичной ремиссии в некоторых случаях требовалось назначение альтернативной терапии (8 пациентам из 27 [30 %]), но при этом гораздо меньшему числу больных по сравнению с группой 1 (р < 0,05).
Одновременно с патогенетической иммуносупрессивной терапией всем больным проводилась нефропротективная терапия ингибиторами ангиотензинпревращающего фермента, по двое пациентов в каждой группе получали блокаторы рецепторов ангиотензина II. Средние дозы ингибиторов ангиотензинпревращающего фермента были сопоставимы и составили 10 мг в обеих группах (р > 0,05).
2. Клинические характеристики групп
При анализе клинических данных установлено, что исследуемые группы пациентов не различались по средней длительности НС (36 [24–42] и 24 месяца [12–48] в 1-й и 2-й группах соответственно) и стадии ХБП (2-я стадия [1–3] – одинаково для обеих групп). При сопоставлении данных морфологического исследования ткани биоптата почки отмечена одинаковая частота встречаемости в группах болезни минимальных изменений (11 и 15 % больных в группах 1 и 2 соответственно) и мембранозной нефропатии (15 и 19 % больных в группах 1 и 2 соответственно), в то время как мезангиопролиферативный гломерулонефрит выявлялся преимущественно в группе 2 (52 %) по сравнению с группой 1 (33 %). У большей части больных, резистентных к стандартной иммуносупрессивной терапии, был диагностирован фокально-сегментарный гломерулосклероз – 41 % по сравнению с 15 % во 2-й группе, что коррелирует с данными литературы.
При сравнении исследуемых групп больных по основным критериям НС оказалось, что у пациентов 1-й группы чаще выявляли отечный синдром: в 41 % (у 11 пациентов из 27) случаев, в то время как во 2-й группе только в 4 % (1 пациент из 27) (р = 0,001). В дополнение к клиническим особенностям у пациентов 1-й группы была более выражена суточная протеинурия, ниже концентрации общего белка и альбумина сыворотки, повышен уровень холестерина по сравнению с группой 2 (табл. 1). Несмотря на отсутствие статистической значимости в концентрации сывороточного холестерина между группами пациентов, в анамнезе в группе 1 достоверно чаще (p < 0,001) регистрировали нарушения липидного обмена (у 13 из 27 пациентов) по сравнению с группой 2 (у 1 из 27 пациентов).

Кроме указанных данных обращала на себя внимание отчетливая тенденция к снижению сывороточных уровней IgG у пациентов с резистентным к стандартной иммуносупрессивной терапии НС (800 мг/дл [580–1120]) по сравнению с ответившими на лечение пациентами (1170 мг/дл [825–1425]) (р < 0,05), что скорее всего связано с высокой протеинурией, приводящей к большей потере иммуноглобулинов с мочой.
В нашем исследовании не выявлено достоверных отличий между группами по уровню сывороточного креатинина (1,1 [0,7–0,8] и 1,1 мг/дл [0,8–1,4] в группах 1 и 2 соответственно) и функции почек (СКФ составила 72 [43–134] и 81 мл/мин [46–92] в 1-й и 2-й группах соответственно), несмотря на активность нефрита у пациентов первой группы. Сывороточные концентрации других продуктов азотистого обмена также были практически одинаковыми: уровень мочевой кислоты – 5,9 [4,4–7,2] и 6,3 мг/дл [4,4–7,4] в 1-й и 2-й группах соответственно, азота мочевины – 6,05 [3,5–9,9] и 6 ммоль/л [3,7–10] в 1-й и 2-й группах соответственно (р > 0,05).
При анализе концентрации электролитов сыворотки крови и суточной экскреции их с мочой также не выявлено достоверных отличий. Уровень натрия сыворотки составил 143 [140–144] и 142 ммоль/л [140–144] в группах 1 и 2 соответственно, экскреция натрия – 2,29 [1,41–2,78] и 2,69 г/сут [1,5–4,12] в группах 1 и 2 соответственно. Уровень калия сыворотки составил 4,5 [4,3–4,9 и 4,4 ммоль/л [4–4,7] в группах 1 и 2 соответственно, экскреция калия – 1,58 [1,09–2,24] и 2,02 г/сут [1,21–2,6] в группах 1 и 2 соответственно.
3. Генетическое исследование
Из 27 больных, не ответивших на стандартную иммуносупрессивную терапию (группа 1), методом случайной выборки выделены 18 больных, которым проведено генетическое исследование: 8 – мужского пола, 10 – женского в возрасте от 13 до 50 лет (в среднем 19 [16,75–26,75]). По данным морфологического исследования ткани биоптата почки выявлены: болезнь минимальных изменений – 1 (6 %) человек, мембранозная нефропатия – 2 (11 %), мезангиопролиферативный гломерулонефрит – 6 (33 %), фокально-сегментарный гломерулосклероз – 9 (50 %).
На основании проведенного исследования гена NPHS2 было выделено 12 полиморфизмов. Среди них наиболее частыми оказались мутации rs1410592 – у 66 % обследованных пациентов (12 человек), и rs1410591 – у 50 % (9 человек). Остальные мутации выявлялись реже и в основном в сочетании с двумя отмеченными выше: rs1079291 – у 22 % (4 пациента), IVS5+69T>A – у 17 % (3 пациента), rs1079292 – у 11 % (2 пациента), IVS7+7AG – у 11 % (2 пациента), glu87term – у 11 % (2 пациента), rs12401708 – у 11 % (2 пациента), rs61747728 – у 5,5 % (1 пациент), rs3738423 – у 5,5 % (1 пациент), rs2274624 – у 5,5 % (1 пациент), rs3818587(L346L) – у 5,5 % (1 пациент).
У каждого обследованного пациента выявлено от 1 до 5 мутаций (табл. 2).
4. Сравнение спектров мутаций гена NHРS2 в различных возрастных группах
Из 18 пациентов 1-й группы, которым проводилось генетическое обследование, 9 человек имели возраст до 18 лет включительно (средний возраст – 16,0 ± 0,6; 5 мужского и 4 женского пола) и 9 человек были старше 18 лет (средний возраст – 31,0 ± 3,7; 4 мужского и 5 женского пола).
При сравнении спектров мутаций у пациентов старше 18 лет и пациентов до 18 лет не получено достоверных различий. Несмотря на отсутствие статистической значимости, частые мутации rs1410591 и rs1410592 доминировали у пациентов старше 18 лет. Из оставшихся редких мутаций 5 выявлено только у пациентов детского возраста (rs1079292, glu87term, rs12401708, rs3738423, rs2274624), 3 – у пациентов как моложе, так и старше 18 лет (rs1079291, IVS5+69T>A, IVS7+7AG), 2 – только у пациентов старше 18 лет (rs3818587(L346L), rs61747728).
Статистических различий в структуре морфологических диагнозов не отмечено. При сравнении групп пациентов по лабораторным критериям НС не выявлено достоверных различий в сывороточных уровнях альбумина, общего белка, общего холестерина, уровне СПУ, а также длительности НС.
5. Сопоставление пациентов с резистентным НС и значимыми мутациями в гене NPHS2 с пациентами без значимых мутаций в гене NPHS2 и ответившими на стандартную иммуносупрессивную терапию
При генетическом исследовании, выполненном пациентам 1-й группы, было отмечено, что наиболее часто выявляемые мутации rs1410591 и rs1410592 сочетаются у 9 из 18 обследованных, причем у 4 из них спектр был представлен только этими двумя полиморфизмами. Для уточнения роли сочетания этих мутаций в развитии резистентного НС больные 1-й группы были разделены на следующие подгруппы: 1А – пациенты с сочетанием мутаций rs1410591 и rs1410592 (n = 9), 1Б – пациенты с другими мутациями (n = 9), 1В – пациенты, которым не проводилось генетическое исследование (n = 9). Больные групп 1А, 1Б, 1В достоверно не отличались от таковых 2-й группы по длительности НС (24 [24–48], 36 [24–54], 36 [12–57] и 24 месяца [12–48] соответственно в группах 1А, 1Б, 1В, 2; р > 0,05), СКФ (74 [56–128,5], 88 [33,5–156,5], 48 [40,5–88,5] и 81 мл/мин [46–92] соответственно в группах 1А, 1Б, 1В, 2, р > 0,05) и уровням сывороточного креатинина (1,1 [0,55–1,36], 0,9 [0,59–2,37], 1,7 [0,9–2], 1 мг/дл [0,8–1,4] соответственно в группах 1А, 1Б, 1В, 2, р > 0,05) (табл. 3).
При попарном сравнении групп пациентов по критериям НС основные отличия были получены только между группами 1А и 2, а также 1Б и 2 (табл. 3). Больные группы 1А по сравнению с группой 2 имели более низкие сывороточные уровни альбумина (2,5 [1,8–3,5] и 3,8 г/дл [2,9–4,1] соответственно), общего белка (4,6 [4,1–5,3] и 6,2 г/дл [5,3–6,5] соответственно) и более высокую СПУ (5 [3,4–7,4] и 2 г/сут [0,46–4,6] соответственно) (табл. 3, р < 0,05). В группе 1Б также отмечены достоверные отличия по сравнению с группой 2 в сывороточном уровне общего белка (5 [3,6–5,6] и 6,2 г/дл [5,3–6,5], р = 0,005 и р = 0,02 в группах 1А и 1Б соответственно по сравнению с группой 2), которые были выражены в меньшей степени, чем в группе 1А, при сравнимом с группой 1А уровне СПУ (5 [4–12,35], 5 [4–12,35] и 2 г/сут [0,46–4,6] соответственно в группах 1А, 1Б и 2) (табл. 3). Группа 1Б не имела статистически значимых отличий от группы 2 по сывороточным уровням альбумина (2,48 [2,26–3,69] и 3,8 г/дл [2,9–4,1] соответственно, р > 0,05) (табл. 3).
Группы 1А и 1Б достоверно не отличались от пациентов 2 группы по уровням общего холестерина сыворотки (361 [284–392], 349 [222–690] и 268 мг/дл [217–376] соответственно в группах 1А, 1Б, 2; р > 0,05), но при этом в анамнезе в обеих группах чаще регистрировались нарушения липидного обмена (в 67 % [6 пациентов из 9] случаев в группах 1А и 1Б по сравнению с 4 % [1 пациент из 27] случаев в группе 2, р < 0,05) (табл. 3).
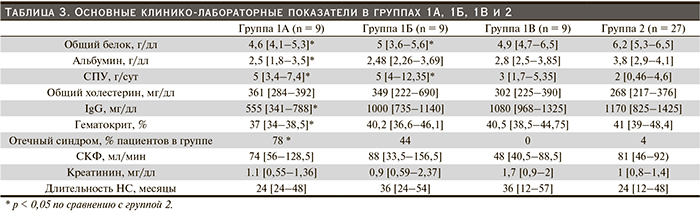
В дополнение к лабораторным сдвигам в группе 1А в качестве клинического критерия НС чаще отмечался отечный синдром – в 78 % (7 пациентов из 9) случаев, в то время как в группе 1Б в 44 % (4 пациента из 9), в группе 1В в 0 %, а во 2 группе только в 4 % (1 пациент из 27) случаев. Склонность к задержке жидкости также подтверждалась более низким гематокритом у пациентов группы 1А по сравнению с остальными группами.
Кроме того, степень снижения уровней IgG в сыворотке крови была обратно пропорциональной величине СПУ (табл. 3).
Следует отметить, что группа 1В не отличалась от группы 2 по сывороточным уровням общего белка, альбумина, общего холестерина, IgG, величине СПУ и гематокриту (р > 0,05, табл. 3).
При сравнении групп пациентов по объему лечения выявлено, что наиболее часто альтернативные виды терапии назначались в группах 1А (в 78 % случаев – 7 пациентов из 9) и 1Б (в 78 % случаев – 7 пациентов из 9), чем пациентам групп 1В (в 22 % случаев – 2 пациентов из 9) и 2 (в 30 % случаев – 8 пациентов из 27) (р < 0,05).
Обсуждение
Анализ особенностей проведенной терапии в нашем исследовании показал, что больные в обеих группах были сопоставимыми по объему проведенной патогенетической стандартной иммуносупрессивной и нефропротективной терапии. Обращает на себя внимание то, что больные, резистентные к стандартной иммуносупрессивной терапии, получали ГКС внутрь в течение более длительного периода времени и большие дозы ГКС внутривенно. Этот факт позволяет подтвердить, что отсутствие ответа на стандартную иммуносупрессивную терапию, по-видимому, не связано с недостаточной длительностью лечения и/или низкой дозой ГКС. Таким образом, исходя из особенностей клинических характеристик групп, больные ХГН с НС, резистентным к стандартной иммуносупрессивной терапии, независимо от длительности заболевания, морфологического варианта и объема лечения по сравнению с больными, чувствительными к стандартной иммуносупрессивной терапии, клинически характеризуются более выраженным НС. В то же время не выявлено существенных различий в функциональном состоянии почек и уровне электролитов между указанными группами пациентов.
Результаты проведенных в 2008 г. молекулярных исследований M. Lowik et al. [13] показали центральную роль поражения генетического аппарата подоцитов в развитии НС (в частности, при фокально-сегментарном гломерулосклерозе). Установлено, что увеличение количества аномальных белков, синтезируемых подоцитами, формирующих структуры щелевой диафрагмы (нефрин, подоцин, CD2АР) и/или играющих роль в функции цитоскелета подоцита (альфа-актин-4), служат причиной нарастания протеинурии.
По данным проведенного генетического исследования у пациентов группы 1 выявлены мутации гена подоцина. Многие варианты НС у пациентов детского возраста, в т.ч. резистентного к стандартной иммуносупрессивной терапии, связаны с геном подоцина (NPHS2). В литературе имеются сообщения о более чем 30 мутациях в данном гене, которые в основном приводят к развитию аутосомно-рецессивного стероидрезистентного НС [14].
В работе A. Koziell et al. [15] показано, что измененный ген спорадически встречается и у взрослых пациентов с резистентным НС. При сравнении пациентов разных возрастных групп с наличием мутаций в гене NPHS2 нами не отмечено достоверных различий в спектрах мутаций. Тем не менее группа пациентов до 18 лет отличалась от группы пациентов старше 18 лет по наиболее часто встречаемым мутациям. С учетом отсутствия разницы между указанными группами больных в клинической картине заболевания наиболее вероятной ролью выявленных нами часто встречающихся мутаций служит не влияние непосредственно самих мутаций на клинико-лабораторные особенности нефрита, а возраст пациента на момент дебюта НС.
Зависимость возраста пациента, в котором дебютирует НС, от наличия мутаций в NPHS2, в т.ч. с комбинацией миссенс-мутаций, продемонстрирована в исследовании B. Hinkеs et al. [16]. В 404 семейных случаях стероидрезистентного НС в 18,1 % (73 случая) выявлены мутации гена подоцина по рецессивному типу наследования, среди которых 69,9 % были представлены гомозиготной мутацией R138Q. Возраст дебюта НС у 392 пациентов варьировался от 0 до 21 года.
У 78 пациентов было выявлено две патологические мутации в гене NPHS2, обусловившие более ранний дебют НС. Наличие гомозиготной мутации R138Q стало причиной дебюта НС в возрасте до 6 лет в 98,2 % случаев.
В нашем исследовании аминокислотная замена R138Q не была обнаружена. Возможно, это связано с особенностями выборки больных стероидрезистентным НС. Полтавец и др. [17] исследовали ген NPHS2 у 21 ребенка и также не выявили никаких полиморфизмов этого гена. Полученные нами ранее данные показывают, что у детей с НС, резистентным к стандартной иммуносупрессивной терапии, нуклеотидная замена G755A (R229Q) встречается достоверно чаще по сравнению с группами стероидчуствительных и здоровых детей [11].
В настоящей работе мутация R229Q у взрослых пациентов была обнаружена только в одном случае.
По данным анализа спектров мутаций нами установлено, что пациенты с ХГН и НС, резистентным к стандартной иммуносупрессивной терапии, независимо от возраста имеющие сочетание двух наиболее распространенных мутаций rs1410592 и rs1410591, отличались от других больных этой группы более тяжелым течением НС. Еще одной выявленной клинической особенностью обследованных пациентов с сочетанием указанных мутаций стала частота развития отечного синдрома, что косвенно свидетельствует о большей выраженности протеинурии и гипоальбуминемии. По-видимому, комбинированные дефекты в подоцитарных генах могут усиливать тяжесть заболевания и ослаблять эффективность разработанных методов лечения, что подтверждается данными литературы [18].
Кроме того, комбинация мутаций более чем в одном подоцитарном гене может служить важным этиологическим фактором развития заболевания почек [19]. В частности, скрещивание мышей, гетерозиготных по CD2AP и синаптоподину, приводило к спонтанному развитию протеинурии и ФСГС-подобным повреждениям гломерулярного аппарата. Следует отметить, что каждая мутация в отдельности не приводит к развитию нефрита [20]. Значение комбинации мутаций в развитии нефрита также установлено в наблюдении за группой пациентов с несемейным ФСГС с дебютом в детском возрасте.
У одного из больных этой группы была описана гетерозиготная мутация NPHS2 в сочетании с CD2AP [13].
Таким образом, обнаруженные в нашем исследовании мутации гена подоцина rs1410592 и rs1410591 могут с высокой степенью вероятности играть ключевую роль в возникновении и персистировании НС, резистентного к стандартной иммуносупрессивной терапии. В свою очередь уточнение патогенетической и прогностической роли этих мутаций позволит оптимизировать тактику обследования и ведения больных ХГН с НС и совершенствовать в перспективе подходы к преодолению терапевтической резистентности.
Дальнейшее изучение мутаций в генетическом аппарате подоцитов позволит определить другие белки, играющие ключевую роль в нарушении фильтрационной функции гломерулярного барьера и в патогенезе НС у человека. Хотя развитие нефрита нельзя полностью связать с выявленными генетическими аномалиями, знание особенностей течения заболевания у больного с наличием мутаций важно для определения дальнейшей тактики ведения пациентов [21]. Уточнение функциональных особенностей подоцитов приведет к объяснению эффектов лекарственной терапии, используемой для лечения гломерулонефритов. Показано, что большинство лекарственных средств, применяемых при НС, обладают прямым действием на подоциты (ГКС [22], ингибиторы ангиотензин-превращающего фермента [23], ингибиторы циклооксигеназы-2 [24], ингибиторы синтеза нуклеотидов [25], ингибиторы кальцинейрина [26]). В частности, антипротеинурический эффект циклоспорина, приписываемый иммуносупрессивному действию, может быть также объяснен стабилизацией актинового цитоскелета подоцита. Циклоспорин предотвращает катепсин-1-опосредованную деградацию синаптоподина – важного регулятора подоцитарной функции [27]. Данная концепция была разработана сравнительно недавно при изучении эффективности циклоспорина в лечении ФСГС [26].
Заключение
Вероятными причинами развития ХГН с НС и/или его исходной резистентности к стандартной иммуносупрессивной терапии больных могут служить выявленные нуклеотидные замены в гене NPHS2. Выполнение генетического анализа становится особенно актуальным в группе больных резистентным НС и морфологическими формами нефритов, как правило, поддающимися стандартной иммуносупрессивной терапии.
Полученные в нашей работе данные еще раз показывают необходимость дальнейшего изучения молекулярно-генетических закономерностей формирования почечного процесса и его резистентности к стандартным схемам иммуносупрессивной терапии больных ХГН, а также важность внедрения генетического консультирования пациентов. Персонифицированный подход к определению тактики ведения пациентов в подобных случаях наряду с результатами морфологического исследования ткани биоптата позволит индивидуализировать иммуносупрессивную терапию, в частности, своевременно отказаться от применения традиционных ее схем в пользу альтернативных, включающих инновационные лекарственные препараты.
Выводы
1. Больные ХГН с НС, резистентным к стандартной иммуносупрессивной терапии, независимо от длительности заболевания, морфологического варианта и объема лечения по сравнению с больными, чувствительными к стандартной иммуносупрессивной терапии, клинически характеризуются большей выраженностью НС (величиной СПУ, степенью белковых нарушений, сдвигом в липидном обмене и частотой развития отечного синдрома), отсутствием существенных различий в функциональном состоянии почек и уровне электролитов.
2. Среди больных ХГН с НС (взрослых и подростков), резистентным к стандартной иммуносупрессивной терапии, выявляются различные мутации в гене подоцина; наиболее часто обнаруживаются rs1410592 (у 66 %) и rs1410591 (у 50 %), остальные мутации – rs1079291, IVS5+69T, rs1079292, IVS7+7AG, glu87term, rs12401708 – значительно реже (соответственно у 22 %, 16 и 11%); rs38185887, rs61747728, rs3738423, rs2274624 – как единичные находки.
3. Больные ХГН с НС, резистентным к стандартной иммуносупрессивной терапии, независимо от возраста имеющие сочетание двух наиболее распространенных мутаций rs1410592 и rs1410591, отличаются от других больных этой группы более тяжелым течением НС.



