Введение
Наследственные и врожденные заболевания органов мочевой системы являются одной из основных причин развития хронической почечной недостаточности (ХПН) у детей, предоставляя тем самым серьезную проблему здравоохранения во всем мире. В России они составляют 71 % всех причин ХПН
в детском возрасте [1].
Среди моногенно-наследуемых нефропатий особое место занимает наследственный нефрит [синдром Альпорта] (СА) – генетически детерминированная неиммунная гломерулопатия, протекающая с гематурией, прогрессирующим снижением почечных функций, сочетающаяся с патологией слуха и зрения, являющаяся причиной развития ХПН – нередко уже в детском возрасте.
В России, по данным эпидемиологического обследования, проведенного в 1970–1980-е гг. в детской популяции, частота СА составляла 17 : 100000 [2]; в мире – 1 : 5000 населения. В европейских странах 0,6 % случаев ХПН связаны с СА, 2,3 % трансплантаций почки приходится на долю больных с этой патологией [3]. В России в силу экономических и социальных причин заместительная почечная терапия доступна не всем больным с ХПН. Кроме того, несмотря на значительный прогресс в диализе и трансплантации, прогноз для детей с ХПН все еще остается весьма серьезным, т. к. отмечены высокая
частота сопутствующих заболеваний и низкий уровень качества жизни больных на диализе.
Таким образом, очевидно, что важнейшей задачей, которую призвано решить мировое нефрологическое сообщество, является предупреждение или отдаление сроков возникновения ХПН.
Успех современной нефропротекции в значительной мере определяется своевременностью ее начала. Влияние факторов прогрессирования нефропатий может начинаться достаточно рано в условиях функциональной компенсации, даже при сохранной массе действующих нефронов, и продолжаться на
всем протяжении заболевания. Естественно, устранение таких факторов способствует замедлению прогрессирования болезни уже на ее ранней стадии – еще при сохранном функциональном состоянии почек.
При СА вследствие неполноценности базальных мембран клубочковых капилляров появляется протеинурия (ПУ), роль которой в прогрессировании хронической болезни почек (ХБП) доказана. Дальнейшее прогрессирование СА происходит по закономерностям, определенным В.Brenner et al. еще в начале 1980-х гг. В оставшихся менее поврежденных клубочках развивается гиперфильтрация, что вызывает нарастание ПУ, активизируется ренин-ангиотензин-альдостероновая система (РААС), усиливается продукция цито- и хемокинов, а также факторов роста. Все это приводит к усилению процессов склероза в почечной ткани, появлению креатининемии и прогрессирующему снижению скорости клубочковой фильтрации (СКФ).
В настоящее время существенную роль в лечении пациентов с хроническими прогрессирующими нефропатиями отводят ингибиторам ангиотензин-превращающего фермента (иАПФ). Лекарственные препараты, снижающие активность РААС, – иАПФ и блокаторы рецепторов к ангиотензину
II (АТII) 1-го типа (БРА) пытаются применять и при СА; накоплен опыт применения этих препаратов и на экспериментальных моделях. Так, K.M. Grodecki et al. (1997) показали на модели собак-самоедов с Х-сцепленным вариантом СА, что раннее назначение иАПФ не влияет на сроки появления ПУ, но тормозит развитие ХПН [4]. O. Gross et al. (2003) показали, что назначение терапии, направленной
на торможение активности ренин-ангиотензиновой системы (РАС), у трансгенных мышей с аутосомно-рецессивным вариантом СА до появления ПУ отодвигает сроки появления ПУ, уменьшает степень ПУ при ее наличии, тормозит развитие почечной недостаточности и увеличивает продолжительность жизни животных. В качестве терапии они использовали иАПФ (рамиприл) или БРА (кандесартан).
Отмечено снижение активности фиброгенных факторов (трансформирующего фактора роста – TGFβ, связанного тканевого фактора роста, металлопротеиназ и белков экстрацеллюлярного матрикса). В меньшей степени эффект был выражен у гипертензивных мышей и при появлении уремии. Более выраженный эффект получен при использовании рамиприла, что авторы расценивают как возможность иАПФ тормозить провоспалительную, профибротическую активность рецепторов АТII 2-го типа [5].
В литературе имеются немногочисленные данные об использовании иАПФ с нефропротективной целью при СА у детей. Так, в 2002 г. L. Adler et al. [6] получили значительное уменьшение TGFβ на фоне 14-дневного приема эналаприла (0,2 мг/кг/с) 11 пациентами с СА (возраст детей был меньше 10 лет). Существенного влияния на степень ПУ, величину АД и уровень СКФ получено не было.
W. Proesmans et al. опубликовали результаты исследования 10 пациентов с СА в возрасте от 3 до 14 лет, получавших терапию эналаприлом (0,24–0,49 мг/кг/с). Результаты 2-летнего исследования были представлены в 2000 г. [7]; 5-летнего наблюдения – в 2004-м [8]. Было показано, что в течение
первых 1,5 лет терапии в группе был получен выраженный антипротеинурический эффект, когда ПУ уменьшилась с 48 до 14 мг/кг/24 ч, однако в дальнейшем она вновь увеличилась, достигнув плато между 30 и 40 мг/кг/24 ч после 3 лет терапии и оставалась на этом уровне до конца наблюдения. Кроме того, был проведен анализ антипротеинурической эффективности иАПФ в зависимости от уровня ПУ на момент начала терапии. Более выраженный и стойкий эффект получен среди детей с
ПУ < 50 мг/кг/24 ч. СКФ в целом по группе через 5 лет терапии оставалась стабильной, хотя у одного пациента за время наблюдения развилась ХПН.
H. Kaito et al. (2006) представили результаты 18-месячного наблюдения, где был получен хороший антипротеинурический эффект при добавлении к терапии антагониста альдостерона спиронолактона для 5 детей с СА, имевших до начала этого исследования ПУ, резистентную к терапии иАПФ, или сочетанной терапии иАПФ и БРА. После 18 месяцев данного исследования у всех детей СКФ оставалась стабильной и не отмечалось значимого повышения уровня калия крови (> 5,0 мЕэкв/л). В связи с этим авторы считают целесообразным использование спиронолактона в сочетанной терапии иАПФ и/или БРА детей с СА в случаях резистентной к терапии ПУ [9].
Таким образом, эффективность, показания и сроки терапии иАПФ больных СА остаются до конца неопределенными. Целью настоящего исследования стала оценка ренопротективной эффективности иАПФ у детей с СА.
Материал и методы
В исследование были включены 22 ребенка (17 мальчиков и 5 девочек) с СА в возрасте от 8 до 15 лет к моменту начала терапии/наблюдения. Средний возраст детей на момент начала исследования составил 10,13 ± 0,57 года. Общая длительность катамнестического наблюдения – 5,25 ± 0,63 года: 3,22 ± 0,45 года до начала исследования и 2,03 ± 0,28 – на терапии/наблюдении. Прогрессирующее течение СА отмечено у 12 пациентов (54,5 %, все мальчики); у пятерых из них (41,7 % детей с прогрессирующим течением СА) к концу исследования уже определились признаки ХПН.
Известно, что ренопротективная эффективность иАПФ оценивается по наличию антипротеинурического, антигипертензивного эффектов и по динамике СКФ (непосредственно
ренопротективный эффект). Мы оценивали ренопротективную эффективность (в дальнейшем “эффективность”) иАПФ у детей с СА по динамике ПУ (в дальнейшем “антипротеинурический эффект”) и СКФ (в дальнейшем “ренопротективный эффект”). Оценка антигипертензивного эффекта иАПФ в
данном исследовании не проведена из-за малочисленности больных с артериальной гипертензией (АГ), выявленной методом Короткова (3/22 детей), и отсутствия достаточного количества данных АД в динамике при СМАД (5/22).
В исследовании использовались следующие понятия:
• прогрессирующее течение СА – снижение СКФ на 15 мл/мин и более в год;
• “скачок” ПУ – выраженное увеличение ПУ (мг/кг/24 ч) за год на 50 % и более от исходного уровня;
• “стабильная” ПУ – ПУ, которая не увеличивалась в течение 1,5 лет и более;
• “раннее” начало терапии иАПФ – когда иАПФ назначались в первые 3 года после “скачка” ПУ;
• “позднее” начало терапии иАПФ – когда иАПФ назначались через 3 года и более от “скачка” ПУ;
• “выраженный” антипротеинурический эффект – уменьшение ПУ на 20 % и более в год от исходного уровня;
• “частичный” антипротеинурический эффект – прекращение увеличения ПУ и/или замедление увеличения ПУ за время наблюдения по сравнению с динамикой ПУ до начала терапии иАПФ;
• ренопротективный эффект – увеличение СКФ, прекращение снижения СКФ, замедление снижения СКФ (на 30 % и более по сравнению с динамикой СКФ до начала терапии);
Все дети были распределены на 2 группы: I группа (n = 14; 12 мальчиков и 2 девочки) получала терапию иАПФ; II (n = 8; 5 мальчиков и 3девочки) – иАПФ не получала.
Показанием к началу терапии иАПФ считали ПУ ≥ 500 мг/24 ч, увеличение ПУ (мг/кг/24 ч) за год на 50 % и более от исходного уровня, снижение СКФ в динамике на 10 % и более в год. Группа без терапии (группа сравнения) появилась в связи с отказом пациентов (или их родителей) от лечения иАПФ. Достоверных различий в группах по полу, возрасту и длительности наблюдения (от момента начала терапии) не было. Однако в I группе детей с прогрессирующим течением СА было почти в 2 раза больше и ПУ у них была достоверно больше, чем во II группе (табл. 1).
Таблица 1. Клинические особенности течения СА у детей до начала терапии иАПФ/наблюдения.
В качестве ренопротективных препаратов использовались иАПФ короткого (каптоприл; 0,4–0,85 мг/кг/с) и длительного (эналаприл; 0,03–0,11 мг/кг/с) действия. У больных оценивали в динамике:
• суточную протеинурию (г/24 ч и мг/кг/24 ч) на анализаторе “Biosystems BTS-330” (BIOSYSTEMS, Испания);
• уровень сывороточного креатинина и холестерина крови на анализаторе “Humastar180” (HUMAN, Германия);
• ультразвуковую картину почек с частотой 1 раз в год на аппаратах для ультразвукового сканирования ALOKA SSD-5500; Aloka Co.LTD (Япония);
• расчет СКФ проводили по формуле Шварца;
Для математической обработки данных использованы методы непараметрической статистики.
Результаты и обсуждение
При оценке антипротеинурической эффективности иАПФ среди детей с СА 2/14 пациентов на терапии иАПФ были исключены из анализа в связи с развитием у них ХПН за время наблюдения. Оценить антипротеинурический эффект иАПФ у детей не представилось возможным, т. к. уменьшение ПУ в этом случае было, вероятнее всего, связано со снижением СКФ, а не с эффективностью иАПФ. Таким образом, динамика ПУ оценивалась у 20/22 детей.
На момент начала исследования средний уровень ПУ в I группе был почти в 4,7 раз выше, чем у пациентов, наблюдавшихся в дальнейшем без лечения. За время наблюдения более чем у 75 % больных на терапии иАПФ был получен антипротеинурический эффект, что оказалось достоверно чаще, чем во II группе. При этом у половины детей, получавших иАПФ, антипротеинурический эффект был “выраженным”. Кроме этого еще у 25 % детей I группы получен “частичный” эффект. В динамике нарастание ПУ определено в обеих группах, однако чаще это выявлялось во II группе и скорость увеличения ПУ (мг/кг/24 ч) у детей II группы была в 2 раза выше, чем у пациентов на терапии
(р > 0,05) (табл. 2).
Оценка динамики ПУ проводилась также отдельно среди детей с прогрессирующим и непрогрессирующим течением СА. У пациентов с прогрессирующим течением заболевания на момент начала исследования уровень ПУ был в 3 раза выше, чем у детей I группы (I группа – 4,29 ± 0,88 г/24 ч; II группа – 1,33 ± 1,07 г/24 ч; р > 0,05). Несмотря на это, антипротеинурический эффект отмечен только у пациентов на терапии иАПФ (р < 0,01), и он получен более чем у половины (55,5 %) больных.
В отличие от этого, у всех пациентов, не получавших лечения иАПФ, за время наблюдения отмечено нарастание уровня ПУ. В динамике в обеих группах детей с прогрессирующим течением заболевания достоверных различий в степени нарастания ПУ не получено (I группа – +19,8 % в год; II группа – +17,3 % в год; р > 0,05). Однако уменьшение протеинурии отмечено только среди детей I группы (I группа – 33,3 %; II группа – 0 %; р > 0,05) (рис. 1).
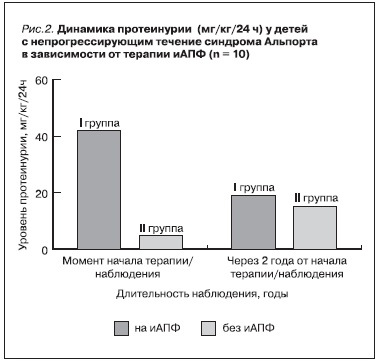
Среди пациентов с непрогрессирующим течением СА мы смогли оценить динамику ПУ только за время терапии/наблюдения, т. к. у большинства из них достоверных данных о динамике ПУ до начала данного исследования не имелось. В группе пациентов на терапии иАПФ уменьшение ПУ отмечалось в 3 раза чаще, чем у детей без лечения (I группа – 60 %; II группа – 20 %; р > 0,05). Только среди детей с непрогрессирующим течением СА на терапии иАПФ определено уменьшение среднего уровня ПУ (рис. 2), причем разница в динамике ПУ в зависимости от наличия терапии иАПФ была достоверной
(I группа – -31,3 % в год; II группа – +127,9 % в год; p < 0,01).
Таблица 2. Динамика протеинурии у детей с СА на терапии иАПФ и без нее (n = 20).
Таким образом, полученные результаты позволяют говорить о возможности получения антипротеинурического эффекта при использовании иАПФ детьми с СА: так, у половины детей, находившихся на лечении иАПФ, получено значимое (> 20 % в год) снижение уровня ПУ в динамике, причем это определялось у пациентов как с прогрессирующим, так и с непрогрессирующим течением заболевания. При этом среди пациентов с непрогрессирующим течением СА этот эффект был более выраженным. Кроме того, среди детей с прогрессирующим течением НН получено достоверное уменьшение частоты нарастания ПУ, а также отмечены случаи стабилизации ПУ, что также важно в замедлении дальнейшего прогрессирования заболевания.
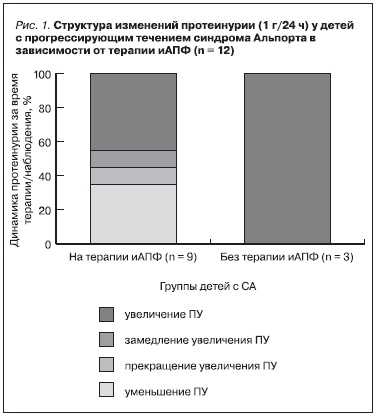
Учтя результаты, полученные в исследовании W. Proesmans et al. (2004), нами проведен анализ динамики ПУ на терапии иАПФ в зависимости от ее уровня на момент начала исследования: среди 6/12 детей она была > 50 мг/кг/24 ч, у 6/12 – < 50 мг/кг/24 ч. Антипротеинурический эффект получен в обеих подгруппах без достоверной разницы, однако у пациентов с ПУ < 50 мг/кг/24 ч уменьшение ПУ на терапии определялось в 2 раза чаще, чем среди детей с ПУ нефротического уровня (66,7 и 33,3 %, р > 0,05). При этом более выраженное уменьшение ПУ (30–50 % в год от исходного уровня) выявлено только у пациентов с ПУ < 50 мг/кг/24 ч (50 и 0 % соответственно; р < 0,05).
В качестве терапии использовались иАПФ как короткого, так и длительного действия. В связи с этим проведен сравнительный анализ антипротеинурической эффективности в зависимости от препарата. Достоверных различий не получено. Однако уменьшение ПУ на терапии эналаприлом отмечено в 2,5 раза чаще (у 5/8 детей; 62 %), чем при использовании каптоприла (у 1/4 детей; 25 %).
Дозы каптоприла для всех детей, получавших этот препарат, не различались. Среди пациентов, получавших эналаприл, 2/8 принимали его в дозе 0,03–0,05 мг/кг/с (у обоих ПУ была < 50 мг/кг/24 ч), 6/8 – в дозе 0,08–0,11 мг/кг/с (у четверых из них ПУ > 50 мг/кг/24 ч). У обоих детей на минимальной
дозе эналаприла получен антипротеинурический эффект, у пациентов, получавших эналаприл в больших дозах, антипротеинурический эффект отмечен в 83,3 % случаев (5/6), в т. ч. у 3 детей с ПУ нефротического уровня (у двоих “выраженный” и у одного “частичный” эффект). Возможно, у пациентов с “частичным” эффектом и отсутствием антипротеинурического эффекта дозы эналаприла были недостаточными. Необходимо продолжить наблюдение с использованием по возможности доз эналаприла, сравнимых с примененными в исследовании W. Proesmans и его коллег.
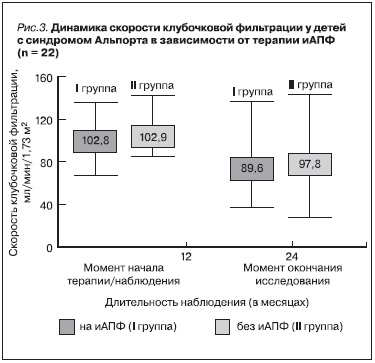
По уровню клиренса сывороточного креатинина на момент начала наблюдения группы детей, получавших и не получавших терапию, практически не различались. Не получено достоверных отличий и через 2 года наблюдения (рис. 3).
Стабильная СКФ выявлена в обеих группах без достоверной разницы (64,3 и 62,5 % соответственно, р > 0,05). При этом снижение СКФ в I группе отмечено несколько реже, чем в группе без лечения (21,4 и 37,5 % соответственно, р > 0,05). Кроме того, в I группе в ряде случаев в динамике выявлено
замедление снижения СКФ (16,7 и 0 %, р > 0,05).
Ренопротективный эффект иАПФ оказался наиболее выраженным в группе детей с прогрессирующим течением CА. Среди них стабилизация СКФ отмечена только у детей, лечившихся иАПФ. В этой группе пациентов снижение СКФ определялось в 3 раза реже и оно происходило в 1,7 раз медленнее, чем в
группе детей без терапии (табл. 3).
Проведен анализ динамики СКФ на терапии иАПФ в зависимости от исходного уровня клиренса креатинина. Большинство (n = 12) детей на момент начала исследования имели 1-ю стабильной (т. е. ее колебания составляли менее 5 % в год), либо отмечалось ее снижение или увеличение. Достоверной разницы в зависимости от динамики СКФ до начала терапии не получено: при стабильной СКФ на момент начала терапии ренопротективный эффект определялся у 3/4 (75 %) пациентов, при увеличении СКФ – у 2/3 (66,7 %), при снижении СКФ – у 4/5 (80 %) детей.
Анализом эффективности проведенной ренопротективной терапии иАПФ установлено, что антипротеинурический эффект получен среди 75 % детей с СА, а ренопротективный эффект в отношении динамики СКФ получен среди 78,6 % пациентов. Выявлено, что антипротеинурический эффект терапии иАПФ достоверно чаще отсутствовал при стабильной, чем при нарастающей, ПУ (75 и 0 %, р < 0,01).
Отсутствие ренопротективного эффекта достоверно чаще (р < 0,01) выявлялось среди детей с уровнем холестерина в крови > 6,0 ммоль/л (4/4 детей; 100 %) на момент начала терапии.
Имели также значение сроки назначения иАПФ. В случае “позднего” начала терапии иАПФ ренопротективный эффект определялся в 3,5 раз реже, чем при “раннем” начале лечения (у 25 и 87,5 % соответственно; р < 0,01).
Кроме того, важной оказалась динамика на терапии иАПФ такого показателя ультразвуковой картины почек, как “эхогенность почечной паренхимы” в течение 1-го года терапии: у всех детей с увеличением эхогенности отмечено отсутствие ренопротективного эффекта иАПФ в отличие от пациентов со стабильной эхогенностью паренхимы почек в динамике (4/4 и 0/6 соответственно; р < 0,01).
Рисунок 4. Влияние раннего назначения иАПФ на замедление прогрессирования синдрома Альпорта у детей (n=19).
Таблица 3. Динамика СКФ у детей с прогрессирующим течением СА на терапии иАПФ и без нее.
Таблица 4. Предикторы отсутствия эффекта (антипротеинурического и ренопротективного)
от терапии иАПФ у детей с СА.
Таблица 5. Влияние раннего назначения терапии иАПФ на ее эффективность и исходы СА
у детей с прогрессирующим течением заболевания (n = 9).
Полученные результаты позволили нам рассматривать стабильную протеинурию, высокий уровень холестерина крови (> 6 ммоль/л) на момент начала терапии, “позднее” начало лечения и нарастание эхогенности почечной паренхимы при УЗИ в первый год терапии как предикторы отсутствия эффективности иАПФ у детей с СА (табл. 4).
Сроки назначения терапии иАПФ имеют особо важное значение в случае прогрессирующего течения СА: в случае “раннего” начала терапии более чем у 80 % детей отмечена стабилизация СКФ. К концу наблюдения ни у одного из этих пациентов не определялась креатининемия. В отличие от них, ренопротективный эффект от терапии иАПФ при “позднем” назначении препарата определялся в 5 раз реже. У двоих детей с прогрессирующим течением заболевания и “поздним” началом лечения к концу наблюдения выявлена стойкая креатининемия (табл. 5).
Определено, что “раннее” назначение иАПФ позволяет существенно замедлять скорость снижения гломерулярной фильтрации при прогрессирующем течении СА. В отличие от этого, “позднее” назначение терапии не влияет на темп снижения СКФ – в динамике скорость падения гломерулярной фильтрации у них увеличивалась так же, как и у пациентов без терапии (рис. 4).
Таким образом, проведенное нами исследование показало высокую антипротеинурическую (75 %) и ренопротективную (78,6 %) эффективность терапии иАПФ у детей с СА, несмотря на малые дозы препаратов. Очевидно, что назначение иАПФ детям с СА показано непосредственно при появлении у них протеинурии; при этом удается добиваться максимального антипротеинурического эффекта, тормозить прогрессирование СА и поддерживать должные величины клубочковой фильтрации. Умеренное снижение почечных функций (СКФ ≥ 60 мл/мин/1,73 м2) не является противопоказанием к назначению терапии иАПФ. Начало терапии в эти сроки в большинстве случаев способствует стабилизации клубочковой фильтрации, замедляет прогрессирование заболевания и развитие ХПН.
Для лечения СА предпочтительнее использовать иАПФ длительного действия.
Своевременное выявление предикторов отсутствия эффективности иАПФ среди детей с СА позволяет с большей точностью прогнозировать эффективность иАПФ. Вопрос о дозировании иАПФ у детей с СА в настоящее время остается открытым и требует проведения дальнейших исследований. По-видимому, детям с невысокой ПУ достаточны минимальные дозы иАПФ, что особенно важно при наличии артериальной гипотензии и/или склонности к ортостатической гипотензии. Целесообразным представляется увеличение доз иАПФ детям с полученным “частичным” антипротеинурическим и/или ренопротективным эффектом или при неэффективности проводимой терапии иАПФ; по возможности назначение более высоких доз эналаприла (до 0,3–0,4 мг/кг/с) новым пациентам, поступающим под наше наблюдение, с оценкой эффективности препаратов по динамике основных клинико-лабораторных показателей. При резистентности ПУ к иАПФ возможно присоединение спиронолактона.



