Сердечной недостаточностью страдают около 2% всего населения западных стран [1]. Декомпенсация кровообращения – одна из ведущих причин смерти от сердечно-сосудистых заболеваний. Кроме этого обращает на себя внимание высокая степень коморбидности пациентов, страдающих недостаточностью кровообращения. Одним из ведущих органов, который поражается у пациентов с хронической сердечной недостаточностью (ХСН), являются почки. Но, несмотря на это, практические врачи во всем мире редко задумываются над проблемой поражения почек у пациентов с ХСН. Так, по данным Y. Amsalem и соавт. [2], у 41% пациентов с декомпенсацией кровообращения поражение почек остается вне поля зрения врача.
Цель исследования – изучить распространенность поражения почек у пациентов с декомпенсацией кровообращения в российской популяции по данным двух регистров – ОРАКУЛ-РФ и Павловского регистра.
В исследование включены пациенты старше 18 лет, имевшие хроническую болезнь почек (ХБП), поступившие в стационар по поводу декомпенсации ХСН.
Материал и методы
 Павловский регистр формировался на базе Павловской больницы (ГКБ № 4) [3]. Павловский регистр был сформирован в 2009 г. Регистр включил 1001 пациента с декомпенсацией ХСН. Период наблюдения за включенными пациентами составил 30, 90, 180, 360 дней со дня выписки. Клиническая характеристика пациентов представлена в табл. 1.
Павловский регистр формировался на базе Павловской больницы (ГКБ № 4) [3]. Павловский регистр был сформирован в 2009 г. Регистр включил 1001 пациента с декомпенсацией ХСН. Период наблюдения за включенными пациентами составил 30, 90, 180, 360 дней со дня выписки. Клиническая характеристика пациентов представлена в табл. 1.
Регистр ОРАКУЛ-РФ формировался в 41 центре 20 городов РФ. Сроки выполнения – 2010–2011 гг. Набраны 2498 пациентов. Наблюдение за ними осуществлялось в течение года. После выписки из стационара состоялся визит или телефонный контакт на 30-й, 90-й, 180-й, 360-й день. Окончательному анализу доступны 2404 пациента. Связь с 94 пациентами на постгоспитальном периоде утеряна, что составило 3,76% от общего числа пациентов. Клиническая характеристика пациентов представлена в табл. 2.
Был проведен анализ баз данных Павловского регистра и регистра ОРАКУЛ-РФ с целью изучения следующих параметров: уровень креатинина, мочевины, альбуминурии и степень снижения СКФ у пациентов с декомпенсацией кровообращения. Кроме того, был проведен анализ смертности пациентов с ХБП.
Методы статистической обработки материала
Для статистической обработки полученных данных использовали программное обеспечение Statistica 10 и 6.1. Нормальность распределения определялась с помощью критерия Шапиро–Уилка. При изложении результатов пользовались методами непараметрической и параметрической статистики. Количественные показатели представлены в форме среднее значение (M)±стандартное отклонение (SD) или медиана, 25-й и 75-й процентили. Различия между несколькими несвязанными группами проверялись с помощью критерия Краскела–Уоллиса или критерий Фишера. Для выявления связей применялись общие линейные регрессионные модели. Проводился многофакторный анализ с помощью модели пропорциональных рисков Кокса. Анализ выживаемости оценивался с помощью метода Каплана–Мейера. Риск возникновения смерти оценивался по критерию отношения шансов, отношения рисков, коэффициента рисков. Статистически значимыми признавали значения р<0,05.
Результаты
Распространенность снижения почечной функции в регистрах
Анализируя распространенность снижения СКФ у пациентов с декомпенсацией ХСН по данным ОРАКУЛ-РФ, можно видеть, что только 16% имели СКФ>90 мл/мин/1,73 м2, а 28 и 33% можно было классифицировать как 1-ю и 2-ю стадии ХБП соответственно [4]. При анализе этой группы пациентов мы не можем говорить о том, что у всех из них была верифицирована ХБП, т.к. по данным регистра не были выявлены какие-либо другие маркеры поражения почек (в группе пациентов с ХБП 1-й стадии – 15%, в группе пациентов с ХБП 2-й стадии – 19%). Прежде всего выявлялась альбумин/протеинурия.
В группе ХБП 1-й стадии уровень альбуминурии составил: А1 – 9%, А2 – 2%, тогда как в группе с ХБП 2-й стадии: А1 – 11%, А2 – 6%, А3 – 4%. Ультразвуковые критерии повреждения почки сильно варьировались в зависимости от центра, в связи с этим было принято решение анализировать только один маркер по данным УЗИ – сморщивание почек. В группе пациентов с ХБП 1-й стадии у 13% была выявлена сморщенная почка, в группе с ХБП 2-й стадии – 9 %. СКФ<60 мл/ мин/1,73 м2 была выявлена у 23% пациентов, из них ХБП 3а–3б встречалась в 20% случаев, ХБП 4-й стадии – в 2% и в 1% случаев – ХБП 5-й стадии.
По мнению исследователей, поражение почек у пациентов, включенных в регистр ОРАКУЛ-РФ, было в 17% случаев, тогда как СКФ<60 мл/мин/1,73 м2, как уже говорилось выше, встречалось в 23%. Причиной гиподиагностики почечной дисфункции было субклиническое протекание ХБП. Так, у 47% пациентов присутствовали изменения почек по данным УЗИ (сморщивание почек) и протеинурия более 1 грамма белка в сутки у 24% пациентов.
Анализ данных Павловского регистра показал, что 47% включенных пациентов имели СКФ>60 мл/мин/1,73 м2, из них только 6% имели уровень альбуминурии А1 и 14% уровень альбуминурии А2; сморщенная почка, по данным УЗИ, оказалась у 12% пациентов. СКФ<60 мл/мин/1,73 м2 имели 52% пациентов, при этом СКФ<30 мл/мин/1,73 м2 была у 14% включенных в регистр и только у 1% пациентов СКФ<15 мл/мин/1,73 м2, при этом на этапе стационарного лечения ни одному пациенту не понадобилось проведения заместительной почечной терапии. У пациентов с СКФ<30 мл/мин/1,73 м2 в два раза чаще встречались рефрактерные отеки, и средняя доза фуросемида для этой группы пациентов составляла 140±34 мг; кроме того, продолжительность отечного синдрома была значительно выше и составляла в средним на 4 дня больше, чем у пациентов с СКФ>60 мл/мин/1,73 м2. Первично сморщенная почка встречалась у пациентов с СКФ>60 мл/мин/1,73 м2 в 20% случаев, у пациентов с СКФ<30 мл/мин/1,73 м2 – в 13%; данных в регистре по распространенности сморщенных почек у пациентов с СКФ<15 мл/мин/1,73 м2 не было.
Проведя сравнение двух регистров, можно прийти к следующему выводу: уровень распространенности дисфункции почек был достаточно значим в обоих регистрах. Обращает на себя внимание значительно большее число пациентов в Павловском регистре с СКФ>60 мл/мин/1,73 м2 (52%), тогда как в ОРАКУЛ-РФ их было 23%; это было связано с тем, что в Павловском регистре проведен ряд субисследований, направленных на изучение почечной функции в популяции пациентов с декомпенсацией кровообращения.
Острое повреждение почек у больных с декомпенсацией ХСН
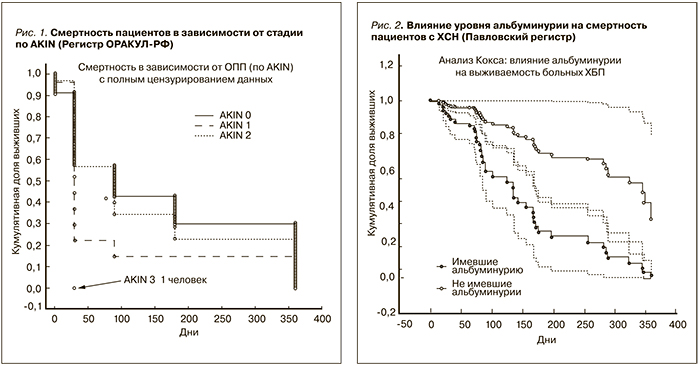
Анализируя базу данных ОРАКУЛ-РФ, был определен риск острого почечного повреждения (ОПП) у пациентов с острой декомпенсацией кровообращения. Все пациенты, которым проводился по данным регистра контроль уровня креатинина крови в течение 48 часов, были стратифицированы по шкале AKIN (Acute Kidney Injury Network) [5]. У 2134 (97%) пациентов признаков ОПП не было выявлено, AKIN 1-й стадии было выявлено у 25 (1,1%) пациентов, AKIN 2-й стадии – у 35 (1,6%) и AKIN 3-й стадии у 1 пациента. Риск смерти с AKIN 1-й стадии составил OR=1,7 (1,1; 2,5), с AKIN 2-й стадии OR=1,4 (1,02; 2,01). При анализе выживаемости можно обратить внимание на то, что наибольший риск смерти был в группе с ОПП 2-й стадии, смертность в группе с 1-й стадией ОПП начинает нарастать с 90-го дня наблюдения. Один-единственный пациент, который был классифицирован по AKIN как с 3-й стадией, умер на 30-й день наблюдения, находясь на заместительный почечной терапии (рис. 1). Исходя из вышеприведенного анализа, можно заключить: ОПП вносит значительный вклад в рост смертности среди пациентов с декомпенсацией ХСН.
Смертность в регистрах пациентов с почечным повреждением
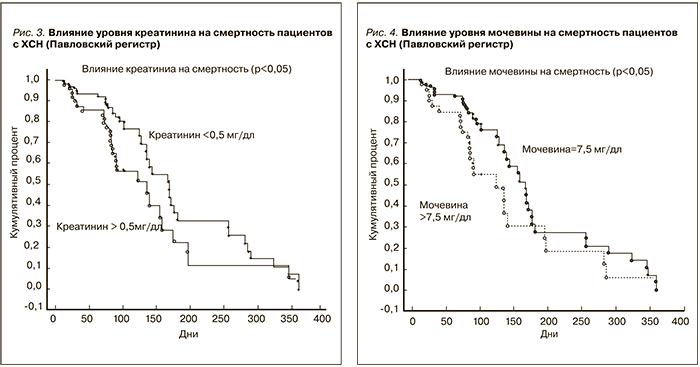
Одно из самых значимых различий, выявленных при сравнении регистров, – это выраженность смертности среди больных со снижением СКФ<60 мл/мин/1,73 м2. В Павловском регистре это оказывало значимое влияние на смертность пациентов, тогда как в регистре ОРАКУЛ-РФ уровень СКФ не повлиял на смертность; значимое влияние, как говорилось выше, начиналось с уровня СКФ<30 мл/мин/1,73 м2. Это, по-видимому, связано с селекцией пациентов в Павловском регистре, т.к. в его структуре специально изучался уровень альбуминурии и его влияние на смертность.
Уровень смертности в зависимости от альбуминурии оценить в регистре ОРАКУЛ-РФ возможности не было из-за отсутствия данных по абсолютному большинству пациентов. В Павловском регистре на смертность пациентов значимо влияет уровень альбуминурии (рис. 2) >30 мг/сут и <30 мг/сут. Анализ показал, что наличие альбуминурии достоверно увеличивает риск развития летального исхода на всем протяжении наблюдения.
Рассчитать риск развития ОПП в структуре регистра не представлялось возможным, т.к. это не планировалось и сроки контроля уровня креатинина крови достаточно сильно колебались от пациента к пациенту. Однако в Павловском регистре анализировалась связь уровня смертности с такими показателями, как уровень прироста креатинина и мочевины крови за время госпитализации.
Анализ влияния уровня креатинина на смертность, а точнее прирост креатинина >0,5 мг/дл в интервале госпитализация–выписка, показал, что смертность в когорте пациентов с приростом уровня креатинина была достоверно выше на всем протяжении наблюдения (рис. 3). Интересно отметить, что 42% летальных исходов приходилось на первые 90 дней наблюдения. Уровень прироста мочевины крови >7,5 мг/дл также оказал значимое влияние на уровень смертности пациентов и был значимым на всем протяжении наблюдения за пациентами (рис. 4).
Обсуждение
В настоящий момент можно видеть повышенный интерес к кардиоренальному синдрому у пациентов с декомпенсацией кровообращения. Сочетание ХБП и ХСН не только изучается в контексте крупных регистров, но и проводятся отдельные исследования. Это связано с тем, что у пациентов на фоне недостаточности кровообращения нарушение функции почек протекает достаточно долго бессимптомно. Так, в исследовании Y. Amsalem и соавт. [2], в которое были включены 4102 пациента с декомпенсацией кровообращения, одной из находок было выявление поражения почек у 2145 (57%), при этом в диагнозе это не было отражено у 872 (41%). Аналогичный результат был получен при анализе регистра ОРАКУЛ-РФ – у 6% пациентов, несмотря на выраженное снижение СКФ, ХБП не было диагностировано. При этом, по данным крупных регистров, фенотип «декомпенсация и ХБП» – один из наиболее распространенных в настоящее время. В наиболее крупном регистре OPTIMIZE-HF, насчитывающем более 14 тыс. пациентов, распространенность поражения почек с уровнем СКФ<60 мл/мин/1,73 м2 составила 40–57% от исследуемой популяции [6]. Этот результат близок к Павловскому регистру, где таких пациентов было 52%. В исследовании Y. Amsalem и соавт. распространенность ХБП составляла 57%, т.е. из 4102 пациентов с декомпенсацией кровообращения поражение почек отмечено у 2145 [2]. В крупнейшем мета-анализе, проведенном в настоящие время, было проанализировано 57 исследований (1 076 104 больных), посвященных ХБП, и 28 исследований пациентов со снижением почечной функции (49 890). По данным мета-анализа было показано, что распространенность ХБП по всем анализируемым регистрам составила 32%. Однако распространенность ХБП колебалась в значительных пределах в зависимости от того, острая сердечная недостаточность (53%) или ХСН (42%) [7]. При этом встречаемость ХБП в общей популяции составила всего 7% [8], т.е. наличие декомпенсации ХСН приводит к 3–4-кратному росту риска снижения почечной функции у таких пациентов.
Следует отметить, что не во всех крупных регистрах, изучающих декомпенсацию кровообращения, исследовалось изменение СКФ. Однако в некоторых регистрах дисфункция почек изучалась по уровню изменения креатинина крови. Так, в регистре EURO HF (креатинин>150 ммоль/л, 16%; креатинин>200 ммоль/л, 7%) и в Канадском регистре повышение креатинина и мочевины также оказали значимое влияние на смертность (креатинин>177 мкмоль/л; 2,90; 95% ДИ – 2,33–3,63; мочевина – 1,37; 95% ДИ – 1,30–1,44). В регистре ОРАКУЛ-РФ непосредственно повышение креатинина или мочевины значимого влияния на смертность не оказало, при том что наличие ХБП значимо увеличивало смертность, OR составило 3,82 (95% ДИ – 3,37–4,33). Еще одно довольно крупное исследование сделано на базе регистра DIG [9], проведенного в Канаде и США, где изучался вклад ХБП в смертность пациентов с систолической и диастолической ХСН. Результаты показали, что риск смерти пациентов, так же как и в регистре ОРАКУЛ-РФ и Павловском регистре, был значим и составил HR=1,22 (95% ДИ – 1,09–1,36; р<0,0001). Аналогичные результаты оказались в исследовании ADHERE, где риск смерти пациентов с повышенным уровнем креатина (более 2 мг/дл) с систолической ХСН составил 8,4%, с диастолической – 4,8% (OR=2,72 [2,36–3,14]; р<0,0001; OR=2,45 [2,07–2,92]; р<0,0001 соответственно). В мета-анализе K. Damman и соавт. [7] наличие ХБП увеличило риск почечной дисфункции в два раза; ОР=2,34 (2,20–2,50; p<0,001). В группе пациентов, у которых было выявлено только снижение почечной функции, риск смерти повышался на 23% (OR – 1,81; 95% ДИ – 1,55–2,12; р<0,001), но наибольший риск был для пациентов с тяжелой почечной недостаточностью, HR – 2,17 (95% ДИ – 1,95–2,40; р<0,001).
В настоящие время большой интерес клиницистов вызывает не только ХБП, но и риск возникновения острого почечного повреждения. Интересно, что острое почечное повреждение может увеличивать риск развития ХСН, а декомпенсация ХСН в свою очередь может увеличивать риск возникновения острого почечного повреждения. Например, в исследовании D. Olsson и соавт. [10–12] были изучены 24 018 пациентов с аортокоронарным шунтированием, у 12% пациентов развилось острое почечное повреждение, риск последующего развития ХСН был прямо пропорциональным тяжести стадии по AKIN. При декомпенсации ХСН риск развития острого почечного повреждения составляет от 10 до 40% в зависимости от применяемых критериев диагностики острого почечного повреждения [13, 14]. Причиной такой высокой распространенности острого почечного повреждения среди больных с декомпенсацией кровообращения служит ряд патологических факторов, присутствующих у этих пациентов. Во-первых, активная диуретическая терапия, которая проводится, как правило, болюсным введением больших доз диуретиков, приводит к активации РААС и симпатоадреналовой системы, а также к увеличению уровня активности вазопрессина. Во-вторых, гиперактивация этих систем и снижение сердечного выброса способствуют усугублению и ишемии тубулоинтерстициальной ткани почек, что приводит к воспалению и последующему фиброзу, а следовательно, – к уменьшению количества функционирующих клубочков. Эти механизмы приводят к росту креатинина и мочевины крови [15]. Известно, что повышение уровня вазопрессина может способствовать увеличению клиренса мочевины, по-видимому, с этим связано увеличение смертности пациентов на этапе госпитализация–выписка не только в Павловском регистре, но и в ряде других исследований [16, 17]. По результатам ряда исследований, развитие острого почечного повреждения признается независимым фактором риска развития смерти пациентов с декомпенсацией кровообращения. Так, в исследовании Y. Takaya и соавт. [18] было показано, что группа пациентов с поздним развитием острого почечного повреждения была более прогностически не благоприятной; ОР=3,39 (1,84–6,18), р<0,001. В регистре ОРАКУЛ-РФ удалось выделить сравнительно небольшую группу пациентов с развившимся острым почечным повреждением, которое также оказалось достаточно значимым предиктором неблагоприятного исхода для пациентов с декомпенсацией кровообращения.
Из результатов данного совместного анализа двух российских регистров, изучавших декомпенсацию сердечной недостаточности, было выявлено, что уровень распространенности ХБП достаточно велик и наибольшее число пациентов с ХСН и ХБП оказалось в Павловском регистре. Фенотип пациентов с «декомпенсацией кровообращения и ХБП» являлся независимым предиктором неблагоприятного исхода. Острое почечное повреждение – значимый фактор, увеличивающий риск смерти пациентов с декомпенсацией кровообращения.



