Введение
Хронической болезнью почек (ХБП) страдает каждый десятый житель земли. Несмотря на достигнутые успехи в диагностике и лечении, растет число больных, нуждающихся в заместительной почечной терапии (гемодиализ [ГД], перитонеальный диализ, трансплантация почки). Основной причиной смерти больных, получающих лечение гемодиализом, служит патология сердца и сосудов [1]. За последние два десятилетия масса исследований была посвящена артериальной гипертензии, гипертрофии и геометрии левого желудочка, систолической и диастолической дисфункции левого желудочка у больных на ГД, при этом практически не уделялось внимания правым отделам сердца.
 Между тем, как показали исследования последних лет, у больных на ГД частота легочной гипертензии достигает 50% и более и она служит независимым предиктором смерти [2–4]. Легочную гипертензию делят на 5 клинических типов, легочную гипертензию при ХБП относится к 5-му типу – с неясной этиологией и патогенезом [5]. В качестве одной из возможных причин обсуждается дополнительный кровоток по артериовенозной (А-В) фистуле с увеличением притока крови к правым отделам сердца [6, 7]. Целью исследования стало изучение динамики давления в легочной артерии в течение года лечения ГД, а также связи между кровотоком в А-В фистуле и давлением в легочной артерии.
Между тем, как показали исследования последних лет, у больных на ГД частота легочной гипертензии достигает 50% и более и она служит независимым предиктором смерти [2–4]. Легочную гипертензию делят на 5 клинических типов, легочную гипертензию при ХБП относится к 5-му типу – с неясной этиологией и патогенезом [5]. В качестве одной из возможных причин обсуждается дополнительный кровоток по артериовенозной (А-В) фистуле с увеличением притока крови к правым отделам сердца [6, 7]. Целью исследования стало изучение динамики давления в легочной артерии в течение года лечения ГД, а также связи между кровотоком в А-В фистуле и давлением в легочной артерии.
Материал и методы
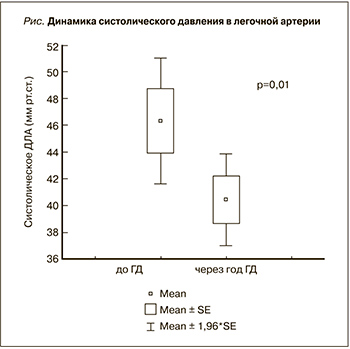
Обследованы 50 больных, находившихся на лечении ГД. Мужчин было 19, женщин – 31, средний возраст составил 55±12 лет. Причины 5-й стадии ХБП: гломерулонефрит – 23 больных, сахарный диабет – 9, поликистоз почек – 8, мочекаменная болезнь – 5, интерстициальный нефрит – 2, амилоидоз почек – 2, пиелонефрит – 1 больной. На момент начала ГД 42 пациента имели артериальную гипертензию, 32 – хроническую сердечную недостаточность I–III функциональных классов по классификации Нью-Йоркской ассоциации сердца (NYHA). ХСН диагностирована и оценена в соответствии с Национальными рекомендациями ВНОК и ОССН по диагностике и лечению ХСН (третий пересмотр, 2009).
Гемодиализ проводили по 4 часа 3 раза в неделю на аппаратах Gambro Artis с использованием бикарбонатного диализирующего раствора и диализаторов Elisio 17H, Elisio 21H с мембраной Polynephron. Kt/V составил от 1,2 до 1,8. Период наблюдения за больными от начала лечения гемодиализом – 1 год.
Всем больным проведена эхокардиография и допплерэхокардиография до начала ГД и через год лечения ГД. Исследование выполнено на аппарате GE Vivid E9 в М-режиме импульсным датчиком 3,5 МГц в положении больного на левом боку. Все эхокардиографические исследования проведены одним специалистом. Измерения проведены согласно рекомендациям Американского эхокардиографического общества. Измеряли толщину межжелудочковой перегородки (МЖП) и задней стенки левого желудочка (ЗСЛЖ) в диастолу, определяли конечный диастолический размер (КДР), конечный систолический размер (КСР) левого желудочка, диаметр левого предсердия (ЛП). Рассчитывали объем левого желудочка в систолу (КСО) и в диастолу (КДО). Определяли ударный объем (УО), фракцию выброса (ФВ). Фракцию выброса считали сохранной при ФВ>50%. Массу миокарда левого желудочка (ММЛЖ) рассчитывали по формуле Devereux. Определяли индекс массы миокарда левого желудочка (ИММЛЖ) как отношение ММЛЖ к площади поверхности тела.
Гипертрофия миокарда левого желудочка диагностирована при ИММЛЖ 115 г/м2 и более у мужчин и 95 г/м2 и более у женщин. Относительная толщина стенки (ОТС) левого желудочка рассчитана по формуле: ОТС=2хЗСЛЖ/КДР. Нормальной геометрией левого желудочка считали ОТС≤0,42 при нормальном ИММЛЖ, концентрическое ремоделирование диагностировали при ОТС>0,42 и нормальном ИММЛЖ, концентрическую гипертрофию левого желудочка диагностировали при ОТС > 0,42 и увеличенном ИММЛЖ, эксцентрическую ГЛЖ – при ОТС≤0,42 и увеличенном ИММЛЖ [8].
Оценка диастолической функции левого желудочка проведена с помощью допплерэхокардиографии из верхушечного доступа в 4-камерном сечении сердца. Определены следующие параметры наполнения левого желудочка: максимальная скорость раннего диастолического наполнения (Е), максимальная скорость наполнения в систолу предсердий (А), отношение этих скоростей (Е/А), время изоволюмического расслабления (IVRT), время замедления потока раннего диастолического наполнения (DT).
Методом допплерографии определен кровоток в А-В фистуле. Легочная гипертензия диагностирована согласно Рекомендациям Европейского общества кардиологов [9].
 Результаты обработаны с применением программы Statistica for Windows 6.0 с использованием критерия t Стьюдента для связанных и несвязанных переменных при распределении параметров, близком к нормальному; в случае если распределение отличалось от нормального, использовали критерий Mann–Whitney U. Проведен однофакторный корреляционный анализ (в зависимости от вида распределения – Pearson или Spearman), рассчитан χ2 с поправка Йейтса. При распределении данных, близком к нормальному, показатели представлены как M±SD, где M – среднее арифметическое, SD – стандартное отклонение. В противном случае данные представлены в виде Me и ИКР, где Me – медиана, ИКР – интерквартильный размах: 25–75-й процентили. Различие считали достоверным при Р<0,05.
Результаты обработаны с применением программы Statistica for Windows 6.0 с использованием критерия t Стьюдента для связанных и несвязанных переменных при распределении параметров, близком к нормальному; в случае если распределение отличалось от нормального, использовали критерий Mann–Whitney U. Проведен однофакторный корреляционный анализ (в зависимости от вида распределения – Pearson или Spearman), рассчитан χ2 с поправка Йейтса. При распределении данных, близком к нормальному, показатели представлены как M±SD, где M – среднее арифметическое, SD – стандартное отклонение. В противном случае данные представлены в виде Me и ИКР, где Me – медиана, ИКР – интерквартильный размах: 25–75-й процентили. Различие считали достоверным при Р<0,05.
Результаты
Характеристика больных представлена в табл. 1. До начала лечения ГД гипертрофия левого желудочка диагностирована у 46 больных, ИММЛЖ составил 159,1±35,8 г/м2. Тридцать больных имели сохранную фракцию выброса левого желудочка (ФВ>50%). Легочная гипертензия наблюдалась у 29 (58%) больных. До начала ГД прослеживалась прямая связь между систолическим давлением в легочной артерии (СистДЛА) и ИММЛЖ (r=0,56; P=0,008), временем изоволюмического расслабления левого желудочка (r=0,79; P<0,001) и обратная связь между СистДЛА и ФВ левого желудочка (r=-0,54; P<0,001) и гемоглобином (r=-0,37; P=0,01).
В табл. 2 представлены эхокардиографические параметры до начала диализной терапии и через год лечения ГД.
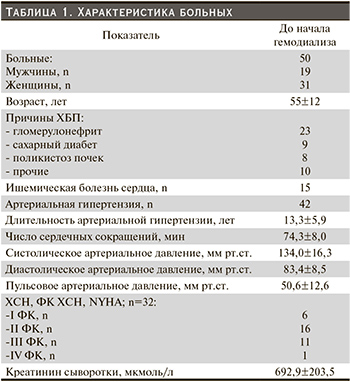
На рисунке изображена динамика систолического давления в легочной артерии через год лечения гемодиализом. В динамике через год уменьшилась ММЛЖ (до ГД ИММЛЖ был 159,1±35,8, через год лечения ГД – 129,1±42,2 г/м2, Р=0,04), при этом давление в легочной артерии также уменьшилось (до ГД СистДЛА составило 46,3±16,1, через год лечения снизилось до 40,4±11,7 мм рт.ст., Р=0,01).
Вместе с тем, если за ЛГ принять показатель систолическое ДЛА>50 мм рт.ст. (высока вероятность ЛГ без исследования каких-либо других параметров [6]), то ЛГ имели 12 (24%) больных до ГД и только 2 (4%) после года лечения ГД (χ2=6,72; Р=0,0095), что также свидетельствует об уменьшении частоты и выраженности ЛГ через год лечения гемодиализом.
Не наблюдалось связи между давлением в легочной артерии и скоростью кровотока в А-В фистуле через год лечения ГД (r=0,11; P=0,3).
Обсуждение
До начала лечения ГД давление в легочной артерии было ассоциировано с выраженностью гипертрофии левого желудочка, систолической и диастолической дисфункции левого желудочка. Через год лечения диализом уменьшилась ММЛЖ и снизилось давление в легочной артерии. Полученные данные свидетельствуют, что кровоток в А-В фистуле существенно не влияет на давление в легочной артерии.
A. Unal и соавт. [10] у 50 больных методом допплерэхокардиографии исследовали ДЛА до формирования А-В фистулы и через 76±11 дней после. Частота ЛГ составила 34 и 38% соответственно, при этом не найдено связи между кровотоком в А-В фистуле и ДЛА. В нашем исследовании через год лечения ГД давление в легочной артерии, как и частота легочной гипертензии, снизились, особенно это касалось больных исходным cистДЛА>50 мм рт.ст. Полученные данные обнадеживают, т.к. свидетельствуют о принципиальной возможности коррекции легочной гипертензии.
В большинстве работ, посвященных ЛГ у больных на ГД, авторы диагностировали и оценивали ЛГ не по среднему давлению в легочной артерии ≥25 мм рт.ст. (как предлагается в рекомендациях по ЛГ), а по систолическому ДЛА в легочной артерии ≥35 мм рт.ст. [3, 10, 11]. Возможно, с разной методикой оценки связан большой разброс данных о частоте легочной гипертензии у больных на ГД – от 22% [12], до 52% [4]. Более того, ряд авторов диагностировали ЛГ при систолическом ДЛА ≥40 мм рт.ст. [12], другие, наоборот, при систолическом ДЛА ≥30 мм рт.ст. [13]. Ряд авторов исключали из исследования больных с заболеваниями легких, с тяжелой сердечной недостаточностью, при этом хорошо известно, как непросто оценить тяжесть ХСН у больных на гемодиализе, поскольку клинические проявления сердечной недостаточности зависят от времени оценки (до, после, на следующий день после ГД), а также от величины ультрафильтрации и других факторов [6]. Более того, в одном из недавних исследований показано, что 38% больных ХБП, у которых при ультразвуковом исследовании легких был обнаружен выраженный застой в легких, не имели клинических проявлений [14].
Давление в легочной артерии у обследованных нами больных до начала лечения ГД коррелировало с величиной ИММЛЖ, ФВ левого желудочка, параметрами диастолической функции левого желудочка и анемией. Через год после ГД уменьшилась ММЛЖ и снизилось ДЛА, несмотря на изменения гемодинамики, связанные с функционирующей А-В фистулой. Фракция выброса левого желудочка существенно не изменилась через год ГД, заметно увеличился гемоглобин. Положительную динамику ИММЛЖ у больных, начавших лечение ГД, наблюдали A. Ganda и соавт. [15], при этом параллельно уменьшался венозный застой.

Катетеризация правых отелов с определением давления, заклинивая в легочной артерии, позволяет не только подтвердить наличие легочной гипертензии, но и дифференцировать пре- и посткапиллярную легочную гипертензию, но такие работы с больными на ГД немногочисленны [16]. Если среднее ДЛА было ≥25 мм рт.ст. и давление заклинивания в легочной артерии ≤15 мм рт.ст. диагностировалась прекапиллярная легочная гипертензия. Авторы провели также тест на вазореактивность. Прекапиллярная легочная гипертензия диагностирована у 13%, посткапиллярная – у 65% больных на ГД. Авторы указывают на необходимость стандартизации методики и времени проведения катетеризации правых отелов сердца и предлагают выполнять ее после процедуры ГД. При всей важности инвазивных методов диагностики легочной гипертензии они вряд ли найдут широкое применение среди больных на ГД, с чем согласны и сами авторы исследования.
Можно согласиться с мнением B. Kawar и соавт. [17], согласно которому легочная гипертензия у больных ХБП развивается до начала диализной терапии. Как поведет себя ДЛА при последующем наблюдении за обследованными нами больными, сказать трудно. В литературе найдены сообщения о длительном наблюдении за больными на ГД, в которых не отмечено влияния кровотока в А-В фистуле на ДЛА [11]. Помимо систолической и диастолической дисфункций в патогенезе легочной гипертензии у больных на ГД обсуждается роль уремической васкулопатии, гиперволемии, гиперфосфатемии, гиперпаратиреоидизма, воспаления, эндотелиальной дисфункции, измененного ответа на вазоконстрикторы и другие факторы [18–20]. Наши данные свидетельствуют о важной роли дисфункции левых отделов сердца у больных, получающих лечение ГД, при этом давление сначала повышается в легочных венах, а затем передается на легочную артерию через легочные капилляры [21]. Необходимы дальнейшие исследования механизмов развития легочной гипертензии у больных ХБП, что позволит определиться с тактикой их ведения [22].
Заключение
Легочная гипертензия наблюдается у половины больных на хроническом ГД во время начала диализной терапии и ассоциирована с ГЛЖ, систолической и диастолической дисфункцией левого желудочка, а также анемией. Через год диализной терапии наблюдается снижение выраженности легочной гипертензии по мере достижения больными «сухого веса» и регрессом ГЛЖ. Нет связи между кровотоком в А-В фистуле и давлением в легочной артерии. Высокая частота легочной гипертензии через год лечения ГД и отсутствие четкой связи между кровотоком по А-В фистуле и ДЛА диктуют необходимость углубленного исследования причин легочной гипертензии у больных на ГД с целью разработки лечебных мероприятий.



