Введение
Хроническая болезнь почек (ХБП) и фибрилляция предсердия (ФП) являются широко распространенными состояниями в общей популяции. Частота встречаемости ХБП, по данным экспертных обществ различных стран, достигает 15% [1], в т.ч. продвинутых ее стадий 18,7% среди заболевших [2]. Распространенность ХБП приобретает все большие масштабы; так, по данным регистров США, доля заболевших ХБП с I по IV стадию среди населения возросла с 10 до 13% за последние два десятилетия [3]. Считается, что рост заболеваемости частично связан с увеличением частоты встречаемости сахарного диабета и артериальной гипертонии [4].
В свою очередь ФП является наиболее распространенным стойким нарушением ритма сердца, повышающим риск инсульта и смерти. Распространенность ФП колеблется от 1 до 2% [5, 6] среди общей популяции, встречаемость ее у лиц старше 50 лет увеличивается вдвое каждые 10 лет и в среднем достигает примерно 10% среди людей старше 80 лет. Частота выявления ФП увеличивается с возрастом от <0,5% в возрасте 40–50 лет до 5–15% в возрасте 80 лет [7–9]. У мужчин данная аритмия развивается чаще, чем у женщин [10]. В настоящее время вызывает интерес сочетание фибрилляции предсердий и ХБП, особенно с позиции возрастающего риска осложнений как почечных, так и сердечно-сосудистых, в частности ишемического инсульта, ассоциирующихся с ним.
Наличие аритмий сердца является значимой проблемой для пациентов ХБП, в частности ФП, часто встречающейся у данной группы больных. По данным различных исследований, распространенность ХБП в сочетании с хронической фибрилляцией предсердий колеблется от 7 до 18% и увеличивается до 12–25% у лиц старше 70 лет [11, 12]. Среди всех пациентов, имеющих ФП, хроническая болезнь почек развивается у 10–15% [13]. Фибрилляция предсердий даже чаще встречается среди пациентов с небольшим снижением почечной функции и, как предполагается, возникает на ранних этапах формирования ХБП. Ее распространенность увеличивается с дальнейшим снижением СКФ независимо от других факторов риска [14].
В связи с этим целью нашего исследования было изучение возможных клинико-патогенетических ассоциаций при сочетании фибрилляции предсердий и ХБП II–IV стадий.
Материал и методы
В исследование были включены 46 пациентов (21 мужчина и 25 женщин) с фибрилляцией предсердий (ФП) и хронической болезнью почек (ХБП) II–IV стадий в возрасте от 52 до 84 лет, средний возраст – 69±9 лет. ХБП определяли как поражение почек любой этиологии и/или снижение их функции, регистрируемое в течение 3 месяцев или более. Стадии ХБП определяли в соответствии с классификацией Национального почечного фонда США (NKF K/DOQI, 2002) в зависимости от величины СКФ и наличия маркеров повреждения почек. СКФ рассчитывали по сокращенной формуле MDRD и CKD-EPI.
Всем больным проведено стандартное клинико-лабораторное и инструментальное обследование, включившее сбор анамнеза, физическое обследование, клинический анализ мочи, исследование мочи и МАУ, клинический и биохимический анализы крови, эхокардиографию, офисное измерение АД.
Критерии исключения: возраст старше 85 лет; пациенты с ХБП V стадии (терминальная почечная недостаточность); поражение почек в рамках системной красной волчанки, системных васкулитов; антифосфолипидный синдром; печеночная недостаточность; гипотиреоз или тиреотоксикоз; пациенты, злоупотребляющие алкоголем; больные с врожденными пороками сердца; ХСН 3–4-го ФК по NYHA.
Дизайн исследования
Для достижения поставленной цели проведено двухэтапное деление всех больных на 2 группы сначала по стадиям ХБП: 1-ю группу составили 22 человек с ХБП II стадии; 2-ю группу – 24 человека с ХБП III и IV стадий; затем по форме ФП для уточнения полученных ассоциаций и получения более точных результатов: 1-ю группу составили 30 человек с пароксизмальной формой ФП; 2-ю группу – 16 человек с постоянной формой ФП.
Статистическая обработка проведена с помощью программного обеспечения SPSS Statistics Desktop версии 22.0 (IBM). Для сравнения групп применяли при правильном распределении t-критерий Стьюдента для независимых выборок, при неправильном распределении – непараметрический критерий Вилкоксона, Манна–Уитни и точный критерий Фишера. При сравнении групп по уровню NT-proBNP для стандартизации показателей проведено логарифмирование (log10). Также осуществлен многофакторный анализ, в т.ч. бинарный логистический регресс.
Результаты
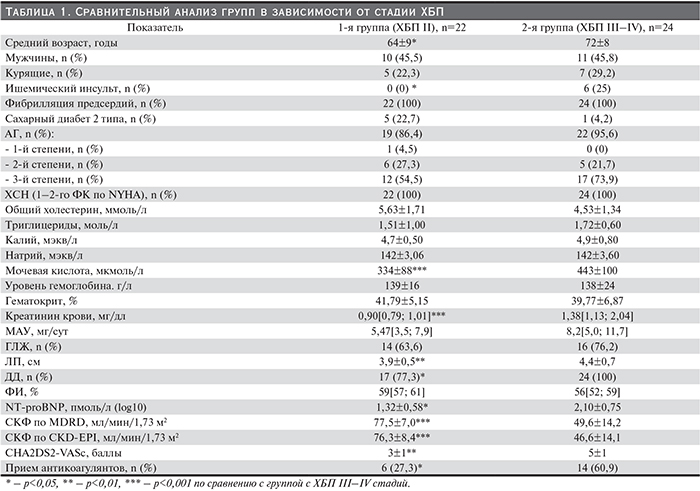
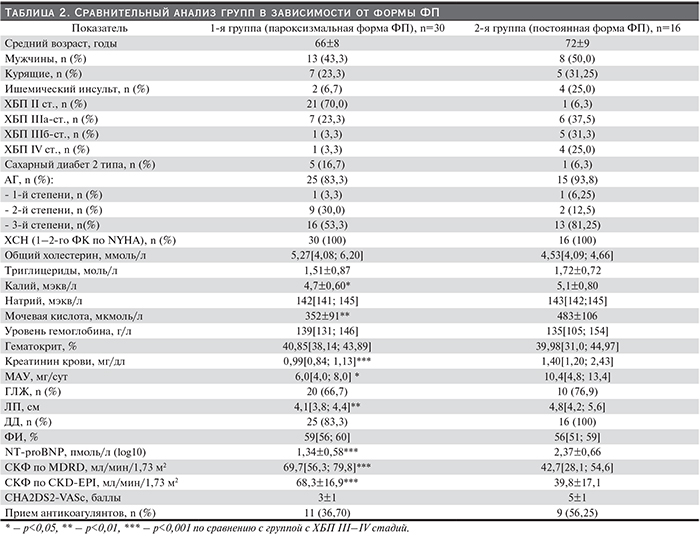
На первом этапе исследования проведено сравнение клинико-лабораторных и демографических показателей у пациентов с разными стадиями ХБП (n=46), разделенными на две группы. В 1-ю группу вошли пациенты со II стадией ХБП, во 2-ю – с III и IV (IIIа-стадия – 13 [54,2%] пациентов; IIIб-стадия – 6 [25,0%]; IV стадия – 5 [20,8%]) пациентов (табл. 1). Пациенты обеих групп не различались по гендерному признаку. Вместе с тем пациенты второй группы были старше. В обеих группах не было достоверных различий по частоте и тяжести АГ (р=0,09). Несмотря на это, во второй группе отмечены большие размеры левого предсердия (4,4±0,7см, р<0,01) и чаще отмечалась диастолическая дисфункция ЛЖ (p<0,05). Частота встречаемости гипертрофии ЛЖ и уровень ФИ левого желудочка были сопоставимыми в обеих группах (p>0,05). Уровень NT-proBNP был достоверно выше среди пациентов второй группы (2,10±0,75 пмоль/л [log10], p<0,05). Во второй группе значимо выше был уровень мочевой кислоты (443±100 мкмоль/л, р<0,001). Концентрация электролитов крови и гемоглобина в сравниваемых группах достоверно не различалась (p>0,05). Группы были сопоставимыми по степени альбуминурии и проводимой нефропротективной терапии (p>0,05). Среди пациентов второй группы чаще встречалась постоянная форма ФП (р<0,001).
Таким образом, у пациентов 2-й группы с III–IV стадиями ХБП при сопоставимой тяжести степени АГ отмечены изменения геометрии ЛП и уровня NT-proBNP и чаще встречалась постоянная форма ФП.
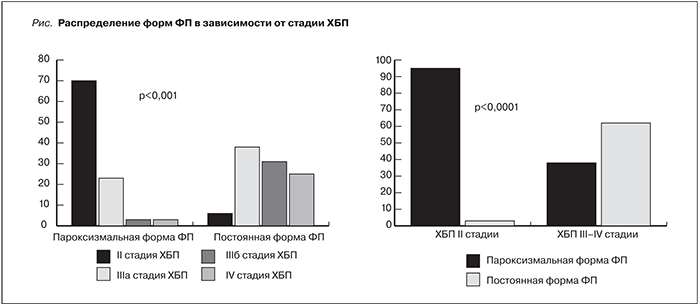
Для уточнения ассоциаций постоянной формы ФП и стадий ХБП нами был предпринят второй этап исследования, где сравнивались пациенты с пароксизмальной (n=30) и постоянной (n=16) формами ФП. Все пациенты с постоянной формой ФП имели более продвинутые стадии поражения почек (см. рисунок).
У пациентов с постоянной формой ФП преобладали тяжелые формы артериальной гипертонии (АГ 3-й степени, 81,25%) (табл. 2). В этой группе значимо больше были размеры ЛП (4,8 [4,2; 5,6], p<0,01) и частота встречаемости ГЛЖ (76,9%, p>0,05). Хотя наличие ДД отмечено у всех больных постоянной формой ФП, статистически значимых различий между группами не выявлено (p>0,05). Уровень фракции изгнания ЛЖ был сопоставимым между пациентами обеих групп (p>0,05). Более выраженное повреждение миокарда у больных постоянной формой отражает и значимо более высокий уровень NT-proBNP (2,37±0,66 пмоль/л [log10]), p<0,001) при сопоставимых концентрациях натрия в обеих группах. Среди метаболических факторов у больных постоянной формой ФП отмечены значимо более высокий уровень мочевой кислоты (483±106 мкмоль/л, p<0,01), а также более высокие концентрации калия (5,1±0,80 мэкв/л, p<0,05) и более низкий уровень гемоглобина (135 [105;154] г/л, p>0,05).
Для уточнения ассоциаций ФП и ХБП было предпринято два регрессионных анализа, где последовательно в качестве постоянной переменной были СКФ и ФП.
Среди изученных показателей для прогрессирования снижения уровня СКФ наиболее значимыми были постоянная форма ФП (β -26,760, 95% ДИ [-38,603; -14,918], р<0,001) и уровень гемоглобина (в г/л) (β 0,238, 95% ДИ [0,077; 0,578], р=0,012). Концентрация NT-proBNP, калия, натрия, мочевой кислоты, размеры ЛП, фракция изгнания ЛЖ, а также прием антикоагулянтов, АРА и ИАПФ значимо не влияли.
В свою очередь для развития постоянной формы ФП в ходе пошагового регрессионного анализа оказались значимыми предикторами только СКФ: (β -0,139 95% ДИ [0,776; 0,976], p=0,018) и размер ЛП (в см) (β 3,051, 95% ДИ [2,061; 216,808], p=0,01). Остальные изученные параметры, такие как концентрация NT-proBNP, калия, натрия, гемоглобина, мочевой кислоты, размеры ЛП, фракция изгнания ЛЖ; прием антикоагулянтов; прием АРА и ИАПФ, были незначимыми.
Ишемический инсульт чаще встречался у пациентов второй группы (p<0,05) и в большинстве случаев при постоянной форме ФП (p>0,05). В целом риск тромботических осложнений был выше во 2-й группе и при постоянной форме ФП. При этом следует отметить, что доля больных, принимавших антикоагулянты, была больше во 2-й группе (p<0,05) и при постоянной форме ФП (p>0,05).
Обсуждение
Взаимная зависимость ФП и СКФ была отмечена в крупных популяционных исследованиях [14]. Снижение СКФ приводит к вторичному ремоделированию сердечно-сосудистой системы и изменению геометрических и функциональных характеристик гемодинамики, что в совокупности с метаболическими изменениями, в т.ч. анемией, электролитными нарушениями, может создавать условия для развития ФП. В свою очередь наличие ФП сопряжено с увеличением вероятности дальнейшего снижения СКФ и нарастания альбуминурии [15]. Во многом это может быть объяснено тем, что как постоянная форма ФП, так и пароксизмы фибрилляции приводят к ухудшению внутрипочечной гемодинамики. Тромбоэмболии, источником которых является левое предсердие в условиях фибрилляции, в основном известны и наглядно демонстрируются при мозговой локализации. Однако не исключено, что определенный вклад в нарушение внутрипочечной гемодинамики вносит и эмболия почечных сосудов [16].
В проведенном нами исследовании у всех пациентов была ФП. При этом у всех пациентов отмечено снижение СКФ. Характерно, что наибольшая доля пациентов с постоянной формой ФП имела III и IV стадии ХБП. Одним из наиболее значимых факторов риска развития ФП является АГ [17].
В нашем исследовании более тяжелые степени АГ встречались чаще у больных III–IV стадиями, что сопровождалось развитием гипертрофии миокарда левого желудочка, увеличением размеров левого предсердия и диастолической дисфункцией у всех больных III и IV стадиями ХБП и у ¾ больных II стадией. Фракция изгнания из левого желудочка снижалась по мере снижения СКФ, хотя это и не было подтверждено статистически. Несмотря на то что все больные получали антигипертензивную терапию и в исследуемой группе не было больных со злокачественной АГ, изменения геометрических характеристик сердца нарастали по мере снижения функции почек. Эти изменения создают благоприятные условия для развития аритмии и усугубления сердечной недостаточности. Об этом свидетельствуют и данные других исследователей [18].
Независимый свидетель перерастяжения кардиомиоцитов NT-proBNP как функциональный маркер, отражающий изменения гемодинамики, был значимо выше у больных III–IV стадиями ХБП. При этом уровень натрия в обеих группах был сопоставимым. Это может косвенно свидетельствовать о том, что помимо такого гемодинамического фактора, как перегрузка объемом на функцию кардимиоцитов, оказывают дополнительное влияние другие уремические факторы.
В литературе широко обсуждается значение одного из компонентов остаточного азота – мочевой кислоты – как независимого фактора развития сердечно-сосудистых заболеваний [19]. Концентрация мочевой кислоты была значимо выше у пациентов III–IV стадий ХБП в нашем исследовании. Уровень калия значимо не различался в обеих группах, но был в среднем выше во второй группе, очевидно, внося свою лепту в изменение метаболизма кардиомиоцитов.
Анемический синдром при ХБП влечет за собой изменение функции кардиомиоцитов и ряд метаболических изменений [20]. В нашем исследовании уровень гемоглобина в обеих группах был в пределах нормальных значений, но у пациентов 2-й группы его средняя концентрация была ниже, чем у больных 1-й группы, что подтверждает неблагоприятный вклад анемии в развитие кардиоренального синдрома.
Уровень альбуминурии (АУ) наряду с СКФ рассматривается как независимый фактор развития кардиоренального синдрома [21]. В исследуемой группе пациентов в целом показатели АУ были в пределах нормальных значений, однако при сравнительном анализе у больных постоянной формой ФП ее уровень был значимо выше, чем в группе с пароксизмальной формой. Возможно, в целом нормальные значения АУ были связаны с нефропротективной терапией – более ¾ больных получали модуляторы РААС. При этом прием препаратов не влиял на распределение форм фибрилляции.
Взаимосвязь высокого риска развития и ишемического инсульта, обсуждаемого в последнее время в литературе [16], подтверждено и нами. В нашем исследовании, по мере нарастания стадии ХБП нарастает и риск развития ишемического инсульта. Механизмы, поддерживающие ФП, при ХБП являются косвенной причиной повышения риска инсультов.
Заключение
Таким образом, проведенное исследование позволяет констатировать связь ФП и ХБП. По мере снижения функции почек развиваются гемодинамические нарушения, влияющие на развитие и сохранение фибрилляции предсердий, такие как артериальная гипертензия и перегрузка сердца объёмом.
Сопряженные с хронической почечной недостаточностью метаболические изменения, такие как гиперурикемия, гиперкалиемия и анемия, также способствуют персистированию ФП.
В свою очередь ФП приводит к изменению внутрипочечного кровотока и утяжелению ХБП.
Выявлена также косвенная взаимосвязь высокого риска развития ишемического инсульта и ХБП.

