Введение
Диабетическая нефропатия (ДН) и развившаяся вследствие нее терминальная стадия хронической почечной недостаточности являются одними из наиболее частых причин смерти больных сахарным диабетом 1 типа (СД1). Сложность патогенеза, длительное бессимптомное течение и несвоевременная диагностика приводят к неудовлетворительной эффективности патогенетической терапии ДН. Данные эпидемиологического скрининга в разных регионах России свидетельствуют, что истинная распространенность ДН превышает фактическую в 2–4 раза [1]. В первые 5 лет от дебюта СД развиваются функциональные и структурные изменения почек. К наиболее ранним морфологическим признакам нефропатии относятся гипертрофия клубочков, пролиферация мезангиальных клеток и утолщение стенок капиллярных петель, затем развиваются дистрофические и атрофические изменения канальцев, фиброз интерстиция артерий и артериол [2, 3].
 Наличие увеличения экскреции альбумина с мочой не всегда свидетельствует о неблагоприятном прогнозе в отношении почечной функции, более того, данное состояние оказывается обратимым и в то же время появляются выборки больных с прогрессирующим снижением скорости клубочковой фильтрации (СКФ) без наличия увеличения экскреции альбумина с мочой. Длительное наблюдение P. Fioretto и соавт. за пациентами с ДН после трансплантации поджелудочной железы показало, что через 10 лет при полном устранении гипергликемии наблюдается регресс структурных изменений ткани почек у больных СД 1 типа (СД1) [4–6]. Стойкая нормализация углеводного обмена, а также назначение своевременной терапии для купирования внутриклубочковой гипертензии могут остановить патологический процесс в почках на ранних стадиях. Таким образом, продолжение поиска ранних критериев поражения почек у больных СД остается весьма актуальной проблемой. Что такое ранняя диагностика ДН? Считается ли увеличение экскреции альбумина (ЭАМ) с мочой более 300 мг/сут своевременной констатацией ДН? Действительно предвестником развития клинически развернутой стадии ДН является повышение ЭАМ в пределах 30–300 мг/сут. У здоровых лиц экскреция альбумина с мочой составляет в среднем 6,5 мкг/сут [7]. Следует отметить, что диагностирование «высокой нормальной» ЭАМ у больных СД является предиктором развития микроальбуминурии [8, 9]. Ежедневный диапазон в показателях экскреции альбумина как у здоровых людей, так у больных СД составляет 40–45% [10]. По данным длительных наблюдений, наличие микроальбуминурии значительно увеличивает риск сердечно-сосудистых катастроф и смерти от сердечно-сосудистой патологии среди больных СД2 [11, 12]. При СД1 микроальбуминурия также ассоциирована с нефрокардиальной смертностью [13]. По данным исследования FinnDiane (Finnish Diabetic Nephropathy study), наличие микроальбуминурии связано с увеличением общей смертности пациентов СД1 в 2,8 раза [14]. Четкая корреляция микроальбуминурии в развитии неблагоприятного прогноза объясняется ее тесной связью с другими факторами риска сердечно-сосудистой патологии [15]. Основной фактор, определяющий показатель СКФ, является сывороточный уровень эндогенного креатинина. Основным недостатком расчетных формул СКФ выступает сложность его валидизации на тех лиц, у которых уровень креатинина в крови (в силу объема мышечной массы, степени физической активности) может отличаться от среднепопуляционных показателей. Согласно исследованиям, у больных СД выявляется низкий сывороточный уровень креатинина, что объясняется сниженной абсолютной (или относительной на фоне ожирения) мышечной массой [9, 12]. Гипергликемия приводит к развитию гиперфильтрации, что затрудняет оценку состояния функционирующих нефронов [16]. С учетом недостатков при использовании креатинина для расчета СКФ делаются попытки применения альтернативных маркеров оценки почечной функции. Отражением этого процесса является появление методов расчета СКФ на основе цистатина С. Цистатин С – негликозилированный белок, принадлежащий ко второй группе генетического семейства цистатинов. Впервые выделен как белок спинномозговой жидкости и мочи у пациентов с почечной патологией [17]. Синтез цистита С происходит всеми ядросодержащими клетками организма с постоянной скоростью, зависящей от почечной функции. По данным сравнительного анализа, выяснения зависимости уровней цистатина С в сыворотке от показателей СКФ позволили внедрить в клиническую практику формулу для расчета СКФ по цистатину С [16]. Однократное измерение сывороточного уровня цистита С позволяет наиболее точно рассчитывать СКФ по сравнению с уровнем эндогенного креатинина [17, 19]. Также имеются данные, свидетельствующие, что чувствительность метода определения цистатина С в моче достигает 70% после второго года течения СД1 у детей [18].
Наличие увеличения экскреции альбумина с мочой не всегда свидетельствует о неблагоприятном прогнозе в отношении почечной функции, более того, данное состояние оказывается обратимым и в то же время появляются выборки больных с прогрессирующим снижением скорости клубочковой фильтрации (СКФ) без наличия увеличения экскреции альбумина с мочой. Длительное наблюдение P. Fioretto и соавт. за пациентами с ДН после трансплантации поджелудочной железы показало, что через 10 лет при полном устранении гипергликемии наблюдается регресс структурных изменений ткани почек у больных СД 1 типа (СД1) [4–6]. Стойкая нормализация углеводного обмена, а также назначение своевременной терапии для купирования внутриклубочковой гипертензии могут остановить патологический процесс в почках на ранних стадиях. Таким образом, продолжение поиска ранних критериев поражения почек у больных СД остается весьма актуальной проблемой. Что такое ранняя диагностика ДН? Считается ли увеличение экскреции альбумина (ЭАМ) с мочой более 300 мг/сут своевременной констатацией ДН? Действительно предвестником развития клинически развернутой стадии ДН является повышение ЭАМ в пределах 30–300 мг/сут. У здоровых лиц экскреция альбумина с мочой составляет в среднем 6,5 мкг/сут [7]. Следует отметить, что диагностирование «высокой нормальной» ЭАМ у больных СД является предиктором развития микроальбуминурии [8, 9]. Ежедневный диапазон в показателях экскреции альбумина как у здоровых людей, так у больных СД составляет 40–45% [10]. По данным длительных наблюдений, наличие микроальбуминурии значительно увеличивает риск сердечно-сосудистых катастроф и смерти от сердечно-сосудистой патологии среди больных СД2 [11, 12]. При СД1 микроальбуминурия также ассоциирована с нефрокардиальной смертностью [13]. По данным исследования FinnDiane (Finnish Diabetic Nephropathy study), наличие микроальбуминурии связано с увеличением общей смертности пациентов СД1 в 2,8 раза [14]. Четкая корреляция микроальбуминурии в развитии неблагоприятного прогноза объясняется ее тесной связью с другими факторами риска сердечно-сосудистой патологии [15]. Основной фактор, определяющий показатель СКФ, является сывороточный уровень эндогенного креатинина. Основным недостатком расчетных формул СКФ выступает сложность его валидизации на тех лиц, у которых уровень креатинина в крови (в силу объема мышечной массы, степени физической активности) может отличаться от среднепопуляционных показателей. Согласно исследованиям, у больных СД выявляется низкий сывороточный уровень креатинина, что объясняется сниженной абсолютной (или относительной на фоне ожирения) мышечной массой [9, 12]. Гипергликемия приводит к развитию гиперфильтрации, что затрудняет оценку состояния функционирующих нефронов [16]. С учетом недостатков при использовании креатинина для расчета СКФ делаются попытки применения альтернативных маркеров оценки почечной функции. Отражением этого процесса является появление методов расчета СКФ на основе цистатина С. Цистатин С – негликозилированный белок, принадлежащий ко второй группе генетического семейства цистатинов. Впервые выделен как белок спинномозговой жидкости и мочи у пациентов с почечной патологией [17]. Синтез цистита С происходит всеми ядросодержащими клетками организма с постоянной скоростью, зависящей от почечной функции. По данным сравнительного анализа, выяснения зависимости уровней цистатина С в сыворотке от показателей СКФ позволили внедрить в клиническую практику формулу для расчета СКФ по цистатину С [16]. Однократное измерение сывороточного уровня цистита С позволяет наиболее точно рассчитывать СКФ по сравнению с уровнем эндогенного креатинина [17, 19]. Также имеются данные, свидетельствующие, что чувствительность метода определения цистатина С в моче достигает 70% после второго года течения СД1 у детей [18].
Опубликованы отдельные работы, посвященные изучению цистатина С при диабетической нефропатии [19], однако его роль в комплексном обследовании функции почек пациентов с СД1 остается не до конца изученной. Имеются недостатки для того, чтобы использовать цистатин С в качестве маркера почечной дисфункции. Так, его повышение может ассоциироваться с возрастом, мужским полом, объемом жировой ткани, концентрацией триглицеридов и мочевой кислоты в крови, артериальной гипертензией, СД [16–19].
Установлено, что механизмом развития патологических изменений сосудистого русла при хронической болезни почек является увеличение сывороточного уровня симметричного диметиларгинина [20, 21]. Симметричный диметиларгинин (СДМА) является метилированным производным аминокислоты L-аргинина. Он выделяется преимущественно почками, его плазменный уровень отражает почечную функцию. В мета-анализе 18 исследований с участием 2136 пациентов диагностирована отрицательная взаимосвязь концентрации СДМА с референс-методом определения СКФ по клиренсу инулина [22, 23]. Как взрослые, так и дети с ранними стадиями почечной недостаточности имеют уже значительно повышенный уровень СДМА, отрицательно коррелирирующий с СКФ [24, 25].
Цель исследования: сопоставление различных способов оценки СКФ, рассчитанной по креатинину и цистатину С у больных СД1 c нормальной и умеренно сниженной фильтрационной функцией почек.
Материал и методы
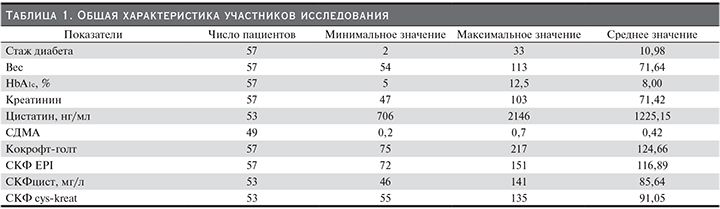
Обследованы 57 больных СД1, 37 мужчин и 20 женщин в возрасте от 21 до 57 лет (медиана –30 лет), с длительностью заболевания с момента постановки диагноза от 33 до 2 лет (медиана – 8 лет). Показатели СКФ, рассчитанные с использованием формулы СКФ-EPIcreat, находились в пределах нормальных значений или умеренно снижены (60–89 мл/мин/1,73 м2). Всем пациентам проводили общеклиническое обследование, лабораторную оценку функционального состояния почек, осуществляли контроль компенсации углеводного обмена. У большинства больных СД1 независимо от длительности заболевания выявлена декомпенсация углеводного обмена (по уровню гликозилированного гемоглобина в крови). Средние значения гликозилированного гемоглобина у пациентов – 8%. Контрольную группу составили 15 человек в возрасте от 19 до 42 лет (медиана – 28 лет) без СД, с нормоальбуминурией и нормальным уровнем креатинина в крови (табл. 1). Все больные, включенные в исследование, получали инсулинотерапию в базис-болюсном режиме. У всех обследованных пациентов отсутствовала артериальная гипертензия, и они не получали ингибиторы ангиотензинпревращающего фермента или антагонисты рецепторов ангиотензина II с нефропротективной целью. В исследование не были включены больные первичной патологией почек без СД, инфекцией мочевыводящих путей, нефротическим синдромом, хронической болезнью почек (ХБП) 2–5-й стадий, хроническими воспалительными заболеваниями.
В соответствии с рекомендациями экспертов KDIGO по диагностике и лечению ХБП СКФ определяли по формулам CKD-EPI на основании уровня в сыворотке крови креатинина (CKD-EPIcreat, 2009), цистатина С (CKD-EPIcys, 2012). Определение концентрации цистатина С в сыворотке крови проводили иммунотурбидиметрическим методом на анализаторе Abbott Architect c8000 с помощью наборов Human Cystatin C Elisa (BioVendor). Показатели СКФ рассчитывали с помощью калькулятора Национального почечного фонда США (http://www.kidney.org/professionals/kdoqi/gfr_calculator.cfm). Контрольную группу составили 15 человек в возрасте от 19 до 42 лет (медиана – 28 лет) без СД, с нормоальбуминурией и нормальным уровнем креатинина в крови. Протокол исследования одобрен локальным этическим комитетом. Все пациенты давали письменное информированное согласие на участие в исследовании.
Статистическая обработка проведена с использованием программы STATISTICA 10 (StatSoft, Inc, 2011, CША), с применением методов непараметрической статистики. Межгрупповые различия оценивали с помощью критерия Манна–Уитни и ANOVA Краскела–Уоллиса. Взаимосвязь признаков изучали с помощью рангового корреляционного анализа Спирмена, многофакторного пошагового регрессионного анализа. Переменные с распределением, отличным от нормального, перед включением в многофакторные модели подвергали логарифмированию. Критический уровень значимости при проверке статистических гипотез принимали равным 0,05.

Результаты
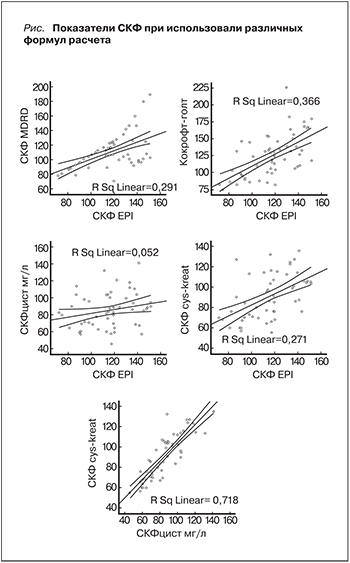
Согласно данным расчета СКФ различными методами, выявлено, что CKD-ЕРI имела положительную корреляцию c СКФ, которая оценивалась по MDRD и Кокрофту–Голту. В то же время взаимосвязи между CKD-ЕРI и СКФ, рассчитанной на основе формулы по цистатину С, не выявлено. Отдельное место занимала формула, в расчете которой учитывались как креатинин, так и цистатин С. СКФ, полученная на ее основе, достоверно коррелировала как с СКФ по CKD-EPIcreat, так и с CKD-EPIcys (см. рисунок).
При дальнейшем анализе мы разделили полученные результаты оценки СКФ на 3 группы: меньше 90, 90–120 и больше 120 мл/мин/м2 (табл. 2). Формулы расчета СКФ, в которых не учитывался сывороточный уровень цистатина С, давали более высокие значения СКФ, в результате большинство пациентов имели нормальные или повышенные цифры СКФ, свидетельствовавшие о гиперфильтрации. При использовании формул с цистатином С число больных с гиперфильтрацией снижалось в несколько раз и увеличивались случаи со снижением СКФ ниже 90 мл/мин/м2.
В качестве дополнительного критерия оценки функции почек нами был выбран один из показателей дисфункции эндотелия –
симметричный диметиларгинин (СДМА). Диапазон измерения показателя соответствует 0,39–0,69 нмоль/л. СДМА практически полностью выделяется почками, его плазменный уровень отражает почечную патологию. При оценке взаимосвязи СДМА и СКФ мы не получили достоверной корреляции с результатами расчета по формулам Кокрофта–Голта и MDRD, была выявлена очень слабая отрицательная взаимосвязь с CKD-EPIcreat и CKD-EPIcys, а также умеренная отрицательная корреляция с формулой, учитывавшей как цистатин С, так и креатинин.
Обсуждение
Задача диагностики ранних проявлений ДН на сегодняшний день остается нерешенной. Говоря о доклинической диагностике, мы в нашей работе подразумеваем те варианты поражения почек, когда у пациента еще не проявились традиционные критерии ДН в виде увеличения экскреции альбумина с мочой или снижения СКФ. С целью оценки функции почек нами были отобраны пациенты, не имевшие других причин для нефропатии, кроме СД, с нормальным артериальным давлением. Первичная оценка функции почек проводилась на основании формулы CKD-ЕРI. Средние значения СКФ в данной выборке были равны 116,9±20,71 мл/мин, при этом у 39% СКФ был выше 120 мл/мин/м2, что свидетельствовало о высокой доле больных с гиперфильтрацией. При этом отрицательная взаимосвязь креатинина с гликозилированным гемоглобином, а также высокие цифры гликозилированного гемоглобина в группе больных с СКФ больше 120 мл/мин/м2 косвенно подтверждали гиперфильтрацию на фоне декомпенсации углеводного обмена. У больных выбранной группы не было данных в пользу нарушения функции почек, о чем свидетельствовали нормальные значения креатинина, цистатина С и СДМА. С учетом целей нашего исследования мы выполнили оценку СКФ с использованием других формул, принципиальное отличие которых между собой было использование или не использование значений цистатина С в сыворотке крови.
Расчеты СКФ на основе цистатина С привели к результатам, свидетельствовавшим о снижении почечной функции в той же выборке больных, при этом не только изменились средние значения, но и существенно наросла доля больных со снижением СКФ ниже 90 мл/мин/м2. Это не оказалось неожиданным, поскольку о схожих результатах в отношении больных ДН сообщается и в других исследованиях. Вероятно, одним из главных факторов, влияющих на такой результат, является развитие саркопении у больных СД и, соответственно, более низкий синтез креатинина. С клинических позиций полученная разница между различными вариантами оценки СКФ у одного и того же больного, как видно из нашей работы, может иметь существенное значение. При этом разброс значений СКФ мог находиться в диапазоне от гиперфильтрации до снижения СКФ ниже 90 мл/мин/м2. Имеющиеся данные литературы свидетельствуют о том, что формула, комбинирующая для расчетов креатинин и цистатин С, дает более точные результаты по сравнению с референсными методами оценки. В нашей работе мы не можем сравнить полученные результаты с «прямыми» методами оценки СКФ, однако косвенно мы можем судить о том, что действительно этот вариант, вероятно, более чувствителен к изменениям СКФ. Такой вывод нам позволяет сделать косвенная оценка отрицательной взаимосвязи СКФ с СДМА.
Использование в клинической практике расчетных методов оценки СКФ является определенным компромиссом, позволяющим с относительно низкими затратами выполнять скрининг больных и в дальнейшем осуществлять динамическое наблюдение с целью предотвращения развития ДН. То, насколько они точны, всегда будет предметом для споров и научных исследований, поскольку проведение валидизации с учетом расовых, генетических, коморбидных и других критериев на сегодняшний день окончательно не решено.



