Атипичный гемолитико-уремический синдром (аГУС) – это орфанное системное заболевание, обусловленное неконтролируемой активацией комплемента из-за генетического дефекта белков – регуляторов активности комплемента (фактор H, фактор I, мембранный кофакторный протеин – MCP, фактор B и др.) или образования антител к фактору H. Следствием неконтролируемой активации комплемента является тромботическая микроангиопатия (ТМА) – образование тромбов и повреждение эндотелия в микроциркуляторном русле различных органов, преимущественно почек и головного мозга, клиническими проявлениями которого являются тромбоцитопения, микроангиопатическая гемолитическая анемия, почечное повреждение и поражение других органов-мишеней [1]. Таким образом, аГУС является комплемент-опосредованной ТМА. Однако существуют и другие формы ТМА: типичный ГУС, ассоциированный с шига-токсином E. coli, тромботическая тромбоцитопеническая пурпура (ТТП), обусловленная дефицитом металлопротеазы ADAMTS13, расщепляющей сверхкрупные мультимеры фактора фон Виллебранда, а также вторичные ТМА, связанные с аутоиммунными заболеваниями (например, катастрофический антифосфолипидный синдром), применением некоторых лекарственных препаратов или беременностью (HELLP-синдром – крайне тяжелая форма преэклампсии с гемолизом, повышением печеночных ферментов и тромбоцитопенией).
ТМА представляет собой важную причину острого почечного повреждения (ОПП) при беременности, составляя не менее 9% всех причин акушерского ОПП и являясь при этом наряду с другими факторами предиктором развития хронической болезни почек [2]. Необходимо помнить, что ОПП при беременности имеет очень серьезный прогноз: летальность плода/новорожденного достигает 39%, материнская летальность – 20% [3].
Беременность сама по себе является триггером развития ТМА. Например, по данным французских авторов, из 100 взрослых женщин с аГУС клинический дебют заболевания был связан с беременностью у 21 пациентки, при этом развитие симптоматики в послеродовом периоде отмечено у 79% этих больных [4]. Физиологически протекающая беременность сопровождается умеренной активацией системы комплемента, но плацента обладает локальными механизмами защиты против эффектов комплемента, ведущим из которых является экспрессия на поверхности трофобласта белка DAF (decay accelerating factor), а также MCP (membrane cofactor protein) и молекулы CD59 [5]. После родов устранение механизма антикомплементарной защиты, связанного с плацентой, кровотечение, инфекционные осложнения могут стать триггером неконтролируемой активации комплемента у женщин с мутациями генов-регуляторов комплемента, именно поэтому манифестация аГУС так часто наблюдается именно в послеродовом периоде [6]. Однако развитие аГУС возможно и во время беременности: в отечественной и зарубежной литературе описаны случаи манифестации этого заболевания в третьем, втором и даже в первом триместрах [4, 7, 8], поэтому срок беременности или послеродовый период не является определяющим фактором дифференциальной диагностики аГУС и других ТМА.
Первой линией терапии аГУС является лечение свежезамороженной плазмой (СЗП) в режиме плазмообмена (ПО) и/или инфузий, но акушерский аГУС отличается тяжелым течением с нередкой резистентностью к плазмотерапии или только частичным ответом на лечение СЗП. Исходы аГУС, ассоциированного с беременностью, у пациенток, получавших плазмотерпию, нельзя назвать удовлетворительными: у 62% больных терминальная хроническая почечная недостаточность развивается в первый месяц болезни, у 76% – при последующем наблюдении [4]. С другой стороны, растет число публикаций с описаниями клинических наблюдений весьма эффективного применения при акушерском аГУС экулизумаба – препарата моноклональных антител против С5-компонента комплемента. В большинстве этих наблюдений сначала проводилась плазмотерапия с частичным ответом и только последующее лечение экулизумабом вызывало полную гематологическую ремиссию аГУС, существенное улучшение функции почек и положительную динамику со стороны других пораженных органов [9–11].
Представляем собственное клиническое наблюдение.
Б о л ь н а я Х. 1991 г.р. (23 года) 13.07.2015 поступила в Московский областной перинатальный центр при сроке беременности 35–36 недель с жалобами на плохое самочувствие, головную боль, повышение АД. Из анамнеза было известно, что женщина ранее считала себя здоровой. Данная беременность первая, наступила спонтанно, первый и второй ее триместры протекали без осложнений. При сроке беременности 28 недель отмечено появление небольшой протеинурии (0,3–0,5 г/сут). При сроке 32–33 недели получала лечение в дневном стационаре по месту жительства по поводу фетоплацентарной недостаточности.
В перинатальном центре проведено экстренное обследование. Общее состояние средней тяжести. Сознание ясное. Периферических отеков нет. Уровень АД – 170/110 мм рт.ст. В общем ан. крови: гемоглобин 112 г/л, гематокрит 34,5%, лейкоциты 17,6*109/л, тромбоциты 105*109/л. Белок мочи 13,7 г/л, эритроциты 3+. Билирубин сыворотки 23,1 мкмоль/л, АЛТ 166 ЕД/л, АСТ 239 ЕД/л, мочевина 7,3 ммоль/л, креатинин 91 мкмоль/л. Показатели коагулограммы в норме.
Установлен диагноз: Беременность 35–36 недель. Головное предлежание. Преэклампсия тяжелой степени. HELLP-синдром. СЗРП 2-й степени. Rh (-) пациентка без признаков сенсибилизации. Учитывая тяжесть состояния больной, наличие преэклампсии тяжелой степени, принято решение о родоразрешении беременной путем кесарева сечения в экстренном порядке. 13.07.2015 с 21:47 до 22:35 – операция: лапаротомия по Пфанненштилю. Кесарево сечение в нижнем маточном сегменте. За головку извлечен живой недоношенный мальчик ростом 47 см, массой тела 2200 г, оценка по шкале Апгар – 7/7 баллов.
Во время операции отмечена повышенная кровоточивость прямых мышц живота, для дополнительного гемостаза была использована гемостатическая губка. Общая кровопотеря во время операции составила 1000 мл. На операционном столе проведена инфузия СЗП в объеме 500 мл. После операции продолжалась искусственная вентиляция легких (ИВЛ), проводилась инфузия сульфата магния и нимотопа, утеротоническая терапия. За время наблюдения (с 20:00 13.07.2015 до 0.00 14.07.2015) выделилось только 50 мл темной мочи.
14.07.2015 к 03:00 отмечено снижение гемоглобина до 59 г/л, тромбоцитов до 25*109/л, дальнейший рост билирубина до 66,7 мкмоль/л, АЛТ до 183 ЕД/л, АСТ до 396 ЕД/л, повышение креатинина сыворотки до 114 мкмоль/л. При УЗИ малого таза и органов брюшной полости: размеры матки 110×89×106 мм (соответствуют обычным значениям в п/о периоде). Полость матки не расширена. Свободной жидкости в малом тазу 20–30 мл.
Эхографических признаков структурных изменений органов брюшной полости не выявлено. Свободной жидкости в брюшной полости нет. Принимая во внимание нарастание тяжести состояния пациентки, принято решение о ее переводе в реанимационное отделение МОНИКИ им. М.Ф. Владимирского. Больная доставлена в институт бригадой врачей на реанимобиле 14.07.2015 в 04:00.
При поступлении общее состояние пациентки крайне тяжелое. Без сознания. Проводится ИВЛ. Кожные покровы бледные, с желтушным оттенком. Отеков нет. Дыхание в легких везикулярное. Тоны сердца ясные. Ритм правильный. ЧСС 80 в мин. АД 150/110 мм рт.ст. Живот мягкий. По уретральному катетеру выделяется малое количество мочи коричневого цвета.
Консультация невролога: Оценка по шкале Глазго – кома 2–3. Реакция зрачков на свет отсутствует. Лицо симметрично. Мышечный тонус – диффузная гипотония. Сухожильные рефлексы отсутствуют.
14.07.2015 в 10:00: гемоглобин 54 г/л, эритроциты 1,89*1012 /л гематокрит 16%, лейкоциты 22,2*109/л, тромбоциты 105*109/л. В общем ан. мочи – белок 3,09 г/л, эритроциты +3. Общий билирубин сыворотки 141,7 мкмоль/л, непрямой билирубин 114,5 мкмоль/л, общий белок 65 г/л, холестерин 4,3 ммоль/л, АЛТ 176 ЕД/л, АСТ 470 ЕД/л, креатинкиназа 267 ЕД/л (24–170), ЛДГ 2625 ЕД/л (110–295), мочевая кислота 598 мкмоль/л, мочевина 11 ммоль/л, креатинин 206 мкмоль/л. Лаборантом визуально отмечен частичный гемолиз в биохимической пробирке. Уровень СРБ резко повышен – 108,4 мг/л (норма 0,01–4,99 мг/л).
Обзорная рентгенография органов грудной клетки: легочные поля прозрачны. Жидкости и газа в плевральных полостях нет. Сердце и средостение – без особенностей. Конец интубационной трубки находится на уровне Th3. УЗИ брюшной полости: Эхо-признаков структурных изменений органов не выявлено. В брюшной полости имеется жидкость.
Выполнена компьютерная томография головного мозга: картина двустороннего ишемически-гипоксического повреждения головного мозга, данных за наличие геморрагических очагов не получено.
Акушерский статус соответствовал сроку после операции, клинических признаков внутрибрюшного и маточного кровотечения не было.
Установлен диагноз: 1-е сутки после экстренного кесарева сечения по поводу тяжелой преэклампсии при сроке беременности 35 недель. HELLP-синдром. Полиорганная недостаточность: кома, состояние на ИВЛ, печеночно-почечная недостаточность. Анемия тяжелой степени. Системная воспалительная реакция. Полисерозит. К вечеру 14.07.2015 вновь отмечено снижение количества тромбоцитов до 23*109/л, нарастание лейкоцитоза до 28,3*1012/л. При этом повышения температуры тела, явных признаков инфекционных осложнений не наблюдалось.
14.07.2015 проведен сеанс ПО с объемом замещения 2800 мл, продолжались ИВЛ, инфузии СЗП и отмытых эритроцитов с учетом фенотипа, вводились низкомолекулярный гепарин (НМГ), препарат антитромбина III, метилпреднизолон 1000 мг, антибиотики, окситоцин.
К 15.07.2015 (2-е сутки после родов) состояние оставалось крайне тяжелым. Сознание отсутствовало. АД – 107/68–95/57 мм рт.ст. Суточный диурез 400 мл. Отмечена умеренная положительная динамика некоторых лабораторных показателей: число тромбоцитов увеличилось до 79*109/л, уровень гемоглобина вырос до 72 г/л, наблюдалось снижение уровня билирубина до 81,8 мкмоль/л, активности ЛДГ до 1002 ЕД/л. Однако продолжал нарастать уровень креатинина сыворотки – до 319 мкмоль/л, лейкоцитоза – до 44*109/л, C-реактивного белка – до 147,8 мг/л, хотя посевы мочи и крови (материал взят в первые сутки, а результаты получены через 3 дня) оказались стерильными. Отмечен выраженный парез кишечника, разрешившийся после стимуляции.
15.07.2015 продолжались ИВЛ, антибактериальная терапия, лечение НМГ, переливание эритроцитов, проведен сеанс ПО, сеанс гемодиафильтрации (ГДФ). Во время ГДФ произошло восстановление сознания, однако больная оставалась заторможенной, выполняла только простые команды. 15–16.07.2015 суточный диурез составил 1500 мл.
16–17.07.2015 (3–4-е сутки после родов) состояние пациентки без существенной динамики. Отмечено увеличение диуреза до 3500 мл без снижения уровня креатинина сыворотки: 17.07.2015 креатинин 330 мкмоль/л.
Результаты микробиологических посевов: в моче и крови роста нет, отделяемое трахеи – роста нет, отделяемое из влагалища – E. faecium менее 103 и S. haemolyticus менее 103 КОЕ/мл.

18.07.2015 (5-е сутки) – ухудшение состояния сознания до комы с частичным восстановлением сознания во время очередного сеанса ПО. 19–22.07.2015 (6–10-е сутки), несмотря на проводимые ежедневно сеансы ПО и инфузии СЗП, сохранялись лабораторные признаки микроангиопатического гемолиза, нарушение сознания, определяющее во многом необходимость продленной ИВЛ, вновь появился парез кишечника, не обусловленный хирургической патологией. Несмотря на увеличение диуреза, уровень креатинина не снижался. Диагноз HELLP-синдрома как самостоятельной патологии начал вызывать сомнения.
Результаты проведенного дополнительного обследования: Активность металлопротеиназы ADAMTS13 в плазме крови пациентки составила 39% от уровня активности ADAMTS13 в контрольной плазме, полученной при смешивании образцов плазмы здоровых доноров (кровь взята утром 14.07.2015 до начала плазмотерапии). Антинуклеарный фактор – отрицательный результат. Антифосфолипидные антитела IgG и IgM – отрицательный результат. Волчаночный антикоагулянт не обнаружен. Антитела к фактору H – 39% (норма). HBsAg, антитела анти-HCV, антитела к ВИЧ не обнаружены. Дополнительное обследование позволило исключить ТТП, системную красную волчанку, антифосфолипидный синдром, вирусные инфекции. Предположен ассоциированный с беременностью аГУС, резистентный к плазмотерапии.
22.07.2015 проведен консилиум, констатировавший, что имеющийся симптомокомплекс в виде микроангиопатического гемолиза, тромбоцитопении и полиорганной недостаточности позволяет диагностировать у пациентки ТМА. Сохраняющаяся на 10-е сутки после родоразрешения и не уступающая плазмотерапии симптоматика заставляет подвергнуть сомнению диагноз HELLP-синдрома как самостоятельной формы преэклампсии. Наиболее вероятным представляется диагноз атипичного гемолитико-уремического синдрома беременных. Учитывая плазморезистентность, у пациентки имеются витальные показания к применению антител к C5-компоненту комплемента, блокирующему образование терминального комплекса комплемента (препарат экулизумаб). До получения препарата необходимо продолжить интенсивную плазмотерапию. Принимая во внимание тяжелое состояние пациентки и невозможность экстренной вакцинации против менингококковой инфекции, необходима антибиотикопрофилактика в течение всего периода лечения экулизумабом.
Дополнительным подтверждением диагноза стали результаты исследования уровня компонентов комплемента, полученные уже после консилиума: C3-комплемент – 0,71 г/л (норма 0,83–1,93 г/л), C4-комплемент – 0,17 г/л (норма – 0,15–0,57 г/л).
23.07.2015 состояние пациентки с отрицательной динамикой. После сеанса ПО на фоне инфузии СЗП развилась картина отека легких с падением сатурации кислородом и рентгенологической картиной отека легких. Введение СЗП пришлось прекратить.
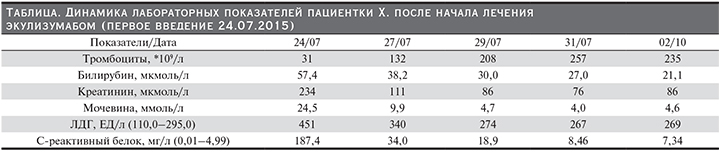
К утру 24.07.2015 снова отмечено ухудшение лабораторных показателей (по сравнению с 23.07.2015): снижение гемоглобина с 73 до 59,2 г/л, снижение количества тромбоцитов с 47 до 31*109/л, нарастание ЛДГ с 315 до 451 ЕД/л, рост уровня C-реактивного белка со 102,8 до 187,4 мг/л.
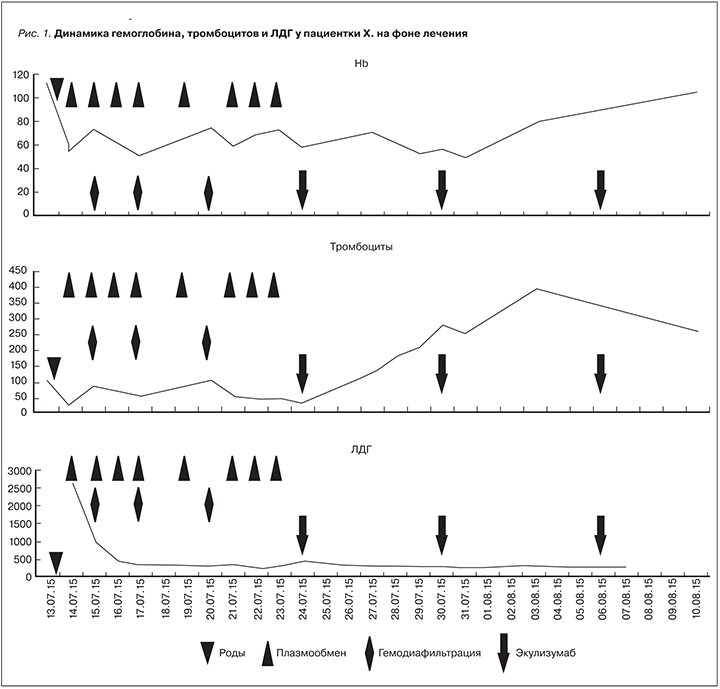
24.07.2015 проведена первая инфузия экулизумаба в дозе 900 мг без осложнений. Плазмотерапия больше не проводилась. На 2–3-и сутки после введения экулизумаба произошло полное восстановление сознания, на 3-и сутки прекращена ИВЛ, дыхание самостоятельное через трахеостому. Рентгенологически: положительная динамика картины легочной ткани. Отмечена также положительная динамика лабораторных показателей (см. таблицу). 30.07.2015 выполнено второе введение 900 мг экулизумаба, 31.07.2015 пациентка переведена из реанимационного в терапевтическое отделение.
03.08.2015 ЛОР-врачом осуществлена декануляция трахеи. 11.08.2015 пациентка вакцинирована против менингококковой инфекции вакциной Менцевакс.
В терапевтическом отделении, а затем в дневном стационаре была продолжена терапия экулизумабом: выполнено еще 2 введения по 900 мг с интервалом 1 неделя (всего 4 введения по 900 мг), 5-е введение в дозе 1200 мг – через 1 неделю, а затем продолжено введение препарата по 1200 мг каждые 2 недели. После раннего быстрого улучшения постепенно произошла полная нормализация клинико-лабораторных показателей. На рис. 1 и 2 видно, что плазмотерапия только частично способствовала улучшению лабораторных показателей и только начало введения экулизумаба кардинально улучшило ситуацию. В течение 2–3 недель после начала лечения пациентку беспокоили сильные головные боли (на фоне нормального или умеренного повышенного АД не выше 140/90 мм рт.ст.), которые затем купировались. В дальнейшем уровень АД – 100/70–110/80 мм рт.ст. без антигипертензивной терапии.
Пациентка продолжает получать экулизумаб более 5 месяцев, при этом у нее хорошее качество жизни, нормальный уровень АД, все гематологические и биохимические показатели также в пределах нормы. В связи с высоким риском рецидива аГУС лечение планируется продолжить не менее 12 месяцев. При появлении возможности выполнить генетическое исследование (пока в России данное обследование недоступно) женщина будет обследована на наличие мутаций, ответственных за развитие аГУС.
При беременности могут развиваться разные формы ТМА – HELLP-синдром как вариант тяжелой преэклампсии, тромботическая тромбоцитопеническая пурпура (ТТП), катастрофический антифосфолипидный синдром (КАФС), аГУС. Дифференциальная диагностика этих состояний бывает весьма непростой, поскольку их клинические симптомы (тромбоцитопения, признаки микроангиопатической гемолитической анемии, поражение почек, головного мозга, печени и нередко других органов) мало различаются, а срок беременности при дебюте болезни тоже не определяет диагноз [4, 6, 7, 12]. Оказалось, перечисленные выше формы ТМА имеют и общие черты патогенеза: чрезмерная активация комплемента обнаружена не только при аГУС, но и при HELLP-синдроме, а также КАФС, хотя только при аГУС неконтролируемая активация комплемента играет главную роль [13, 14]. Подтвердить КАФС помогает обнаружение антифосфолипидных антител в сыворотке и волчаночного антикоагулянта в плазме пациента, а диагноз ТТП считается верифицированным, если активность ADAMTS13 в плазме ниже 10%. Отсутствие гематологического ответа на ПО в течение 3–5 дней при активности ADAMTS13 ≥ 10% также более характерно для аГУС [15].
Сложнее различить HELLP-синдром и аГУС, особенно если ТМА развивается в третьем триместре беременности или в раннем послеродовом периоде. Принципиальное различие состоит в том, что HELLP-синдром обычно полностью разрешается в течение нескольких дней после родов (хотя в первые-вторые сутки после родов состояние пациентки может ухудшаться), а при аГУС родоразрешение не только не вызывает клинического улучшения, но может стать триггером клинической катастрофы. Таким образом, если у женщины с ТМА беременных радикальное улучшение состояния не наступает через 4–6 дней после родов, следует думать о наличии аГУС, а не HELLP-синдрома как самостоятельной патологии. Надо все же отметить, что взаимоотношения ассоциированного с беременностью аГУС и HELLP-синдрома до конца не ясны. Известно, что у части больных HELLP-синдромом при последующем генетическом обследовании выявляются мутации регуляторов комплемента, характерные для аГУС [16]. Как расценить эти данные? Был ли HELLP-синдром диагностирован ошибочно у пациенток с аГУС, или HELLP-синдром трансформировался в аГУС? Возможно ли, что хотя бы часть пациенток с тяжелейшим HELLP-синдромом, погибающих после родоразрешения в первые несколько суток, на самом деле страдают аГУС? Окончательно ответа на эти вопросы пока нет, но важность быстрого проведения дифференциально-диагностического поиска очевидна, поскольку подходы к лечению HELLP-синдрома и аГУС различаются – пациенткам с аГУС требуется специфическая комплемент-подавляющая терапия.
В представленном наблюдении у пациентки с преэклампсией развился аГУС, дебютировавший как HELLP-синдром. В течение раннего послеродового периода было трудно заподозрить клиническую манифестацию аГУС, поскольку соответствующего анамнеза у родильницы не было, зато имелись все критерии HELLP-синдрома как одной из вторичных ТМА: гемолиз, повышение трансаминаз и тромбоцитопения, возникшие на фоне преэклампсии.
Важным фактором дифференциальной диагностики HELLP-синдрома и аГУС явилось отсутствие существенной положительной динамики после родоразрешения в течение 10 дней даже на фоне применения плазмотерапии в режиме ПО с дополнительными инфузиями СЗП.
Особенностью случая является плазморезистентность заболевания и тяжелое осложнение лечения СЗП у пациентки в виде отека легких, что определило витальные показания к применению экулизумаба – препарата, блокирующего образование терминального комплекса активации комплемента. После начала лечения экулизумабом получен быстрый и выраженный клинический ответ в виде гематологической ремиссии, восстановления сознания, возможности самостоятельного дыхания, полного восстановления функции почек, регресса системного воспалительного ответа.
Как уже было отмечено выше, в целом плазмотерапия недостаточно эффективна при аГУС, ассоциированном с беременностью, напротив, использование специфической комплемент-подавляющей терапии экулизумабом позволяет быстро оборвать патологический процесс [4, 9–11, 15]. Более того, описано успешное применение экулизумаба не только при аГУС, но и при других потенциально фатальных ТМА, резистентных к стандартной терапии, а именно – при HELLP-синдроме и при КАФС [17, 18].
В случае развития аГУС при беременности и в послеродовом периоде времени на проведение дифференциальной диагностики и принятие решения о начале терапии экулизумабом, как правило, катастрофически мало. В то же время своевременно начатое специфическое комплемент-подавляющее лечение позволяет не только спасти жизнь женщины, но и полностью восстановить функцию почек и других пораженных органов. Генетическое исследование не является необходимым для диагностики и начала лечения экулизумабом, но информация о характере мутаций важна для оценки возможности безопасной отмены препарата после полного прекращения микроангиопатического гемолиза и действия триггерного фактора [19].
Таким образом, ТМА при беременности требует проведения дифференциальной диагностики в основном между HELLP-синдромом, ТТП и аГУС. Констатация наличия ТМА диктует необходимость проведения плазмотерапии, а отсутствие улучшения состояния пациентки на фоне лечения СЗП в течение 4–6 суток после родоразрешения (продолжающийся микроангиопатический гемолиз, сохранение/прогрессирование почечной недостаточности, полиорганная недостаточность), уровень ADAMTS13 ≥10% и исключение вторичных форм ТМА (на фоне системных заболеваний, инфекций) требует экстренного начала лечения экулизумабом. Следует также отметить, что необходимость в назначении специфической комплемент-подавляющей терапии может возникнуть и ранее указанного выше срока, когда состояние женщины ухудшается катастрофически быстро.
Понятно, что при развитии послеродового аГУС вакцинация против менингококковой инфекции, которая обычно проводится до начала введения экулизумаба, должна быть отложена до стойкого улучшения состояния пациенток, а лечение экулизумабом до вакцинации и не менее двух недель после нее должно сопровождаться применением антибиотиков с антименингококковой активностью.



