Введение
Изучению легочной гипертензии (ЛГ) при ХБП посвящено небольшое количество работ, однако выводы относительно этиологии и патогенеза формирования данного заболевания остаются неоднозначными. Согласно европейским рекомендациям, группа ЛГ при ХБП выделена в отдельный (5-й) класс с неуточненной этиологией и мультифакторными механизмами развития [1]. Повышение давления в легочной артерии (ЛА) встречается у 18–68,8% пациентов, получающих ГД, у 12–42% лиц, находящихся на ПД, в 5% случаев после трансплантации почки, и у 2–25% людей с ХБП 1–4-й стадий [2–9]. Научные изыскания выявили обратную зависимость между уровнем давления в ЛА и скоростью клубочковой фильтрации (СКФ) [7–9]. В проспективных исследованиях наличие ЛГ у пациентов на ГД служило независимым предиктором высокой заболеваемости, смертности, отсроченной функции трансплантата и высокого риска смерти после пересадки почки [10–13].
Среди причин повышения легочного артериального давления (ЛАД) при ХБП рассматриваются гиперволемия сосудистого русла, наличие артериовенозной фистулы (АВФ) у пациентов на ГД, артериальная гипертензия (АГ), систолическая и диастолическая дисфункции сердца, нарушения фосфорно-кальциевого обмена, патологическое влияние уремических токсинов [9, 14–16]. Перечисленные факторы приводят к вазоспазму на пре- и посткапиллярном уровне, пролиферации средней и внутренней оболочек сосудов с последующей облитерацией просвета. Прогрессирующие морфологические преобразования в легких неизбежно индуцируют функциональные, а затем структурные изменения сердца [17]. Степень влияния и участие вышеуказанных причин в развитии ЛГ остаются до конца не выясненными.
Целью данного исследования стало определение особенностей развития и клинической картины ЛГ у пациентов с ХБП.
Материал и методы
Были обследованы 60 пациентов в возрасте от 18 до 70 лет с установленным диагнозом ХБП III–V стадий. В зависимости от наличия ЛГ и стадии заболевания больные были разделены на 4 группы: 1–20 пациентов с ХБП V стадии и ЛГ, получавших ГД; 2–20 больных ХБП V стадии и без ЛГ, получавших ГД; 3–15 пациентов с ХБП III–V стадий и без ЛГ; 4–5 больных ХБП III–V стадий и ЛГ. Причины ХБП: хронический гломерулонефрит – 43 случая, сахарный диабет – 6 пациентов, хронический пиелонефрит – 2 больных, подагра – 2, поликистоз почек – 5, гипертоническая болезнь – 2. Критериями исключения из исследования служили наличие у пациентов хронической обструктивной болезни легких, тромбоэмболии легочной артерии, дыхательной недостаточности 2–3-й ст., заболеваний грудной клетки, врожденных и приобретенных пороков сердца, стенокардии напряжения 3–4-го функциональных классов, хронической сердечной недостаточности 3–4-й ст. Всех больных исходно подвергали общеклиническим, лабораторным и инструментальным обследованиям. СКФ была определена по формуле CKD-EPI с учетом возраста, пола, уровня креатинина сыворотки крови. Пациентам, находившимся на заместительной почечной терапии, проводился стандартный бикарбонатный ГД через АВФ, три раза в неделю по 4 часа на аппаратах фирм «Фрезениус» (Германия) и «Гамбро» (США).

Индекс массы тела (ИМТ) вычислен по формуле А. Кетле: ИМТ=Масса/(рост2) кг/м2.
Инструментальные исследования, такие как спирометрия, электрокардиография (ЭКГ), эхокардиография (ЭхоКГ), осуществлялись после процедуры гемодиализа с целью исключения влияния гипергидратации организма на результаты обследования. Ультразвуковое исследование сердца выполнено одним специалистом, в М- и В-режимах аппаратом Акусон (США) по методике, предложенной Американским эхокардиографическим обществом. В ходе анализа регистрировали показатели среднего давления в ЛА (ср. ЛАД), толщину межжелудочковой перегородки (тМЖП) и задней стенки (ЗС) левого желудочка (ЛЖ), конечный систолический размер (КСР) ЛЖ, конечный диастолический размер (КДР) ЛЖ, диаметр правого желудочка (ПЖ) и левого предсердия (ЛП). Конечный объем ЛЖ в систолу (КСО) и диастолу (КДО), фракция выброса (ФВ) рассчитаны по методу J.S. Simpson. ЛГ диагностировалась при ср. ЛАД≥25 мм рт.ст.
Масса миокарда ЛЖ (ММЛЖ) рассчитана по формуле R.B. Devereux:
ММЛЖ=1,04×[(КДРЛЖ+тМЖП+ЗСЛЖ)3–КДРЛЖ3]–13,6.
Индекс массы миокарда ЛЖ (ИММЛЖ) определяли как отношение ММЛЖ к площади поверхности тела (S) по формуле: ИММЛЖ=ММЛЖ/S.
Критерием диагностики гипертрофии ЛЖ были приняты следующие показатели ИММЛЖ: для мужчин – более 115 г/м2, для женщин – более 95 г/м2.
Полученная доза гемодиализа оценивалась по уравнению J.T. Daugirdas: еКt/V=spKt/V-0,6×(spKt/V)/t+0,03; где spKt/V=Z-ln(R-0,008xt)+(4–3,5×R)×UF/W; R=1–URR;
URR=отношение последиализного уровня мочевины к преддиализному уровню;
UF-объем ультрафильтрации;
W – объем распределения мочевины.
Для обработки полученных данных использована компьютерная программа Statistica 7.0. С целью проверки нормальности распределения использовался критерий Шапиро–Уилка. Применены методы описательной статистики с вычислением средних значений (М) и стандартного отклонения (SD) для переменных с нормальным распределением и медианы (Мe), 25-й и 75-й процентили – при асимметричном распределении. Для выявления отличий количественных признаков использован дисперсионный анализ и t-критерий Стьюдента. Для сравнения количественных признаков в трех и более группах с нормальным распределением использован дисперсионный анализ. При сравнительном анализе качественных параметров применялся критерий Краскела–Уоллеса. Также для выявления отличий в трех и более группах с асимметричным распределением использовался критерий Краскела–Уоллиса, а для сравнения качественных признаков был применен χ2 Пирсона. Отличия считались статистически значимыми при p<0,05.
Результаты
По демографическим показателям у наших пациентов выявлена тенденция к развитию ЛГ на додиализной стадии ХПН в более молодом возрасте – 47,65±11,44 и 35,4±16,18 года (Р2–4=0,051). Однако по половому признаку группы пациентов были сопоставимыми (p>0,05). При объективном обследовании в выборках пациентов с ЛГ и без ЛГ, находившихся на ГД, мы зарегистрировали более низкий ИМТ (22,57±3,93, 22,43±3,3 и 25,93±5,78 кг/м2; Р1–3=0,02, Р2–3=0,02). В группе больных ЛГ и получавших ГД основной жалобой пациентов была одышка с тенденцией к значимому отличию (Р1–2=0,052), отеки отмечались с аналогичной тенденцией (Р1–2=0,058). Клинической находкой при проведении перкуссии явилось расширение правой границы сердца вправо у больных ЛГ, получавших и не получавших ГД (Р1–2=0,016; Р3–4=0,053). Другими отличительными признаками ЛГ выступили подъемы сист. АД (Р1–2=0,009; Р2–4=0,004; Р3–4=0,02) и диаст. АД (Р2–4=0,02). Одновременно в группе пациентов с ЛГ на ГД с достаточным уровнем достоверности установлена гепатомегалия (Р1–2=0,0098).
При лабораторном изучении образцов крови у пациентов с ХБП V стадии на додиализной стадии часто выявлялись снижение концентраций гемоглобина (Р1–3=0,005; Р2–3=0,002; Р3–4=0,04), числа эритроцитов (Р1–3=0,03) и гематокрита (Р1–3=0,0003; Р2–3=0,001; Р3–4=0,04). Среди биохимических показателей в 3-й группе пациентов без ЛГ и не получавших гемодиализ был отмечен низкий уровень альбумина крови (Р2–3=0,003), а у больных ЛГ и не получавших ГД ‒ гиперхолестеринемия (Р1–4=0,01). Группы пациентов с ХБП V стадии на додиализной стадии отличались от больных, находившихся на ГД, с более низким уровнем креатинина (Р1–3=0,046; Р1–4=0,008; Р2–3=0,003; Р2–4=0,001), гиперкалиемией (Р2–3=0,02) и относительно большей СКФ (Р2–3=0,002; Р2–4=0,004). В свою очередь у больных на ГД мы выявляли гипонатриемию (Р1–3=0,0006, Р2-3=0,0006), указывающую на гипергидратацию организма, гиперкальциемию (Р2–3=0,028), вызванную нарушением фосфорно-кальциевого обмена.
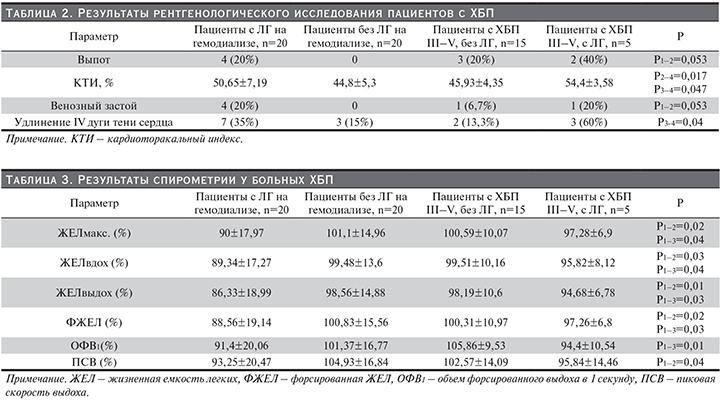
Рентгенография
При рентгенологическом обследовании у пациентов с ЛГ и на ГД чаще регистрировались наличие выпота в плевральных полостях (Р1–2=0,053) и признаки венозного застоя в легких (Р1–2=0,053). Больные ЛГ, не получавшие ГД, характеризовались увеличенным кардиоторакальным индексом (КТИ) (Р2–4=0,017; Р3–4=0,047) и удлинением IV дуги тени сердца (Р3–4=0,04) за счет увеличенного ЛЖ.
Спирометрия
Исследование функции внешнего дыхания (ФВД) среди пациентов с ЛГ, получавших ГД, выявило снижение максимальной и форсированной жизненной емкости легких (ЖЕЛ) (Р1–2=0,02; Р1–3=0,04; Р1–2=0,02; Р1–3=0,03), ЖЕЛ при вдохе и выдохе соответственно (Р1–2=0,03; Р1–3=0,04; Р1–2=0,01; Р1–3=0,03). В других легочных тестах у данных больных мы зафиксировали уменьшение объема форсированного выдоха (ОФВ1) (Р1–3=0,01) и пиковой скорости выдоха (ПСВ) (Р1–2=0,04).
ЭКГ и ЭхоКГ
На основании электрокардиографии гипертрофия ЛП (ГЛП) в исследуемых группах регистрировалась одинаково часто (p>0,05). Однако в 4-й группе больных ХБП V и ЛГ по сравнению с пациентами 3-й группы с ХБП и без ЛГ чаще встречалась гипертрофия ЛЖ (ГЛЖ) (Р3–4=0,03) и ПЖ (ГПЖ) (Р3–4=0,05). По результатам ЭхоКГ, подъем давления в ЛА у пациентов с ЛГ на ГД и без ГД по сравнению с другими группами имел значимые отличия (Р1–2<0,001; Р1–3<0,001; Р2–4<0,001; Р3–4<0,001).
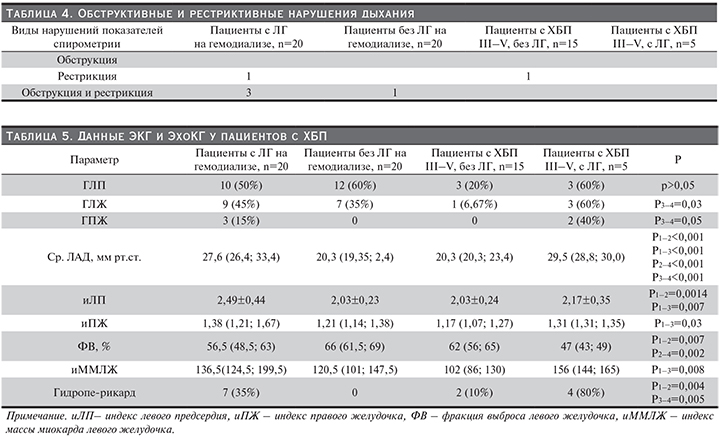
Увеличение индексов ЛП и ПЖ также отмечены в группах с ЛГ и ГД (Р1–2=0,0014; Р1–3=0,007; Р1–3=0,03). Снижение сократительной функции сердца зафиксировали у больных ЛГ, получавших и не получавших ГД (Р1–2=0,007, Р2–4=0,002). Увеличение массы миокарда ЛЖ установлено у пациентов с ЛГ и ГД (Р1–3=0,008).
Выпот в полости перикарда при ультразвуковом исследовании сердца чаще выявлялся в группах пациентов с ЛГ независимо от вида терапии (Р1–2=0,004; Р3–4=0,005).
Обсуждение
При нашем обследовании 51 больного на ГД ЛГ была выявлена у 23 (45%) больных и у 5 (25%) из 20 пациентов с ХБП III–V на додиализной стадии. Полученные результаты совпадают с литературными данными, согласно которым ЛГ у пациентов на гемодиализе встречается в 25–56%, а на додиализной стадии ‒ в 20 % случаев [8, 11, 12, 14]. В нашем исследовании ХБП, осложненная ЛГ, отмечена в более молодом возрасте, однако в других исследованиях повышенное давление в ЛА ассоциировалось со старшим возрастом пациентов [10]. Данный факт, по-видимому, связан с преобладанием молодого населения в данной популяции, скрытым течением ХБП и поздним обращением больных. Отсутствие связи между ЛГ, полом и ИМТ пациентов, как и во многих других исследованиях, подтверждено в нашей работе [9, 12, 18, 19].
«Золотым стандартом» в диагностике ЛГ является прямое определение давления в ЛА с помощью катетеризации правых отделов сердца. Данный метод применил S. Pabst и соавт. в отношении пациентов с ХБП V ст., при этом ЛГ выявлена в группах пациентов, получавших и не получавших ГД. Повышение давления в ЛА было вызвано патологическими изменениями на пре- и посткапиллярном уровнях [20]. Для сравнения: распространенность прекапиллярной ЛГ в общей популяции составляет 15 случаев на 1 млн населения [21].
ЛГ характеризуется скудной клинической картиной, отсутствием патогномоничных признаков и наличием таких неспецифических симптомов, как усталость, отеки, загрудинные боли и одышка [7, 22]. Данный синдром начинает проявляться только при двукратном повышении давления в ЛА. В нашем исследовании пациенты с ЛГ жаловались на одышку в 11 (55%) случаях, а отеки выявили только у 7 (38%) пациентов. Симптомы правожелудочковой недостаточности проявлялись в виде увеличения правых отделов сердца и гепатомегалии в 8 (40 %) и 9 (45 %) случаях соответственно.
В исследовании R. Hekmat на протяжении процедуры ГД и в конце зафиксировано значимое уменьшение выраженности респираторных жалоб и улучшение показателей ФВД [23]. Мы в своей работе также отметили снижение показателей ЖЕЛ, ФЖЕЛ, ОФВ1, ПСВ у пациентов с ЛГ. P. Kovacevic и соавт. сообщают о наличии связи между низкими показателями спирометрии у больных, получавших заместительную почечную терапию, с высокими уровнями NO, эндотелина в крови по сравнению со здоровыми субъектами [24]. Однако израильские ученые при обследовании пациентов, получавших ГД, пришли к выводу о том, что повышение давления в ЛА сопровождается увеличением сердечного выброса, высоким содержанием эндотелина-1 и низким уровнем метаболитов NO [25]. ЛГ при ХБП сопровождается эндотелиальной дисфункцией и воспалением, которые приводят к сужению и облитерации мелких сосудов легких.
Задержка жидкости в организме, наблюдаемое при ХБП, приводит к увеличению межклеточной жидкости со сдавлением мелких бронхиол. При проведении зональной рентгеноденситометрии легких у пациентов, получающих ГД, отмечено снижение суммарных показателей вентиляции [26]. На основании ультразвукового обследования 392 пациентов, находящихся на ГД, C. Zocalli и коллеги заключили, что у больных ЛГ гидратация легких приводит к появлению т.н. В-линий [27]. Гипертензионный и гиперволемический синдромы малого круга кровообращения морфологически были подтверждены при аутопсии больных тХПН, получавших ГД [28].
Нельзя не отметить влияния АВФ на гемодинамику у больных, находящихся на ГД, которая приводит к увеличению венозного возврата к сердцу, повышению легочного кровотока и сердечного выброса. В экспериментах временное сдавление АВФ, трансплантация почки, а также уменьшение просвета сосудистого анастомоза хирургическим путем приводили к снижению ЛАД, сокращению увеличенных камер сердца и улучшению показателей функции сердца [29,30]. Напротив, A. Unal и G. Agaturk в своих исследованиях не выявили корреляции между скоростью кровотока в АВФ и уровнем давления в ЛА [31, 32].
Согласно закону Франка–Старлинга, растяжение сосудистого русла и сердца в результате гиперволемии приводит к увеличению силы сокращений и повышению АД. Нарушение расслабления ЛЖ вызывает дилатацию ЛП и застой крови в легочных венах [7, 12, 15]. В нашем исследовании в группе пациентов с ЛГ чаще регистрировались увеличение иММЛЖ, иЛП, иПЖ и снижение ФВ ЛЖ. При рентгенологическом исследовании у пациентов с ЛГ выявлены признаки венозного застоя и кардиомегалии. М.Ю. Дудко и соавт. в своей работе регистрировали снижение повышенного АД, уменьшение количества сердечно-сосудистых осложнений и улучшение качества диализа при строгом контроле волемического статуса организма с помощью биоимпедансометрии [33].
Другие ученые высказывают предположение о связи ЛГ с высоким уровнем паратиреоидного гормона, который приводит к кальцификации сосудистого русла и снижению податливости стенок легочных сосудов [5, 34, 35]. В исследовании R. Agarwal прием препаратов витамина D, размер ЛП, а также уровень URR стали независимой детерминантой ЛГ [12]. Однако нам не удалось установить связи повышенного ЛАД с гиперкальциемией. В других независимых исследованиях связь между степенью кальцификации легких с уровнем паратиреоидного гормона и ЛГ не установлена [36, 37]. В рандомизированном контролируемом PRIMO-исследовании применение парикальцитола не вызывало статистически значимого улучшения показателей диастолической функции сердца и снижения повышенного ЛАД [38].
Заключение
Проведенное исследование позволяет нам сделать вывод, согласно которому нарушение почечной функции при ХБП приводит к гипергидратации организма с развитием ЛГ независимо от традиционных факторов риска сердечно-сосудистых заболеваний. Повышение давления в ЛА ассоциируется с подъемом АД, снижением показателей спирометрии, рентгенологическими изменениями в легких, увеличением и гипертрофией камер сердца. Увеличение объема ультрафильтрации и достижение «сухого веса» пациентами с ЛГ на ГД могут уменьшить частоту данного осложнения.
Авторы заявляют об отсутствии конфликта интересов.



