Гиперкалиемия – одно из наиболее частых электролитных нарушений у больных хронической болезнью почек (ХБП) 3–5-й стадий, требующее ускоренных терапевтических мер из-за высокой опасности нарушения сердечного ритма. Понимание причин, факторов риска, клинических последствий и принципов терапии, а также профилактики позволит улучшить выживаемость больных и повысить качество жизни.
Частота гиперкалиемии в общей популяции и у больных ХБП
В общей популяции частота гиперкалиемии относительно невелика и отмечается у 2,6–3,5% больных, госпитализированных по любым причинам [1, 2]. Значительно выше частота гиперкалиемии у больных ХБП и сниженной скоростью клубочковой фильтрации (СКФ). Так, в исследовании P.A. Sarafidis и соавт. (2012) среди больных с СКФ<20 мл/мин (ср. – 14,4±4,6 мл/мин) у 23,1% уровень калия сыворотки составил 5,5–6,0 ммоль/л, у 8,4% >6,0 ммоль/л [3]. В другом более объемном исследовании, включавшем 1277 больных со средней СКФ 37 мл/мин, число больных с уровнем калия сыворотки > 5,3 ммоль/л составило 7,7%, однако 42% из всех больных в течение 2,7 года наблюдения отмечали хотя бы один эпизод гиперкалиемии [4]. По данным И.Г. Каюкова и соавт. (2013), возможность гиперкалиемии увеличивается по мере падения СКФ и средние значения калия сыворотки возрастают от 4,5 ммоль/л на 1-й стадии до 5,36 на 5-й [5]. По мере того как ХБП прогрессирует от 3а-стадии к 3б- и 4-й стадиям, частота гиперкалиемии, определяемой как уровень калия >5,1 ммоль/л, возрастает с 23,5% до 33 и 47,7% соответственно [6]. У больных на гемодиализе распространенность гиперкалиемии еще выше: согласно данным С.P. Kovesdi и соавт. (2015), у 12,5% больных средний 3-месячный преддиализный уровень калия был >5,5 ммоль/л [7]. Среди трансплантированных больных, получающих кальцийнериновые блокаторы эпизодическая гиперкалиемия наблюдается у 44–73% больных [8].
Гиперкалиемия и смертность
Гиперкалиемия (начиная с уровня калия сыворотки >5,1 ммоль/л) ассоциирована с повышенной смертностью больных с сохранной функцией почек и при всех стадиях ХБП. У больных острым инфарктом миокарда повышение смертности отмечено при уровне калия >4ммоль/л, а желудочковой фибрилляции – при уровне >5 ммоль/л [9]. Кривая зависимости смертности от уровня калия сыворотки у этих больных имеет U-образную форму и наименьший риск смерти соответствует нормальному уровню калия от 3,5 до 4,5 ммоль/л. Аналогичная U-образная кривая, характеризующая связь летальных исходов и уровня калия сыворотки, представлена для больных ХБП как до, так и после начала заместительной почечной терапии (ЗПТ) [10]. При сравнении смертности в ближайшие сутки после повышения калия у больных ХБП и без нее было продемонстрировано, что смертность выше при сохранной функции почек и снижается по мере прогрессирования ХБП, так что относительный риск однодневной смерти при гиперкалиемии в 4 раза выше у больных с нормальной функцией почек по сравнению с ХБП 5-й стадии [2]. Это, с одной стороны, говорит о том, что частые эпизоды гиперкалиемии способствуют выработке адаптивных механизмов у больных со сниженной СКФ, с другой – свидетельствуют, что появление гиперкалиемии у больных без нарушения функции почек связано с более тяжелыми состояниями.
В то же время риск внезапной смерти на фоне гиперкалиемии выше у больных на гемодиализе, что связано с резкими колебаниями уровня калия во время процедуры диализа (особенно с низкокалиевым диализатом), сопровождающиеся дополнительными факторами риска в виде гипокальциемии, гипомагниемии, колебаний КЩС [11].
Причины гиперкалиемии
Основные причины гиперкалиемии представлены в табл. 1.
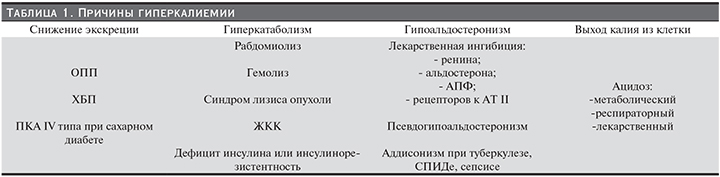
Следует отметить, что у больных ХБП может сочетаться несколько факторов риска гиперкалиемии. Например, помимо снижения экскреции калия на фоне уменьшения количества действующих нефронов у больного могут присутствовать метаболический ацидоз, гиперкатаболизм, инсулинорезистентность.
Кроме того, действие ряда лекарственных препаратов, принимаемых на фоне ХБП со снижением СКФ, осложняется гиперкалиемией. Перечень таких препаратов и механизм развития гиперкалиемии при их приеме представлены в табл. 2.
Отдельного обсуждения заслуживает гиперкалиемия, возникающая при приеме ингибиторов ренин-ангиотензин-альдостероновой системы (иРААС).
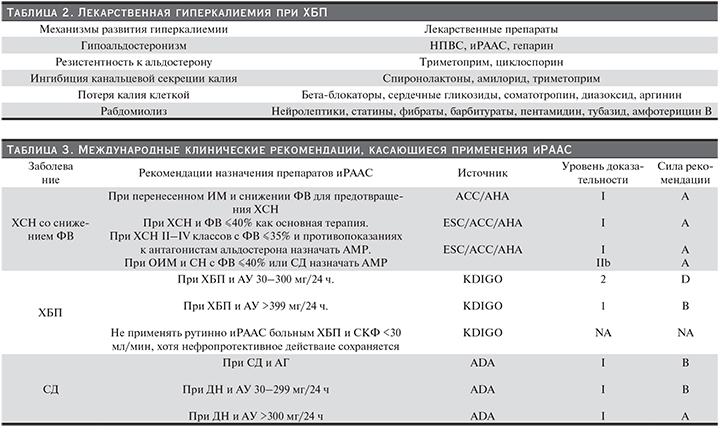
РААС является центральным звеном патогенеза сердечно-сосудистых заболеваний (ССЗ) и ХБП. Ингибиторы РААС обеспечивают многочисленные благоприятные эффекты: уменьшают АД, предупреждают повреждение органов-мишеней при ГБ, СД, ХСН и резистентной АГ [12–14]. Важно, что ингибиция РААС достоверно снижает риск неблагоприятных исходов при этих заболеваниях. Со времени публикации результатов исследования CONSENSUS 20 лет назад [15], применение терапии иРААС прочно вошло в лечебную практику, адаптировано к различным клиническим ситуациям с созданием схем терапии как моно-, так и комбинированного приема препаратов. В настоящее время применяются три основных класса иРААС: ингибиторы ангиотензин-превращающего фермента (иАПФ), блокаторы рецепторов к ангиотензину II (БРА) и антагонисты минералокортикоидных рецепторов (АМР). К последним относятся давно известный спиронолактон и недавно появившиеся эплеренон и канренон. Четвертый класс агентов (прямые ингибиторы ренина) в процессе активного изучения. Эти препараты входят во все международные кардиологические, нефрологические и эндокринологические клинические рекомендации (табл. 3).
В отечественных Национальных рекомендациях по нефрологии, опубликованных в 2016 г., иРААС также выступают в качестве препаратов первой линии для лечения артериальной гипертензии, нефропротекции, в качестве антипротеинурического средства [16].
Недавние исследования заострили внимание на нескольких важных аспектах применения иРААС, которые ранее подробно не рассматривались. Во-первых, частота гиперкалиемии, доложенная в исследованиях RALES, EPHESUS, EMPHASIS-HF, не соответствует таковой в реальной клинической практике. Частота гиперкалиемии в РКИ составляла 2–2,5%, в то время как в реальной практике – 6–12% [17]. В дополнение по мере прогрессирования ХБП частота НК и СД возрастает [18]. Увеличение коморбидности ведет к увеличению риска гиперкалиемии, что основано на увеличении требуемого сопутствующего лечения. В то же время снижение дозы или отмена препаратов иРААС у больных ХБП 3–5-й стадий достоверно повышает неблагоприятные исходы (сердечно-сосудистые катастрофы) и смертность этих больных. В исследовании М. Epstein и соавт. (2015) изучены данные длительного наблюдения 43288 больных ХБП 3–4-й ст., принимавших иРААС в дозах максимальных (рекомендуемых), субмаксимальных (ниже рекомендуемых) или прервавших прием (отсутствие приема ≥380 дней). Определялась частота достижения комбинированной конечной точки (сердечно-сосудистые события, ТХБП и смерть) и отдельно смерти от любых причин. Было показано, что у больных, принимавших максимальную дозу иРААС, частота достижения комбинированной конечной точки составила 42,6%, при снижении дозы – 47,4%, при отмене препарата – 54,4% (р<0,001). Равно и смертность составила 9,8%; 20,3 и 22,4% соответственно [6].
Основной (или одной из основных) причиной отказа от использования иРААС в полной мере больными ХБП стала гиперкалиемия, которая мешала начать или продолжить терапию [19]. Например, T. Yildirim и соавт. [20] исследовал барьеры, которые не позволили начать или продолжить терапию иАПФ. Проанализированы 279 больных, средний возраст – 56,7±15,2 года, средняя СКФ – 33,3±15,1 мл/мин; иАПФ использовали 68,8% больных, среди больных сахарным диабетом II типа (СД2) – 67,7%. Гиперкалиемия была основной причиной, по которой не назначали или отказывались от продолжения лечения иАПФ. К сожалению, предварительный отбор больных для назначения иРААС с целью избежать развития гиперкалиемии, не гарантирует успеха. В новом исследовании, PARADIGM-HF [21] (сравнение сочетанного препарата иАПФ и ингибитора неприлизина (валсартан+сакубитирил) с иАПФ ), исключались больные с повышенным риском развития гиперкалиемии: с СКФ<30 мл/мин, с калием >5,2 ммоль/л. Более того, в процессе предварительного ran-in-периода исследования были исключены еще 12% больных, у которых были зафиксированы эпизоды повышения уровня калия. Однако у больных, в конечном итоге включенных в исследование, гиперкалиемия развилась в 16,1% в группе валсартан+сакубитрил (n=4176) и 17,3% в группе эналаприла (n=4203).
При данной частоте и достоверности гиперкалиемии у больных ХБП и сердечно-сосудистыми заболеваниями становится обычным снижать дозу или даже отменять иРАAС при угрозе развития гиперкалиемии. Как правило, уровень калия повышается с 4 до 5 ммоль/л, если больной принимает иРААС, но повышение может быть значительно больше, если больной одновременно принимает другие препараты, повышающие уровень калия, или фрукты с большим содержанием калия, или пищевые добавки. Такая ситуация диктует необходимость наличия хорошо переносимого и простого способа контроля уровня калия для больных ХБП и сердечно-сосудистой патологией, принимающих иРААС.
У больных, получающих диализ, проблема гиперкалиемии остается одной из основных и ощутимо влияет на частоту внезапной смерти (достигающую 25% от всех смертей на диализе) [22]. Многие исследования отмечали, что наибольшее количество сердечно-сосудистых осложнений (в т.ч. внезапной смерти) происходит у больных, получающих гемодиализ, на первой процедуре (или сразу после нее), которая проводится после двудневного перерыва. По данным исследования DOPPS, проведенного в 930 гемодиализных центрах, расположенных в 12 странах и включившего 37 764 больных, наблюдавшихся с 1996 по 2008 г., терапия гиперкалиемии у больного на процедуре гемодиализа при помощи низкокалиевого (<3 ммоль/л) диализата достоверно повышала частоту смерти от любых причин, в т.ч. внезапной смерти [23].Поскольку число больных, у которых преддиализный уровень калия превышает 6 ммоль/л, достигает 50% в первый диализный день после двудневного перерыва, перед врачом встает серьезная проблема: если увеличить уровень калия в диализает >3 ммоль/л, снижение калия в плазме больного будет плавным и гарантирующим отсутствие значительных колебаний, а следовательно, и повышенного риска неблагоприятных исходов, но в междиализный период быстро разовьется гиперкалиемия. В случае же гемодиализа с использованием низкокалиевого диализата снижение уровня калия в плазме будет значительным, что предотвратит быстрое восстановление гиперкалиемии в междиализный период, но зато повысит риск внезапной смерти.
Прежде чем обсуждать терапевтическую стратегию при гиперкалиемии, следует разобрать механизмы, поддерживающие баланс калия в организме и их изменение при ХБП.
Баланс калия в норме и при ХБП
Контроль и поддержание гомеостаза калия в организме хорошо изучены и могут быть определены как классический механизм «обратной связи».
Обычный человек, питающийся в рамках западной диеты (рацион питания, привычный для жителя Европы), потребляет в среднем 70–80 ммоль (2800–3120 мг) калия в день [24].
В кишке весь поступивший калий абсорбируется и поступает в печень через гепатопортальную систему циркуляции.
В нормальных условиях с фекалиями удаляется минимальное количество калия. Принципиальным механизмом, противостоящим перегрузке организма калием, является выделение калия почками. Калий свободно фильтруется в клубочке, реабсорбируется в проксимальном канальце и затем секретируется в дистальном канальце и сегментах собирательных трубочек в коре и прилегающей медуллярной ткани; 75% клеток собирательных трубочек представлены главными клетками, которые реабсорбируют натрий и секретируют калий, а также являются клетками-мишенями для ангиотензина II, альдостерона, антагонистов минералокортикоидных рецепторов и калий-сберегающих диуретиков.
Главные клетки используют электрохимический градиент, устанавливаемый вхождением натрия в клетку через натривые каналы на люминальной мембране (молекулярная мишень для амилорида), и натрий/калиевую аденозинтрифосфатазу (Nа-K-АТФаза) на базолатеральной мембране для обеспечения секреции калия через два типа калиевых каналов [25]. Один класс, почечные внутримедуллярные калиевые каналы, также называемые ROMK, секретируют калий при нормальных условиях тубулярного потока. Другой класс калиевых каналов представляет собой «большие» кондуктивные каналы (также называемых BK-каналами), которые относительно неактивны в обычных условиях, но резко повышают активность при высоком тубулярном потоке или в условиях повышенной калиевой нагрузки. Фактором, регулирующим секрецию калия главными клетками, служат потребление калия, уровень внутриклеточного калия, поступление натрия в клетку, скорость мочетока, гормоны (альдостерон и катехоламины). Другие клетки собирательных трубочек – вставочные – отвечают за кислотно-основную регуляцию, но повышают экспрессию люминальной водород-калиевой аденозинтрифосфатазы (Н/К-АТФаза) при недостатке калия, увеличивая реабсорбцию калия. Система «обратной связи» в регуляции калия состоит из каскада шагов. В ответ на высококалиевую пищу, которая включает глюкозу, секреция инсулина активирует Na-K-АТФазу поперечно-полосатых мышц и печени, способствуя накачиванию калия из плазмы в клетку. Этот механизм минимизирует постпрандиальное повышение калия в плазме. В процессе работы мышц калий перемещается в плазму и фильтруется в клубочке. Таким образом, поступивший с пищей калий эксретируется в мочу и поддерживается нейтральный баланс калия.
Если повышенное потребление калия значимо увеличивает концентрацию калия в плазме, клетки надпочечников усиливают секрецию альдостерона, стимулирующего активность и синтез Na-K-АТФазы в люминальных калиевых каналах в главных клетках собирательных трубочек, что приводит к секреции избыточного калия. Кроме того, альдостерон повышает экскрецию калия в дистальных отделах толстой кишки [26]. Эта функция особенно важна при адаптации к сниженной работоспособности почек.
Напротив, если потребление калия низкое или экскреция калия с мочой избыточна, концентрация калия в плазме снижается и регуляция по обратной связи активизируется, восполняя недостаток из внутриклеточного пространства и минимизируя гипокалиемию. Одновременно мышцы становятся инсулинорезистентными для поглощения калия (но не глюкозы). Интересно, что инсулин продолжает стимулировать поступление глюкозы в клетку, в то время как поступление калия затрудняется. Это может быть следствием падения активности или числа натриевых насосов. Такое снижение транспорта калия в клетку случается даже до того, как уровень калия в плазме заметно уменьшается.
Если гипокалиемия становится явной, экспрессия мышечной ɑ2-изоформы Na-K-АТФазы снижается, что обеспечивает перемещение достаточного количества калия из внутриклеточного пространства в плазму. Низкая концентрация калия в плазме подавляет выделение альдостерона надпочечниками, в результате почки могут реабсорбировать 99%, профильтровавшегося калия. Эта консервация калия почками включает подавление секреции калия ROMK каналами в главных клетках собирательных трубочек. В условиях недостатка калия реабсорбция калия происходит даже в собирательных трубочках. Как полагают, это связано с активацией апикальной H/K-АТФазы в вставочных клетках.
«Обратная связь» не единственный путь компенсации экскреции калия. Существует дополнительный механизм, поддерживающий гомеостаз калия, который обозначен как «прямая связь». Примером «прямой связи» может служить условный рефлекс саливации у собак Павлова в предвкушении приема пищи, прежде чем пища реально потребляется. В случае регуляции баланса калия в ответ на повышение содержания калия в пище, которое не может немедленно значительно изменить концентрацию калия в плазме и запустить механизм обратной связи, запускается процесс быстрого изменения почечной экскреции калия через прямую связь.
Почти 30 лет назад Rabinowitz и соавт. [27] провели серию экспериментов на овцах, которые продемонстрировали, что количество калия в пище, поступившей в желудок, пропорционально достоверно повышает экскрецию калия почками. При этом было показано, что усиление мочевой экскреции калия не имеет отношения к повышению калия в сыворотке или СКФ и, следовательно, не может быть связано с увеличением количества профильтровавшегося калия, а отражает повышение секреции калия канальцами. Было также продемонстрировано, что эти процессы не связаны с секрецией альдостерона, т.к. его концентрация в плазме не менялась. Более того, дополнительная инфузия альдостерона, как и введение антагониста альдостерона (канренола), не меняли направленность и активность процесса. Скорость мочетока, степень экскреции натрия, рН мочи не влияли на экскрецию калия в этих экспериментах. Авторы заключили, что в осуществлении «прямой связи» задействованы неидентифицированные рецепторы, расположенные в местах до центральной циркуляции, которые реагируют на повышение калия в потребляемой пище и инициируют экскрецию его почками.
После этого было проведено много исследований, направленных на подтверждение этого феномена и на определение места расположения специфических калиевых рецепторов в желудочно-кишечном тракте (ЖКТ). Calo и соавт. [28] продемонстрировали, что в условиях водного диуреза экскреция калия возрастает в течение 20 минут после калиевой нагрузки, когда ни уровень калия в плазме, ни секреция альдостерона еще не изменились. Недавно Preston и соавт. [29] в исследовании с участием 32 здоровых добровольцев подтвердили наличие ЖКТ-почечного сигнального калийуретического пути, в т.ч. в условиях блокады секреции альдостерона, что свидетельствует о независимости этого пути от воздействия альдостерона. Предположения о месте расположения рецепторов, регистрирующих повышение калия в содержимом ЖКТ, были разными: некоторые исследования показывали вовлечение гепатопортальной области [30], другие позволяли утверждать, что основным источником сигналов является желудок [31]. Исследовалась заинтересованность ряда ЖКТ и внеинтестинальных гормонов (гуанилин, глюкагоноподобный пептид, аргинин-вазопрессин, меланоцит-стимулирующие гормоны) в процессе передачи сигнала от ЖКТ к клеткам канальцев [32], однако такой связи выявлено не было. Пока идентифициорвать гуморальный фактор взаимосвязи между ЖКТ и почками не удалось, но определенно показана активация почечной калликреин-кининовой системы в ответ на повышение содержания калия в пище или на острую нагрузку калием, что вело к повышению калликреина в такни почки. Было продемонстрировано, что калликреин активирует экскрецию калия главными клетками собирательных трубочек и снижает реабсорбцию вставочными клетками [33].
Экскреция калия подчиняется циркадному ритму, как и другие параметры работы почек (СКФ, почечный плазматок, секреция и реабсорбция основных мочевых электролитов). Пик экскреции калия приходится на середину дня и не зависит от физической активности, диетических изменений, диуреза. Предполагается, что циркадный ритм экскреции регулируется альдостероном [34] и циркадным ритмом экспрессии mРНК в клетках дистального нефрона [35].
Как упоминалось выше, выделение калия через кишечник составляет около 10% потребленного количества. Таким образом, при западной диете с потреблением калия на уровне 80 мэкв/сут (3128 мг) это соответствует 8 мэкв (312,8 мг). У здоровых индивидуумов большая фракция потребленного калия абсорбируется в тонком кишечнике и вклад толстой кишки в общее количество абсорбированного или секретированного калия мал. В тонком кишечнике и толстой кишке абсорбция калия пассивна, в толстой кишке также происходит пассивная секреция калия. Cекреция калия в толстой кишке как путь выведения калия начинает играть определенную роль в гомеостазе калия при терминальной уремии [36]. Одним из важных основных аспектов транспорта калия в толстой кишке является его сегментарная дифференциация: проксимальная часть толстой кишки секретирует калий, в то время как дистальная часть абсорбирует. Применение сорбентов калия позволяет снизить абсорбцию калия в дистальной части, не влияя на секрецию в проксимальной части.
Подтверждение диагноза гиперкалиемии
Наличие гиперкалиемии должно быть подтверждено повторным лабораторным исследованием: следует принимать во внимание возможность быстрого перераспределения калия между вне- и внутриклеточным пространством, ошибку лаборанта, циркадные колебания. Необходимо также дифференцировать псевдогиперкалиемию, возникающую при технических ошибках в методике взятия крови из вены, высоком лейкоцитозе и тромбоцитозе [37]. Например, «работа кулаком» при взятии крови из вены может привести к повышению уровня калия в полученной для анализа крови на 1 ммоль/л, поскольку при работе мышц калий активно перемещается из клетки [38]. По этой же причине калий сыворотки может быть повышен сразу после физических упражнений. Повторное наложение жгута способствует повреждению эритроцитов и гемолизу, что может отразиться на уровне калия в крови, отобранной для исследования [39].
Клинические признаки гиперкалиемии
В зависимости от уровня калия сыворотки гиперкалиемия подразделяется на легкую (5,5–6,5 ммоль/л), выраженную (6,5–7,5 ммоль/л) и тяжелую (>7,5 ммоль/л). Однако яркость клинической симптоматики гиперкалиемии зависит не только от степени повышения уровня калия, но и от быстроты развития гиперкалиемии, сочетания с другими электролитными нарушениями, приемом лекарственных препаратов и сопутствующих заболеваний, поэтому нет прямой зависимости между уровнем калия и определенными симптомами. Нередко гиперкалиемия протекает бессимптомно или сопровождается неспецифическими изменениями самочувствия: парестезиями, мышечной слабостью, тошнотой, парезом кишечника, сердцебиением. Наиболее патогномоничны нарушение ритма сердца (чаще всего – выраженная брадикардия) и изменения на ЭКГ. Гиперкалиемия снижает трансмембранный градиент калия, что ведет к повышению калиевой проводимости, и это укорачивает продолжительность действующего потенциала [40]. Когда калий достигает уровня от 5,5 до 6,5 ммоль/л, появляется остроконечный Т-зубец и пролонгированный PR-сегмент, при дальнейшем увеличении уровня калия QRS становится все более широким, возникает фасцикулярная блокада и блокада ножек пучка Гиса, затем ЭКГ приобретает вид «синусоиды» и наконец развивается асистолия [41]. Тем не менее нельзя полагаться на ЭКГ для определения тяжести гиперкалиемии [42]. Тяжелая гиперкалиемия может сопровождаться незначительными изменениями на ЭКГ или изменения могут вовсе отсутствовать [43]. Старческий возраст и наличие сахарного диабета также ассоциируются с меньшей частотой появления патологического Т-зубца [44]. В то же время отсутствие изменений на ЭКГ не гарантирует благоприятного исхода. Гиперкалиемия может стать причиной нарушения функционирования песмейкера или имплантированного дефибрилятора. Уширение QRS, спонтанные Т-зубцы могут быть проявлением неадекватной работы кардиостимуляторов и в конечном итоге привести к кардиогенному шоку [45]. Из всего сказанного можно сделать вывод: при подтвержденном наличии гиперкалиемии следует начинать корректирующую терапию независимо от степени клинических проявлений.
Заключение
Приведенные в обзоре данные свидетельствуют о значительной распространенности гиперкалиемии в популяции кардиологических больных, больных СД 2 и больных 3–5-й стадиями ХБП. Причины гиперкалиемии многочисленны и разнообразны и нередко носят ятрогенный характер. Гиперкалиемия достоверно повышает частоту сердечно-сосудистых осложнений и снижает выживаемость этих больных. Знание причин и проявлений гиперкалиемии позволяет проводить профилактические мероприятия, препятствующие ее развитию, а при возникновении – своевременно диагностировать и начинать эффективную терапию.



