Введение
Важная роль тубулярного компонента почечной ткани для образования активных метаболитов витамина D, гормонзависимый процесс регуляции их синтеза и рецепции указывают на тесную взаимосвязь патологии почек и нарушений обмена витамина D [1, 2]. Ряд работ посвящен роли витамина D при хронической болезни почек (ХПБ), мочекаменной болезни (МКБ), рахитоподобных заболеваниях [3–5]. Значение дефицита витамина D в патогенезе нейрогенных расстройств мочеиспускания ранее практически не изучалось. Только в работе L. Li et al. [6] показано возможное значение дефицита кальцитриола в развитии энуреза у детей 5–7-летнего возраста. Согласно полученным результатам, распространенность энуреза в группе детей с концентрациями предшественника кальцитриола 25(OH)D3, превысившими 20 нг/мл, составила лишь 7,3%, тогда как у 17,5% детей этот показатель был ниже 20 нг/мл. Таким образом, дети с более высокой частотой ночного недержания мочи имели более низкие концентрации 25(ОН)D3 [6].
Роль нарушений фосфорно-кальциевого обмена (ФКО), прежде всего гиперкальциурии, в развитии нейрогенных расстройств мочеиспускания изучена в большей степени. В ряде исследований показано, что гиперкальциурия у детей часто сочетается с различными жалобами со стороны мочевого тракта, включая повышенную частоту мочеиспусканий, императивные позывы к мочеиспусканию, дизурию, ночной энурез. Используя кальций-креатининовый коэффициент, американские исследователи провели ретроспективный анализ состояния 288 детей с функциональными нарушениями опорожнения на протяжении 8 лет. Оказалось, что во всех группах число детей, имевших идиопатическую гиперкальциурию, колебалось от 21 до 30% [7]. Подобная частота нарушений опорожнения мочевого пузыря пациентов с идиопатической гиперкальциурией, значительно превосходившая показатели контрольных групп, подтверждена и в работах других авторов. Так, среди 529 детей с дизурией и дневным учащением мочеиспускания гиперкальциурию имели 32,2 и 32,6% соответственно [8].
Если ранее во всех работах речь шла об идиопатической гиперкальциурии, то в последние годы рассматривается связь гиперкальциурии с физиологически активным витамином D, описывается зависимая и не зависимая от 1,25 (ОН)2D гиперкальциурия [1]. В большинстве работ связь между гиперкальциурией, витамином D и паратгоромоном не подтверждена [1, 9]. Однако ряд исследований указывает на роль витамина D в развитии гиперкальциурии у больных МКБ [3, 10].
Таким образом, весьма вероятно, что существуют общие возможные патогенетические механизмы развития нейрогенных расстройств мочеиспускания, связанные с нарушениями ФКО и витаминD-дефицитных состояний.
Цель исследования: установить особенности ФКО и содержание витамина D у детей с нейрогенными дисфункциями мочевого пузыря.
Материал и методы
В обследование были включены 25 детей, средний возраст которых составил 10,4±3,6 года, из них мальчиков 13, девочек 12, находившихся на стационарном лечении в нефрологическом отделении с диагнозом «нейрогенная дисфункция мочевого пузыря». Основные критерии исключения: 1 – значимая структурная патология органов мочевой системы; 2 – наличие воспалительных заболеваний мочевых путей на момент включения в исследования; 3 – установленный диагноз рахитоподобных или других заболеваний, потенциально оказывающих значимое влияние на ФКО.
Всем пациентам проведено обследование, включившие общеклинические методики, функциональные почечные пробы, ультразвуковое исследование внутренних органов, почек и мочевого пузыря, урофлоуметрию. По показаниям проводили внутривенную урографию и микционную цистоуретрографию. В соответствии с задачами исследования всем пациентам проведено измерение в плазме крови 25-гидроксихолекальциферола как показателя уровня витамина D и паратгормона (ПТГ). Результаты оценивали согласно рекомендации Ассоциации американских эндокринологов 2011 г.: дефицит – менее 20 нг/мл, недостаток – 20–30 нг/мл, нормальные значения от 30 до 100 нг/мл. Для оценки ФКО исследовали уровни кальция и фосфора крови, а также содержание кальция и фосфора в суточной моче. За нормативные значения для уровня кальции в крови принимали 2,2–2,5 ммоль/л, фосфора – 1,3–2,1 ммоль/л, суточной кальциурии – 2,5±7,7 ммоль/сут [11]. Дополнительно измеряли уровень остеокальцина в крови и дезоксипиридинолина (ДПИД) в моче. Измерение уровня остеокальцина в крови проводили методом электрохемилюминесцентного иммуноанализа. Определение ДПИД в моче проводили методом твердофазного хемилюминисцентного иммуноанализа. Для устранения влияния вариаций мочеобразования результаты определения ДПИД соотносили с концентрацией креатинина в моче и выражали как нмоль/л ДПИД на моль/л креатинина. Креатинин определялся в той же пробе мочи (кинетический метод Яффе). Для оценки функционального состояния нижних мочевых путей использовали квалиметрическую (балльную) оценку терминологически стандартизированных симптомов с учетом возрастных особенностей по Е.Л. Вишневскому. Для оценки влияния изучаемых показателей на течение заболевания дополнительно проводили оценку качества жизни детей при помощи общего опросника PedsQL™. Применялись варианты анкеты для детей 8–12 и 13–18 лет. Данный опросник содержит 23 вопроса, объединенных в следующие шкалы: физическое функционирование – ФФ (8 вопросов); эмоциональное функционирование – ЭФ (5 вопросов); социальное функционирование – СФ (5 вопросов); жизнь в школе – ЖШ (3 или 5 вопросов в зависимости от возраста детей). Ответы на вопросы представлены в виде шкал Ликерта, которые представляют собой горизонтально расположенные варианты ответов на вопрос, каждому из которых соответствует цифра. Ребенок или родитель отвечает на вопрос, выбирая один из предложенных вариантов ответов: «никогда», «почти никогда», «иногда», «часто» и «почти всегда». После проведения шкалирования результаты оценки выражают в баллах от 0 до 100 по каждой из 4 шкал опросника. Чем выше балл по шкале опросника PedsQL™ 4,0, тем лучше показатель качества жизни детей. Кроме того, в процессе шкалирования получены суммарные баллы по психосоциальной компоненте качества жизни, или психосоциальному функционированию (ПСФ) и суммарный балл по всем шкалам опросника – суммарная шкала (СШ).
Результаты представлены в виде средних значений M±m или доли (%) от числа обследованных, для оценки корреляционных взаимосвязей применялся критерий Пирсона: значения 0–0,29 – очень слабая; 0,3–0,699 – средняя; 0,7–1 – сильная корреляционная связь.
Результаты
Из включенных в исследование 25 детей 9 (36%) имели диагноз «нейрогенные расстройства мочеиспускания по гиперрефлекторному типу с частотой мочеиспускания более 9 раз в сутки». Средняя частота мочеиспусканий в этой подгруппе составила 11,3±1,2. В той же подгруппе отмечались императивные позывы на мочеиспускание у 4 (44,4%) и редкие эпизоды ночного недержания мочи у 4 (44,4%). У 16 детей, включенных в исследование, выявлены признаки нейрогенной дисфункции мочевого пузыря по гипорефлекторному типу, основным проявлением которой было снижение частоты мочеиспусканий до 3 и менее раз в сутки (в среднем 3,1±0,55). В целом при оценке выраженности симптомов по унифицированной шкале средний балл в общей группе составил 6,6±4,4, что соответствует легкой степени заболевания.
По данным ультразвукового исследования, у 15 (60,0%) детей выявлены изменения по типу одно- или двусторонней пиелоэктазии, у 2 (8,0%) – признаки повышенной подвижности почек и признаки удвоения чашечно-лоханочной системы у 1 (4,0%) ребенка. При проведении урофлоуметрии вне зависимости от клинических проявлений ведущими оказались изменения по типу снижения эффективного объема мочевого пузыря у 12 (48%) детей от числа обследованных, повышение скорости тока мочи – у 6 (24%) и реже – снижение скорости тока мочи, определенное у 2 (8%) детей.
При оценке уровня витамина D установлено, что низкие значения выявлены у 10 (40,0%) детей общей группы. Сниженный уровень определен еще у 8 (32,0%) пациентов. В целом низкий или сниженный уровень витамина D выявлен у значительного числа: 18 (72,0%) обследованных. Средний уровень витамина D также был снижен и составил 25, 04±9,36 нг/мл.
Повышение уровня ПТГ отмечено у 3 (12,0%) пациентов общей группы. Повышение уровня ПТГ имело место только у детей с низким или пониженным уровнем витамина D. Таким образом, в этой подгруппе доля детей с повышенным уровнем ПТГ составила 16,6%. Наличие умеренной обратной корреляционной связи между уровнем витамина D и ПТГ (r=-0,4) подтверждает, что данное повышение обусловлено феноменом вторичного гиперпаратиреоза на фоне дефицита витамина D.
При оценке уровня кальция крови установлено, что гипокальциемия с уровнем кальция от 2,2 до 2,0 ммоль/л определяется у каждого пятого ребенка. Средней уровень кальция крови составил 2,26±0,18 ммоль/л. Прямой корреляционной связи между уровнем витамина D и кальция в крови не было обнаружено (r=0,11), но была зарегистрирована прямая корреляционная связь между уровнями кальция и ПТГ (r=0,30). Значимых изменений содержания фосфора в крови не выявлено (средний уровень – 1,72±0,23 ммоль/л). Исходя из выявленных изменений ФКО, проведена оценка влияния данных изменений на состояние костной ткани. Повышение уровня остеокальцина в крови, отражающее активность метаболизма костной ткани, выявлено у 3 (12%) из числа обследованных. Выявлена умеренная прямая корреляционная связь между уровнем остеокальцина и ПТГ (r=0,49), а также остекальцина и кальция в крови (r=0,41). Корреляционная связь между уровнем остекальцина и витамина D (r=-0,15) отсутствовала.
При оценке уровня ДПИД мочи значимых изменений выявлено не было. У всех пациентов значение данного показателя оставалось в пределах нормативных значений. Установлена прямая корреляционная связь между уровнем ДПИД и кальция крови (r=0,35), а также обратная с уровнем фосфора крови (r=-0,50) При этом корреляционной связи с уровнем витамина D не выявлено (r=0,22).
В ряде работ обсуждается роль гиперкальциурии в патогенезе нейрогенных расстройств мочеиспускания. Отметим, что в этих исследованиях чаще речь идет о феномене идиопатической гиперкальциурии [1, 7, 8]. При оценке содержания кальция в суточной моче нами установлено, что гиперкальциурия выявлена всего у 1 (4,0%) пациента. Напротив, более частым было снижение суточной экскреции кальция, выявленное у 11 (44%) детей от числа обследованных. Среднее значение суточной экскреции кальция также было значительно снижено и составило 1,26±0,58 ммоль/сут. Не исключено, что данные изменения, возможно, связаны с дефицитом витамина D и обусловлены феноменом сохранения кальция в организме при его дефиците за счет стимулирующего влияния ПТГ на реабсорбцию этого катиона в почечных канальцах.
На последнем этапе проведена оценка возможного влияния выявленных нарушений ФКО на выраженность клинических проявлений и качество жизни пациентов. Как было представлено ранее, при оценке терминологически стандартизированных симптомов средний балл составил 6,6±4,4. Значимой корреляционной связи между выраженностью клинических проявлений и уровнем витамина D не выявлено, но установлена прямая корреляционная связь между его уровнем и таким параметром качества жизни, как физическое функционирование (r=0,31). Что касается ПТГ, то отмечается умеренная отрицательная связь с таким параметром качества жизни, как жизнь в школе и слабая отрицательная корреляционная связь с такими параметрами, как суммарное шкалирование (СШ) (r=-0,25) и суммарное психосоциальное функционирование (r=-0,25). Кроме того, установлена прямая корреляционная связь между выраженностью симптомов и уровнем ДПИД в моче (r=0,65) и остеокальцина крови (r=0,29). Также установлена отрицательная связь между уровнем ДПИТ и остеокальцина с большинством показателей качества жизни (см. таблицу).
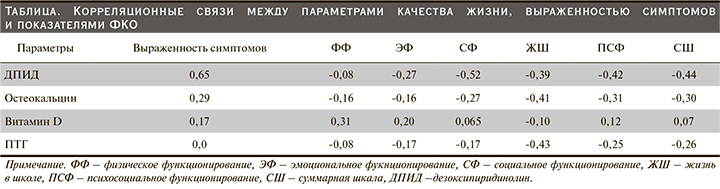
Обсуждение
Оценка влияния дефицита витамина D на развитие отдельных нозологий представляет определенные трудности с учетом его высокой распространенности и множественных метаболических эффектов в организме. В нашем исследовании низкий уровень данного показателя выявлен у 40,0%, низкий и сниженный – у 72% детей. Выявленные изменения других показателей ФКО также напрямую связаны с дефицитом витамина D. Так, умеренная гипокальциемия в нашем исследовании отмечена у каждого пятого ребенка.
К значимым нарушениям ФКО относятся явления вторичного гиперпаратиреоза, выявленные у 12% детей. На вторичный характер данных изменений, обусловленных дефицитом витамина D, указывает наличие обратной корреляционной связи между данными показателями.
Кроме того, к существенным изменениям ФКО следует отнести повышение уровня остеокальцина в крови, выявленное в общей группе у 12% детей. Умеренная прямая корреляционная связь между уровнем остеокальцина и ПТГ (r=0,49) подтверждает роль вторичного гиперпаратиореза в активации процессов ремоделирования костной ткани.
По мнению ряда авторов, одним из важных механизмов, приводящих к развитию нейрогенных расстройств мочеиспускания, может быть феномен гиперкальциурии [1, 7, 8]. Однако в нашем исследовании гиперкальциурия практически не отмечалась. Напротив, у 40% детей выявлена гипокальциурия, по-видимому обусловленная усиленной реабсорбцией кальция в условиях его дефицита.
При оценке влияния выявленных изменений на течение изучаемой нозологии в отличие от ранее цитируемого исследования L. Li et al. [6] не выявлено прямой связи между уровнем витамина D, ПТГ и выраженностью симптомов нейрогенных расстройств мочеиспускания. Выявлены корреляционные связи с другими показателями ФКО: уровнем фосфора крови и в большей степени – с показателями повышенного метаболизма костной и соединительной ткани – уровнем ДПИД мочи (r=0,65) и остеокальцина крови (r=0,29). В клинической практике повышение уровня ДПИД мочи и остеокальцина крови наиболее часто наблюдается при гиперпаратиреозе, обусловленном дефицитом витамина D. Кроме того, к одним из клинических проявлений гиперпаратиреоза относятся дизурические проявления, в т.ч. по типу полиурии, обусловленной влиянием ПТГ на реабсорбцию кальция и фосфора в почках. Усиление дизурических проявлений может быть одним из факторов развития изучаемой нозологии.
На роль вторичного гиперпаратиреоза в развитии изучаемой нозологии указывает наличие корреляционных отрицательных связей между параметрами качества жизни с уровнем ПТГ и показателями повышенного метаболизма костной ткани: уровнем ДПИД мочи и остеокальцина крови, а также прямой корреляционной связи между показателями метаболизма костной ткани с выраженностью симптомов.
Заключение
Таким образом, результаты проведенного исследования указывают на возможную роль нарушения ФКО, обусловленного прежде всего дефицитом витамина D, приводящего к развитию вторичного гиперпаратиреоза в патогенезе нейрогенных расстройств мочеиспускания.



