Введение
Распространенность посттрансплантационного сахарного диабета (ПТСД), по данным современных зарубежных исследований, составляет 4–25% [1, 2] и ассоциируется с высоким риском потери трансплантата, сердечно-сосудистых заболеваний, смертности и инфекционных осложнений [2, 3]. ПТСД является независимым предиктором снижения выживаемости пациентов [4], увеличивает риск смертности от всех причин до 87%, дисфункцию трансплантата и смерть пациента после трансплантации по сравнению с пациентами без диабета [5–7].
Согласно критериям ВОЗ (Всемирная организация здравоохранения) и АDA (American Diabetes Assotiation), диагноз ПТСД выставляется на основании следующих данных: уровень глюкозы плазмы крови натощак ≥7,0 ммоль/л (≥126 мг/дл), случайное определение уровня глюкозы плазмы крови в любое время суток вне зависимости от приема пищи ≥11,1 ммоль/л (≥200 мг/дл) либо ≥11,1 ммоль/л (≥200 мг/дл) через 2 часа после перорального глюкозотолерантного теста (ПГТТ). В 2010 г.
АDA добавила уровень гликозилированного гемоглобина (HbA1c) ≥6,5% как критерий постановки диагноза [8].
Материал и методы
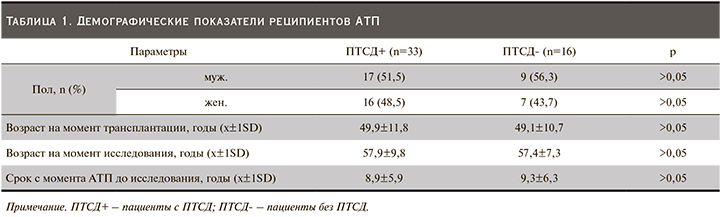
В исследовании приняли участие 49 больных с ранее установленным диагнозом ПТСД. Однако в ходе исследования 33 (67,3%) реципиентам ПАТ диагноз ПТСД был подтвержден согласно критериям АDA (2003), в то время как в отношении 16 (32,7%) реципиентов ПАТ диагноз ПТСД был пересмотрен в связи с нормальными уровнями НbА1с и гликемии натощак и отсутствием сахароснижающей терапии. Это связано с тем, что в раннем посттрансплантационном периоде с целью снижения риска отторжения трансплантата применялись максимальные дозы иммуносупрессивных препаратов, обладающих свойством индуцировать СД. С течением времени по мере уменьшения дозы иммуносупрессантов у части пациентов нормализовались уровни гликемии и HbA1c, что исключило необходимость применения сахароснижающей терапии. Эти пациенты вошли в группу контроля. Демографические показатели представлены в табл. 1.
ПТСД был подтвержден по уровню HbA1c в соответствии с действующими рекомендациями АDA. Все пациенты получали иммуносупрессивные препараты: циклоспорин А (ЦсА) или такролимус (Тас), глюкокортикостероиды (ГКС) в сочетании с микофенолата мофетилом (ММФ) или ингибиторами мишени рапамицина млекопитающих (ингибиторы mTOR). Все пациенты получали антигипертензивную терапию ингибиторами ангиотензинпревращающего фермента (иАПФ) или блокаторами рецепторов ангиотензина II (БРА) и статинами. На момент исследования у всех реципиентов были стабильная функция ПАТ, иммуносупрессивная терапия по стандартной трехкомпонентной схеме в средних поддерживающих дозах, отсутствие острых инфекционных состояний или других факторов риска, способствующих развитию транзиторной гипергликемии в позднем посттрансплантационном периоде.
Для оценки инсулинорезистентности использован индекс IR-HOMA (Homeostasis Model Assessment of Insulin Resistance), рассчитанный по формуле IR-HOMA=инсулин натощак (мкЕД/мл)×глюкоза натощак (ммоль/л)/22,5. Для оценки функциональной активности β-клеток поджелудочной железы применен индекс HOMA-β=20×инсулин натощак (мкЕД/мл)/(глюкоза натощак (ммоль/л)-3,5).
Описательная статистика проведена с помощью программного обеспечения SPSS версии 22.0. Непрерывные переменные представлены как среднее±SD и проанализированы непарным t-тестом. Категориальные переменные выражались как частоты и проценты. Анализировались корреляционные связи r-критерия Пирсона с определением двустороннего критерия значимости. Значение p<0,05 считалось статистически значимым.
Результаты
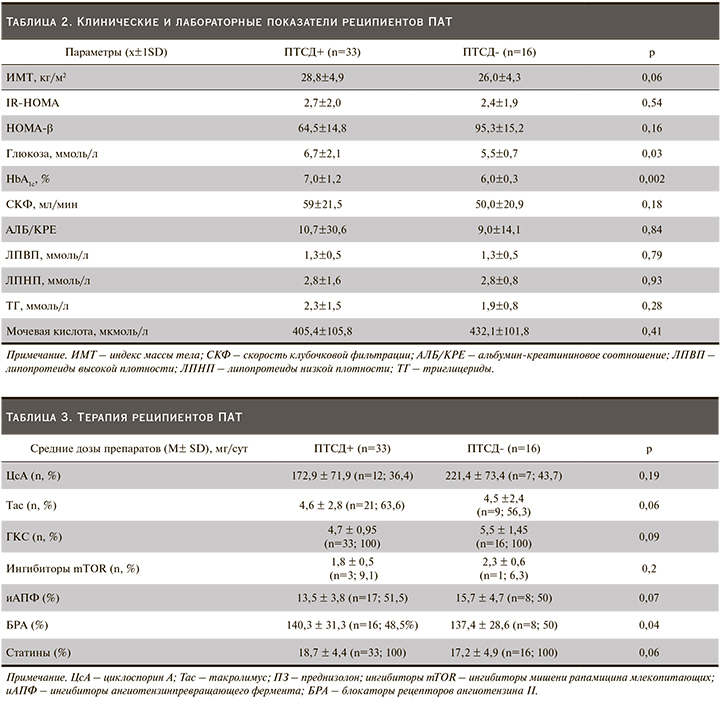
Индекс массы тела (ИМТ), гликемия натощак и уровень НbА1с были достоверно выше в группе с ПТСД по сравнению с пациентами без ПТСД: 28,8±4,9 против 26,0±4,3 кг/м2 (р=0,06); 6,7±2,1 против 5,5±0,7 ммоль/л (р=0,03) и 7,0±1,2 против 6,0±0,3 ммоль/л (р=0,002) соответственно.
Альбумин-креатининовое соотношение IR-HOMA и HOMA-β не имело статистически достоверных различий между группами пациентов с ПТСД и без ПТСД. Факторы риска развития ПТСД представлены в табл. 2.
Согласно нашим данным, Тас, ингибиторы mTOR чаще применялись пациентами с ПТСД (63,6 против 56,3%), однако статистически достоверных различий между группами не было. Всем реципиентам проведена терапия иАПФ или БРА и статинами (табл. 3).
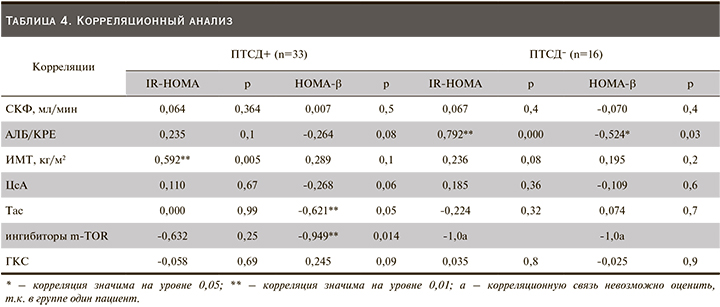
У реципиентов почечного трансплантата с ПТСД в отличие от пациентов без ПТСД выявлена прямая достоверная связь между IR-HOMA и ИМТ (Rs=0,592 р=0,005 при ПТСД; Rs=0,236 р=0,08 у больных без ПТСД). Была выявлена корреляция между АЛБ/КРЕ и IR-HOMA в группе реципиентов без ПТСД (r=0,792; p=0,000 и r= -0,524; p=0,027), но не для реципиентов с ПТСД (r=0,235; p=0,105 и r=-0,264; p=0,083) соответственно. В группе пациентов с ПТСД выявлены отрицательные корреляционные связи между HOMA-β и дозой Тас и ингибитора m-TOR (r=-0,621; p=0,05 и r=-0,949; p=0,014), которых не было выявлено в группе без ПТСД (r=0,074; p=0,7) (табл. 4).
Обсуждение
Kasiske et al., по данным USRDS (US Renal Data System), показали, что старший возраст служит важным фактором риска развития ПТСД, и выявили сильную ассоциацию между возрастом и ПТСД [5, 10].
В нашем исследовании средний возраст реципиентов и средний возраст на момент АТП в группах с ПТСД и без ПТСД достоверно не различались: 57,9±9,8 против 57,4±7,3 года (>0,05) и 49,9±11,8 против 49,1±10,7 года (>0,05) соответственно.
Избыточная масса тела и ожирение, по результатам многих исследований, служат фактором риска ПТСД [11]. Наши данные совпадают с таковыми проведенных ранее исследований [12]. ИМТ у пациентов с ПТСД был выше, чем у таковых без ПТСД (28,8±4,9 против 26,0±4,3 кг/м²; р=0,06).
Иммуносупрессивная терапия – наиболее значимый модифицируемый фактор риска в развитии ПТСД. Среди препаратов, способных индуцировать его развитие, одними из первых были отмечены ГКС. В настоящее время подтверждено, что они стимулируют глюконеогенез, увеличивают инсулинорезистентность, подавляют секрецию инсулина, в высоких дозах индуцируют апоптоз бета-клеток [13]. F.L. Luan et al., проведя ретроспективный анализ базы данных Organ Procurement Transplant Network/ Scientific Registry of Transplant Recipient (OPTN/SRTR), состоявшей более чем из 25 тыс. реципиентов с трансплантацией почки, показали, что при иммуносупрессивной терапии, не включавшей стероиды, наблюдалось значительное снижение вероятности развития ПТСД по сравнению с протоколами иммуносупрессии, включившими стероиды [14]. В нашем исследовании ГКС были включены в программу иммуносупрессии для всех пациентов обеих групп практически с одинаковой дозой (4,7±0,95 у пациентов с ПТСД и 5,5±1,45 без ПТСД, р=0,09), что позволило нам рассматривать бóльший вклад в развитие ПТСД другой группы препаратов – ингибиторов кальциневрина.
Ингибиторы кальциневрина (циклоспорин А, такролимус) служат основой современной иммуносупрессивной терапии после трансплантации почки. Но также хорошо известны диабетогенные эффекты ингибирования кальциневрина, обусловленные активацией апоптоза, торможением роста и пролиферации бета-клеток, снижением мРНК и белка-субстрата инсулинового рецептора, нарушением глюкозоиндуцированной секреции инсулина [15]. Есть данные, показывающие прямой эффект ингибиторов кальциневрина на показатели HOMA-β и IR-HOMA [16]. При этом у такролимуса способность индуцировать развитие СД выражена сильнее, чем у циклоспорина А. В исследовании DIRECT (Diabetes Incidence after Renal Transplantation: Neoral C2 monitoring versus Tacrolimus) продемонстрировано, что заболеваемость ПТСД или нарушенная гликемия натощак (по определению ВОЗ/ADA) через полгода после трансплантации была достоверно ниже при лечении ЦсА по сравнению с Тс (26 против 33,6%; р=0,046) [15]. В нашем исследовании Тас применялся чаще пациентами с ПТСД по сравнению с ЦсА, но без достоверных различий между группами (63,6% vs 56,3%, р=0,06). Есть данные, показывающие прямое действие ингибиторов кальцинейрина на показатели HOMA-β и IR-HOMA [16]. По результатам нашего исследования при оценке влияния доз Тас и ЦсА на уровень HOMA-β достоверно выявлены отрицательные корреляционные связи между HOMA-β, дозой Тас и ингибитора m-TOR (r=-0,621; p=0,05 и r=-0,949; p=0,014), которых не было выявлено в группе без ПТСД (r=0,074; p=0,7). Вместе с тем у пациентов с ПТСД после АТП было выявлено увеличение резистентности к инсулину и отсутствие компенсаторного увеличения секреции инсулина [16, 17]. Согласно этим данным, IR-HOMA является предиктором ПТСД, а не HOMA-β [16]. Кроме этого IR-HOMA связан с маркерами хронической болезни почек, в частности с АЛБ/КРЕ [18].
По нашим данным, отсутствие корреляции между IR-HOMA, HOMA-β и АЛБ/КРЕ в группе с ПТСД может быть связано с проводимой антидиабетической терапией препаратами, уменьшающими инсулинорезистентность. Усиление корреляции между IR-HOMA, HOMA-β и АЛБ/КРЕ у пациентов без ПТСД и отсутствие достоверных различий IR-HOMA между двумя группами могут это подтверждать.
Данные корреляции требуют углубленного изучения по влиянию инсулинорезистентности на течение ХБП у реципиентов ПАТ.



