Актуальность проблемы хронической болезни почек (ХБП)
Согласно результатам крупных популяционных исследований (HDFP, HOPE, Framingham Heart study, NHANES III, Hoorn), стремительный рост частоты сердечно-сосудистых заболеваний и их катастрофических исходов в популяции пациентов, страдающих ожирением и/или сахарным диабетом 2 типа, связан с развитием и прогрессированием ХБП [1—3]. Это сделало необходимыми детальное изучение причин ХБП и поиск новых подходов к ее лечению.
Внимание медицинской и научной общественности (ВОЗ, Международная федерация диабета) сосредоточено на метаболическом синдроме (МС), объединяющем абдоминальное ожирение и сахарный диабет 2 типа (СД2) с многочисленными факторами риска, общими для поражения сердца и почек.
Исследования последних лет свидетельствуют о доминирующем значении МС в повсеместном повышении заболеваемости ХБП и тесной ассоциации патогенетической основы этого синдрома — инсулинорезистентности (ИР) и компенсаторной гиперинсулинемии (ГИ) — со скоростью клубочковой фильтрации (СКФ) уже на самых ранних этапах развития нефропатии [4—7]. Было показано, что распространенность ХБП прямо связана с количеством диагностических критериев МС, и высказано предположение, что терапия, направленная на снижение ИР, может замедлить прогрессирование ХБП [8, 9].
Возможные пути патогенеза ХБП в условиях ИР/ГИ
Накапливаются данные, свидетельствующие, что вовлечение почек в патологический процесс при наличии ИР с развитием ХБП происходит независимо от наличия СД и/или артериальной гипертензии. В экспериментальных исследованиях была доказана непосредственная роль ИР в развитии и прогрессировании ХБП [10—11]. Выделяют несколько возможных механизмов почечного поражения, обусловленных ИР и компенсаторной ГИ: во-первых, активация ренин-ангиотензиновой системы с сопутствующим функциональным гиперальдостеронизмом и внутриклубочковой гипертензией; во-вторых, усиление оксидативного стресса, усугубляющего перекисное окисление гликолипопротеидов и липидов; в-третьих, митогенный эффект избытка инсулина, способствующий пролиферации мезангиальных клеток и гиперпродукции экстрацеллюлярного матриксного протеина за счет увеличения биологической активности факторов роста (эндотелин-1, трансформирующий фактор роста в, инсулиноподобный фактор роста I). Кроме того, ИР нарушает функционирование (ослабляет регуляцию) рецепторов, активирующих пролиферацию пероксисом, что приводит к формированию пенистых клеток, почечной липотоксичности и эндотелиальной дисфункции [12].
Ассоциация ИР и СКФ на разных стадиях ХБП
В настоящее время самым ранним и обратимым признаком развития ХБП у пациентов с МС считается ГФ. М. Tomaszewski и соавт., обследовав более 1,5 тыс. молодых мужчин (средний возраст — 18,4 года), показали, что высокий метаболический риск (сочетание не менее трех признаков МС) ассоциировался с 7-кратным повышением СКФ [5]. Мы подтвердили эти данные, продемонстрировав преобладание ГФ у молодых мужчин с МС, андрогенным дефицитом и ее связь с основными компонентами МС (рис. 1).
Рисунок 1. Факторы, связанные с гиперфильтрацией.
Непосредственное участие ГИ в развитии ГФ показано в многоцентровом исследовании, включившем 200 пациентов без СД, у которых анализировали уровень инсулина и клиренс креатинина через 3 и 12 месяцев после трансплантации почки. Большинство пациентов получали ингибиторы кальцинейрина. В ходе исследования были выделены группы пациентов с персистирующей нормоинсулинемией и ГИ. У больных ГИ увеличение клиренса креатинина было выше по сравнению с группой нормоинсулинемии (12,00 против 0,03 %). Проведенный анализ показал, что ГИ является независимым фактором риска увеличения клиренса креатинина или ГФ [13].
Поскольку в будущем ГФ может вызывать снижение функции почек и развитие ХБП, ИР/ГИ можно рассматривать как новый фактор риска почечной болезни в общей популяции, а ГФ — как раннее следствие ГИ и потенциальную мишень терапевтического действия.
Данные клинических исследований подтверждают роль ИР не только в формировании ГФ, но и в прогрессировании ХБП. K. Kaartinen и соавт. в исследовании длительностью более 6 лет, включившем 174 пациента с IgA-нефропатией (1—3-й стадий ХБП), показали, что уровень ИР является независимым предиктором прогрессирования поражения почек: в группе стабильного течения IgA-нефропатии (n = 95) среднее значение индекса HOMA-IR составило 2,79, а в группе прогрессирующего течения (n = 23) — 4,43 (p = 0,005). По мнению авторов этой работы, ИР можно рассматривать как фактор прогрессирования любой протеинурической нефропатии [14].
В нашей работе была подтверждена тесная ассоциация между ИР и ХБП и показана прямая связь между СКФ и индексом ИР HOMA (Homeostasis Model Assessment — математическая модель гомеостаза для расчета ИР) на 1-й и 2-й стадиях ХБП (г = 0,4; p = 0,04) и обратная связь на 3-й и 4-й стадиях ХБП (г = - 0,7; p = 0,02; рис. 2, 3).
Рисунок 2. Корреляция СКФ и НОМА на 1-2 стадии ХБП, ИМТ > 25 кг/м2.
Рисунок 3.Корреляция СКФ и НОМА на 3-4 стадии ХБП, ИМТ > 25 кг/м2.
Таким образом, проведенные исследования свидетельствуют об ассоциации между ИР и всеми стадиями ХБП. По-видимому, ИР способствует формированию ГФ на начальных стадиях ХБП и усугубляет прогрессирование нефросклероза на стадии хронической почечной недостаточности.
Подходы к терапии ХБП у пациентов с МС
Основываясь на результатах ряда опубликованных исследований, мы изучали потенциальное положительное действие терапии, направленной на снижение ИР, в отношении функции почек.
АНДРОГЕННЫЙ ДЕФИЦИТ И ЕГО КОРРЕКЦИЯ
По данным крупных международных исследований MMAS (Massachusetts Male Aging Study) [15], Telecom Study [16], Tromso Study [17], EPIC-Noifolk (European Prospective Investigation Into Cancer in Norfolk) [18] и MRFIT (Multiple Risk Factor Intervention Trial) [19], андрогенный дефицит является одной из причин ИР и фактором риска МС. Кроме того, было показано, что коррекция андрогенного дефицита препаратами тестостерона у мужчин с МС снижает ИР и замедляет прогрессирование атеросклероза с его общими для поражения почек и сердца факторами риска [20-23].
Учтя это, мы совместно с сотрудниками Эндокринологического центра исследовали влияние терапии тестостероном (Небидо, Bayer Shering Pharma AG, Германия) на факторы риска ХБП (ИР, висцеральное ожирение, артериальная гипертензия, дислипидемия, гиперлептинемия) и на признаки почечного поражения (гиперфильтрация, альбуминурия) у мужчин с МС и андрогенным дефицитом в возрасте от 35 до 69 лет (средний возраст - 53,6 ± года, n = 76).
Пациенты были рандомизированы в две группы: основную, получавшую препарат тестостерона, и контрольную, получавшую плацебо. На момент включения в исследование группы были сопоставимыми по проводимой терапии и основным оцениваемым показателям (табл. 1).
Таблица 1. Клиническая характеристика основной и контрольной групп.
Примечание. САД - систолическое артериальное давление, ДАД - диастолическое артериальное давление, ЛПНП - липопротеиды низкой плотности, ЛПВП -липопротеиды высокой плотности.
Уровень ЛПВП был достоверно выше в контрольной группе (без терапии тестостероном), поэтому показатель ЛПВП был включен в исследование.
Через 30 недель после проведенной терапии тестостероном (3-й инъекции Небидо) в основной группе отмечены следующие положительные результаты: объем талии уменьшился на 3 % (р = 0,03), ДАД снизилось на 6 % (р = 0,04), уровень ЛПВП возрос на 20 % (р = 0,04), а лептина уменьшился на 39 % (р = 0,02). Кроме того, имела место тенденция к снижению уровней триглицеридов (-22 %; р = 0,06) и САД (-5 %; р = 0,09). В контрольной группе было выявлено уменьшение объема талии на 2,8 % (р = 0,04) и уровня лептина на 32 % (р = 0,03). Концентрация тестостерона возросла в основной группе почти в 2 раза (до 14,3 ± 6,2 нмоль/л).
В основной группе было также отмечено снижение альбуминурии (-15 %; р = 0,02) и ГФ, определенное по уровню СКФ (-8 %; р = 0,01). Распространенность ГФ среди пациентов в основной группе уменьшилась с 33 до 26 %, а в контрольной выросла с 30 до 44 % (р = 0,04). При этом ИР, определяемая по индексу НОМА, снизилась в основной группе на 28 % (р = 0,03) и выросла в контрольной группе на 38 % (р = 0,02).
Таким образом, терапия препаратом тестостерона при МС приводит к коррекции ИР, уменьшению распространенности ГФ, выраженности альбуминурии и ГФ, снижая риск развития ХБП.
КОМБИНИРОВАННАЯ ТЕРАПИЯ (СУЛОДЕКСИД И МЕТФОРМИН)
Национальный институт здоровья и клинических исследований (National Institute of Health and Clinical Excellence), Международная федерация диабета, Американская диабетическая ассоциация рекомендуют метформин в качестве терапии первой линии для снижения ИР [24]. Последние исследования расширили границы его применения для пациентов с ХБП [25]. В 2009 г. появились международные рекомендации (National Evidence Based Guidelines for Blood Glucose Control in type 2 diabetes), согласно которым метформин может применяться пациентами с 3-й стадией ХБП, тогда как 4-я и 5-я стадии ХБП являются абсолютным противопоказанием к его назначению [26].
Учтя эти данные, мы провели исследование по изучению возможности применения метформина пациентами со сниженной функцией почек (2-я и 3-я стадии ХБП) и МС. Оценивалось действие метформина и сулодексида (Весел Дуэ Ф, Alfa Wassermann (Италия)) на течение и факторы риска ХБП. Комбинация метформин + сулодексид была выбрана из-за прямого действия метформина на ИР и нефропротективного действия сулодексида за счет нормализации функции сосудистого эндотелия и усиления синтеза компонентов базальной мембраны клубочка. На момент включения в исследование группы были сопоставимыми по основным оцениваемым показателям и проводимой терапии (табл. 2).
Таблица 2. Клинико-лабораторные данные пациентов, получавших метформин + сулодексин.
Через 25 недель лечения в группе пациентов, получавших комбинированную терапию метформином и сулодексидом, отмечены следующие положительные результаты: объем талии и ИМТ уменьшились на 4,4 (p = 0,02) и 2,8 % (p = 0,003) соответственно, уровень ЛПВП возрос на 32,3 % (p = 0,016), а показатель НОМА снизился на 43,8 % (p = 0,04). При этом уменьшение индекса ИР сочеталось с тенденцией к увеличению СКФ (на 8,8 %; p = 0,14). В контрольной группе и группе пациентов, получавших сулодексид, указанная динамика не была достоверной. Однако обращает на себя внимание выявленная тенденция к снижению показателя НОМА (-41,4 %; p = 0,4) и увеличению СКФ (+5,6 %; p = 0,09) при применении сулодексида (рис. 4).
Рисунок 4. Динамика ДСКФ и ДНОМА после 25 недель терапии.
Таким образом, по данным нашего предварительного исследования, комбинированная терапия метформином и сулодексидом снижала ХБП 2-й и 3-й стадий у больных ИР и выраженность связанных с ней факторов риска ХБП, ассоциируясь с тенденцией к увеличению СКФ (улучшению функции почек).
Как известно, ИР и ГИ — независимые факторы, связанные с ГФ, которая, по современным представлениям, является самым ранним признаком развития нефропатии и индуцирует дальнейшее прогрессирование ХБП [2, 13, 27]. Вместе с тем состояние ГФ может быть обратимым и лечение, начатое на этом этапе почечной болезни и направленное на снижение ИР, может стабилизировать функцию почек, тормозить развитие ХБП.
И хотя ГИ направлена на преодоление ИР, она при этом вызывает структурные и функциональные нарушения в ряде внутренних органов, включая почки, на прегликемическом этапе МС, связанные с избыточным действием инсулина и потреблением глюкозы, активацией ренин-ангиотензиновой системы и эндотелиальной дисфункцией, запуском липогенеза/липотоксичности, синтезом адипоцитокинов [28]. В совокупности это ведет к срыву адаптационных механизмов в почках, истощению почечного функционального резерва, относительной и абсолютной олигонефронии и прогрессирующему падению СКФ [29—31].
Динамика почечной болезни была рассмотрена в нашем исследовании среди разных возрастных групп мужчин, страдающих МС. В старшей возрастной группы по сравнению с младшей уменьшилось число больных ГФ и возросло число пациентов со сниженной СКФ (табл. 4).
Таблица 4. Распределение мужчин различных возрастных групп с МС в зависимости от СКФ.
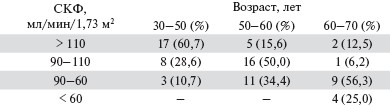
Таким образом, преобладание ГФ в молодой возрастной группе предшествует развитию ХБП в старшей возрастной группе и может отражать динамику почечного поражения, вызванного ИР и компенсаторной ГИ. Результаты наших исследований демонстрируют прямую ассоциацию ИР и СКФ на стадии ГФ и обратную — на стадиях снижения функции почек. Это и выявленная нами тенденция к снижению ИР и увеличению СКФ в группе, получавшей сулодексид, позволяет предположить, что почка является не только органом-мишенью МС, но и эффекторным органом, вносящим вклад в усиление ИР на продвинутых стадиях ХБП.
Таким образом, терапия, направленная на снижение ИР, может прерывать/ослаблять тесную ассоциацию между ХБП и МС, оказывать положительное влияние на функцию почек в целом. В будущем необходимо проведение крупных популяционных исследований для оценки возможного нефропротективного эффекта препаратов, снижающих ИР.



