Введение
Результаты крупных эпидемиологических исследований четко показали, что распространенность хронической болезни почек (ХБП) в общей популяции велика и сопоставима с таковой для сердечно-сосудистых заболеваний, сахарного диабета (СД) и хронической обструктивной болезни легких (ХОБЛ) [1].
В отсутствие сердечно-сосудистых заболеваний и СД частота ХБП составляет 6,8 %, при наличии артериальной гипертонии (АГ) этот показатель возрастает до 15,2 %, при сочетании СД и АГ достигает 43 % [2].
Среди наиболее эпидемиологически значимых вариантов ХБП особое место занимает поражение почек при АГ, встречающееся, по некоторым данным, более чем у 35 % пациентов [3]; с точки зрения предупреждения его прогрессирования особое значение имеет эффективная фармакологическая блокада ренинг-ангиотензин-альдостероновой системы (РААС). Алискирен (Расилез, Novartis AG) в настоящее время является единственным используемым в реальной клинической практике селективным прямым ингибитором ренина. Блокируя активный центр молекулы ренина, алискирен препятствует трансформации ангиотензиногена в ангиотензин I (АТI). Молекула алискирена устойчива, имеет непептидную структуру и высокое сродство к человеческому ренину. Алискирен реализует свое действие на начальном этапе активации РААС, уменьшая плазменную активность ренина и предотвращая образование последующих ее компонентов. В отличие от ингибиторов АПФ (иАПФ) и блокаторов рецепторов ангиотензина II при применении прямого ингибитора ренина не наблюдается компенсаторного увеличения плазменной концентрации ренина. [4].
Нефропротективное действие алискирена продемонстрировано в крупных контролируемых клинических исследованиях. Так, в исследовании AVOID [5] применение алискирена позволило добиться существенного уменьшения альбуминурии у пациентов с диабетической нефропатией.
Установлено, что у больных ХБП наблюдаются расстройство системы гемостаза в виде дезадаптивной активации компонентов системы гемостаза – как эндотелиальных, так и тромбоцитарных, в формировании которой определенную роль могут играть компоненты РААС [6]. Вместе с тем клинические исследования, посвященные оценке влияния препаратов, блокирующих РААС, в частности прямых ингибиторов ренина, на показатели тромбоцитарного гемостаза при ХБП практически отсутствуют.
Материал и методы
Работа выполнена на базе нефрологического отделения ГБУЗ ОКБ № 1 Тюмени и терапевтического отделения железнодорожной больницы на станции Тюмень (НУЗ ОАО РЖД). В исследование включены 50 больных ХБП с АГ (23 мужчины и 27 женщин, средний возраст – 43,5±3,2 года). Скорость клубочковой фильтрации (СКФ) рассчитана по формуле MDRD.
ХБП диагностирована при наличии повреждения почек, определенного как структурные или функциональные нарушения (по данным лабораторных и/или инструментальных методов исследования) с наличием или без снижения СКФ либо снижения СКФ менее 60 мл/мин/1,73 м2 в течение 3 месяцев и более (K/DOQI, 2002) с разделением третьей стадии на 3а и 3б (K/DOQI, 2009) [7].
Нозологическая структура ХБП была представлена хроническим пиелонефритом (40 [80,0 %] больных), мочекаменной болезнью (6 [12 %] больных), хроническим гломерулонефритом (4 [8 %] больных). У 10 пациентов констатирована ХБП 1-й стадии; у 22 – ХБП 2-й; у 10 – ХБП – 3а; у 6 – ХБП – 3б; у 2 – ХБП 4-й стадии.
Все пациенты в течение 8 недель получали алискирен (Расилез, Novartis AG) в дозе 150 – 300 мг/сут. Измерение АД проведено в соответствии с общепринятыми рекомендациями с помощью аппарата Microlife BP AG-10 (Швейцария). Офисное АД определяли как среднее из результатов 3 измерений, полученных в положении сидя после 5-минутного отдыха. Эхокардиография (ЭхоКГ) проведена на аппарате (Phillips, США): по общепринятой методике [8] определены конечный диастолический и систолический размеры левого желудочка (ЛЖ), толщина межжелудочковой перегородки, толщина задней стенки ЛЖ; определены конечный диастолический (КДО) и конечный систолический (КСО) объемы, фракция выброса (ФВ) и индекс массы миокарда левого желудочка (ИММЛЖ).
Тромбоциты выделены из цельной крови методом центрифугирования в градиенте плотности. В мембранах тромбоцитов стандартизованными методами определены содержание диеновых конъюгатов (ДК) [9], малонового диальдегида МДА [10], альфа-токоферола [11], общего холестерина (ОХС) по методу Златкиса–Зака и суммарных фосфолипидов (СФЛ) по реакции с малахитовым зеленым на неорганический фосфор [12].
Агрегация тромбоцитов исследована с помощью стандартного турбидиметрического метода с использованием анализатора BIOLA 230-2 (НПФ “Биола”, Россия) по кривой светопропускания и кривой среднего размера агрегатов. Определена спонтанная агрегация тромбоцитов.
Исследования проведены до начала лечения и через 8 недель приема алискирена. В качестве контрольной группы обследованы 30 нормотензивных лиц, сопоставимых по полу и возрасту.
Статистическая обработка полученных результатов проведена с использованием пакета статистических программ STATISTICA 6.0. Для создания базы данных использован редактор электронных таблиц Microsoft Excel 10.0. Тестирование параметров распределения проведено при помощи критериев Колмогорова–Смирнова. Для сравнения величин при нормальном распределении использован критерий Стьюдента, а при ненормальном – U-критерий Манна–Уитни. Для качественных признаков различия установлены методом Х 2. Для непрерывных переменных результаты представлены как М +-m, где М – среднее арифметическое, m – стандартное отклонение среднего арифметического. Достоверными считали различия при р < 0,05.
Результаты и обсуждение
Спустя 8 недель лечения алискиреном отмечено снижение систолического АД (САД) с 168,34 ± 3,50 до 141,0 ± 3,6 мм рт. ст. (р < 0,01) и диастолического АД (ДАД) с 105,56 ± 4,85 до 82,45 ± 4,00 мм рт. ст. ( р < 0,01). Целевой уровень АД (< 130/80 мм рт. ст.) был достигнут 32 (64 %) больными.
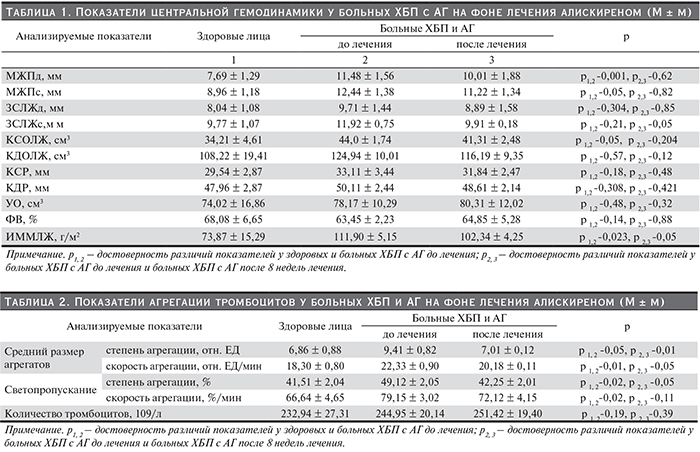
Результаты исследования центральной гемодинамики у больных, включенных в исследование, представлены в табл. 1. Как видно из табл.1, по сравнению с контрольной группой здоровых лиц у больных АГ и ХБП исходно были констатированы достоверные различия в величинах толщины межжелудочковой перегородки в систолу и диастолу, конечного систолического объема левого желудочка, а также ИММЛЖ.
Спустя 8 недель приема алискирена показатели центральной гемодинамики у наблюдаемых больных существенно не изменились, однако была отмечена тенденция к уменьшению толщины межжелудочковой перегородки, задней стенки ЛЖ, конечного систолического и диастолического объема ЛЖ и конечного систолического и диастолического размера ЛЖ по сравнению с показателями до лечения. У больных АГ и ХБП спустя 8 недель лечения алискиреном существенно уменьшился ИММЛЖ.
Результаты исследования агрегации тромбоцитов у больных ХБП с АГ представлены в табл. 2: у больных ХБП с АГ по сравнению со здоровыми до лечения было отмечено увеличение степени агрегации и скорости агрегации тромбоцитов по среднему размеру агрегатов и светопропусканию. Через 8 недель приема алискирена зарегистрировано статистически достоверное уменьшение степени агрегации и скорости агрегации тромбоцитов по среднему размеру агрегатов и степени агрегации тромбоцитов по светопропусканию по сравнению с показателями до лечения.
Уровень тромбоцитов у наблюдаемых больных по сравнению со здоровыми лицами и в динамике лечения существенно не менялся.
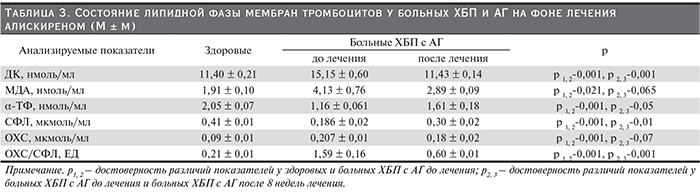
Исходно (табл. 3) у больных ХБП с АГ была отмечена активация процессов пероксидации липидов с накоплением в мембранах тромбоцитов первичных (ДК) и промежуточных (МДА) продуктов пероксидации липидов и уменьшение уровня альфа-токоферола на фоне существенного уменьшения содержания суммарных фосфолипидов и увеличения более чем в 2 раза содержания общего холестерина. Коэффициент ОХС/СФЛ также оказался значительно увеличенным. После лечения алискиреном наблюдалось уменьшение активности начальных этапов пероксидации липидов, в пользу чего свидетельствовало статистически достоверное снижение уровня ДК и тенденция к уменьшению уровня МДА на фоне увеличения уровня альфа-токоферола и содержания суммарных фосфолипидов Уровень холестерина в мембранах тромбоцитов у больных несколько уменьшился, но различия оказались статистически недостоверными. Коэффициент ОХЛ/СФЛ при этом уменьшился более чем в 2,5 раза.
Результаты настоящего исследования свидетельствуют о том, что применение алискирена в режиме монотерапии больных ХБП с АГ позволяет достигать целевого АД более чем 60 % пациентов, что сопоставимо с опытом применения данной категорией больных ингибиторов АПФ и БРА [13]. Кроме того, алискирен обусловливает регресс гипертрофии ЛЖ у пациентов с ХБП и АГ, что подтверждается отмеченным нами уменьшением ИММЛЖ.
У пациентов, включенных в исследование, после завершения лечения алискиреном значительно уменьшилась спонтанная агрегационная активность тромбоцитов, что может свидетельствовать о положительном влиянии алискирена на показатели гемостаза. Изменение функциональной активности тромбоцитов у больных ХБП с АГ под действием алискирена, по-видимому, обусловлено частичным восстановлением липидной структуры мембран тромбоцитов, уменьшением активности процессов липопероксидации и улучшением эластических свойств мембран тромбоцитов за счет уменьшения коэффициента холестерин/фосфолипиды [14]. Эти данные могут стать основанием обсуждения принципиально новой составляющей органопротективного действия алискирена у пациентов с АГ и ХБП.

