Введение
Слизистая оболочка желудочно-кишечного тракта является одним из важнейших тканевых барьеров в организме человека, отграничивающих его внутреннюю среду от внешнего мира. Главным компонентом этого барьера считается кишечный эпителий, который расположен на границе между просветом кишечника и собственной пластинкой, представляет собой монослой, состоящий из нескольких типов клеток (каемчатые энтероциты, бокаловидные, энтероэндокринные, микроскладчатые клетки и клетки Панета). Кишечный эпителий постоянно и быстро обновляется посредством скоординированных процессов клеточной пролиферации, дифференцировки, миграции и экструзии [1]. Эпителиальные клетки способны идентифицировать люминальные бактерии и могут нейтрализовать некоторые бактериальные токсины. Взаимодействие между кишечным эпителием и кишечной микробиотой осуществляется через рецепторы распознавания образов (PRR), такие как toll-подобные рецепторы (TLR) и NOD-подобные рецепторы (NLR), которые активируют врожденный иммунный ответ [2]. Кроме того, немаловажная роль в сохранении иммунного гомеостаза кишечника принадлежит антимикробным пептидам (иммуноглобулин А – IgA, дефенсины, лизоцим, белки Reg3 и др.), обеспечивающим защиту против широкого спектра микроорганизмов, а также различным иммунокомпетентным клеткам, необходимым для активации антиген-специфических реакций и поддержания толерантности к комменсальным бактериям и пищевым антигенам [3].
Таким образом, нормально функционирующий кишечный барьер позволяет всасываться из просвета кишечника необходимым веществам, при этом блокируя попадание в организм многочисленных патогенов. В свою очередь, нарушение герметичности кишечного барьера, сопровождающееся повышением его проницаемости, наряду с кишечным дисбактериозом рассматривается в настоящее время в качестве важного механизма патогенеза многих заболеваний, включая острое повреждение и хроническую болезнь почек (ХБП) [4, 5]. Это диктует необходимость располагать доступными в повседневной клинической практике методами оценки целостности кишечного эпителия.
Одним из диагностических подходов, применяемых для этих целей, является обнаружение в биологических средах (кровь, моча, кал) повышенного уровня протеинов, являющихся компонентами кишечного барьера, в частности кишечной фракции белка, связывающего жирные кислоты I-FABP (Intestinal Fatty Acid-Binding Protein) [6]. В многочисленных работах подчеркивается, что I-FABP обладает высокой диагностической и прогностической значимостью при острой мезентериальной ишемии [7], риск развития которой у пациентов с терминальной стадией почечной недостаточностью (ТПН) значительно превышает общепопуляционный [8], а показатели смертности могут достигать 60% [9]. Между тем необходимо учитывать, что снижение скорости клубочковой фильтрации (СКФ) потенциально может влиять на содержание I-FABP у пациентов с нарушением функции почек [10].
Исходя из этого, целью настоящего исследования было изучить содержание сывороточного I-FABP у больных на разных стадиях ХБП, в т.ч. получающих лечение гемодиализом.
Материал и методы
В исследование включены 3 группы пациентов: 1) 20 относительно здоровых лиц с СКФ>60 мл/мин/1,73 м2; 2) 30 пациентов с ХБП С3а–5 (СКФ<60 мл/мин/1,73 м2); 3) 38 пациентов с ТПН, получающих лечение гемодиализом. Группы были сопоставимы по полу, возрасту, индексу массы тела (ИМТ), статусу курения и этиологической структуре ХБП.
Критерии исключения: острые воспалительные и некомпенсированные хронические заболевания; энтеропатии (болезнь Крона, неспецифический язвенный колит, целиакия и др.); острый мезентериальный тромбоз, желудочно-кишечные кровотечения в предшествовавшие исследованию 12 месяцев.
У всех участников исследования утром натощак до приема лекарственных препаратов отбирались образцы венозной крови для последующего лабораторного анализа в сертифицированной лаборатории. Расчет СКФ проводили по формуле CKD-EPI на основе сывороточного креатинина. Концентрацию I-FABP в сыворотке крови определяли методом иммуноферментного анализа по инструкции коммерческого набора (Cloud-Clone Corp., США) на планшетном анализаторе Victor X5 (PerkinElmer. Inc., США).
Статистическая обработка данных проводилась с помощью программы SPSS Statistics 26. Рисунки выполнены в программе GraphPad Prism 8.0. Ввиду небольшого числа наблюдений численные величины всех параметров представлены в виде медианы (Ме) и интерквартильного размаха (Q25–Q75). Качественные признаки представлены как абсолютное количество и процент от общего числа. Сравнение групп по количественным показателям выполнялось с помощью критериев Манна–Уитни и Краскела–Уоллиса. Частотные характеристики качественных показателей сравнивали у обследованных лиц из различных групп с помощью метода χ2-критерия Пирсона. Направление и силу связи между двумя количественными показателями оценивали с помощью коэффициента ранговой корреляции Спирмена. Влияние СКФ на содержание I-FABP в крови у больных на додиализных стадиях ХБП дополнительно оценивали с помощью линейной регрессии. Значение р<0,05 считалось статистически значимым во всех тестах.
Проведение исследования одобрено локальным этическим комитетом ФГБВОУ ВО «Военно-медицинская академия им. С.М. Кирова» (протокол № 262 от 26.04.2022).
Результаты
Основные демографические и лабораторные характеристики пациентов, стратифицированных по степени нарушения функции почек, приведены в таблице.
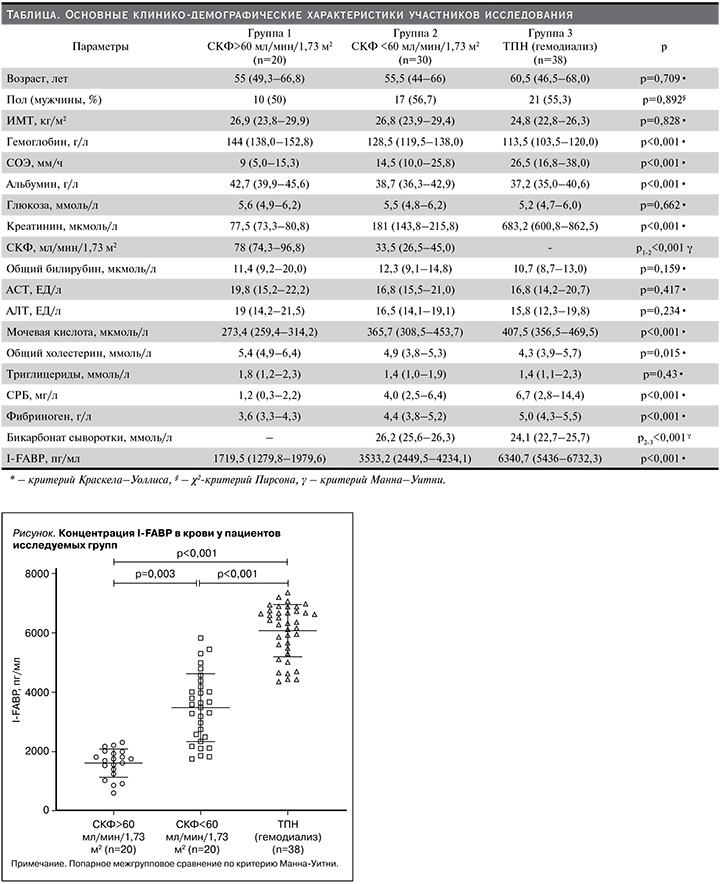
Их динамика характеризовалась типичным для прогрессирования ХБП снижением СКФ, уровней гемоглобина, альбумина, бикарбоната, а также повышением уровней мочевой кислоты и воспалительных биомаркеров (СОЭ, С-реактивный белок – СРБ, фибриноген). Медианные уровни I-FABP также значимо увеличивались параллельно с усилением тяжести почечной недостаточности и достигали максимальных значений у больных на диализе (см. рисунок).
В группе пациентов с СКФ>60 мл/мин/1,73 м2 I-FABP значимо коррелировал с возрастом (r=0,584; р=0,007), креатинином (r=0,502; р=0,024), СРБ (r=0,48; р=0,032) и СКФ (r=-0,850; р<0,001). В группе пациентов с СКФ<60 мл/мин/1,73 м2 также были обнаружены значимые корреляции уровня I-FABP с возрастом (r=0,492; р=0,006), креатинином (r=0,824; р<0,001), СРБ (r=0,842; р<0,001), СКФ (r=-0,99; р<0,001), а кроме того, с гемоглобином (r=-0,642; р<0,001) и фибриногеном (r=0,378; р=0,04). В группе гемодиализных больных убедительных ассоциаций между содержанием I-FABP в крови и другими исследованными показателями выявлено не было.
С учетом наличия значимой обратной сильной корреляции между уровнем I-FABP и СКФ у больных на додиализных стадиях ХБП эти переменные были оценены на предмет ассоциаций с помощью однофакторного линейного регрессионного анализа. Поскольку распределение показателей отличалось от нормального, для статистической обработки использовались логарифмически преобразованные значения. Объединив данные групп 1 и 2, было установлено, что концентрация I-FABP увеличивалась пропорционально снижению СКФ. Полученная регрессионная модель характеризовалась коэффициентом корреляции R=0,946, а уровень ее значимости составил p<0,001. СКФ определяла 89,5% дисперсии I-FABP.
Обсуждение
I-FABP представляет собой низкомолекулярный (14–15 кДа) цитозольный водорастворимый белок, специфически экспрессируемый энтероцитами от подвздошной до толстой кишки, который играет ключевую роль в клеточном поглощении и метаболизме жирных кислот [11]. I-FABP быстро высвобождается в системный кровоток при повреждении энтероцитов и считается информативным биомаркером острой ишемии кишечника [12]. Определение концентрации I-FABP также предлагается использовать для диагностики синдрома повышенной эпителиальной проницаемости кишечника, сопровождающего широкий спектр хронических кишечных и внекишечных заболеваний, в т.ч. ХБП [13]. Однако влияние функции почек на кинетику I-FABP к настоящему времени до конца не изучено. Принимая во внимание тот факт, что I-FABP, как и другие представители семейства протеинов FABP, в основном экскретируются почками (период полувыведения приблизительно 11 минут) [14], у пациентов со сниженной СКФ стоит ожидать повышения его концентрации в крови.
В ряде работ повышенный уровень I-FABP выступал в качестве предиктора осложнений и неблагоприятных исходов у пациентов с септическим шоком, политравмой и остановкой сердца. Между тем они не учитывали влияния функции почек на содержание I-FABP в крови, несмотря на высокую частоту острого повреждения почек, возникающего при этих критических состояниях [15–17]. По данным M. Sekino и соавт., содержание I-FABP в крови при поступлении в отделение интенсивной терапии также было достоверно связано с внутрибольничной смертностью после кардиохирургических операций у пациентов, находившихся на гемодиализе [18]. В то же время в исследовании T. Kitai и соавт., в котором сообщалось о связи более высокой концентрации I-FABP с повышенной частотой неблагоприятных клинических событий у пациентов с острой декомпенсированной сердечной недостаточностью, влияние I-FABP на исход было нейтральным после корректировки на сопутствующие факторы, включая СКФ [19]. По всей видимости, именно по этой причине из большинства исследований, в которых изучалась диагностическая и прогностическая значимость I-FABP, исключали пациентов с ХБП, чтобы избежать погрешностей в выводах, связанных с нарушением функции почек.
Результаты проведенного нами исследования показали, что уровень I-FABP в крови как у гемодиализных больных, так и у лиц с умеренно выраженной ХБП был значительно выше по сравнению с лицами с СКФ>60 мл/мин/1,73 м2. Кроме того, у больных ТПН содержание I-FABP было достоверно выше, чем у пациентов с СКФ<60 мл/мин/1,73 м2. Влияние функции почек на сывороточный уровень I-FABP также подтверждала сильная отрицательная корреляция с СКФ. Схожие данные были получены в исследовании K. Okada и соавт., в котором уровни I-FABP у пациентов с ХБП (СКФ=45,9 мл/мин/1,73 м2) и ТПН до гемодиализа были значительно выше, чем у пациентов с нормальной функцией почек (СКФ=71,8 мл/мин/1,73 м2). У 6 (11,3%) из 53 пациентов с ХБП и у 4 (16,7%) из 24 пациентов с ТПН значения I-FABP превышали пороговый уровень, используемый для диагностики острой мезентериальной ишемии, несмотря на отсутствие характерных симптомов. Кроме того, на фоне процедуры гемодиализа отмечалось значимое снижение концентрации I-FABP на 45,1% до уровня, близкого к показателям лиц с нормальной функцией почек [20]. В другой серии исследований из Тайваня уровни кишечной, печеночной и сердечной фракций FABP увеличивались параллельно с прогрессированием ХБП-С2–4 и служили фактором риска развития диабетической нефропатии у больных сахарным диабетом 2-го типа [21, 22]. Эти данные дают основание рассматривать I-FABP не как биомаркер повреждения энтероцитов, а как диагностический и прогностический показатели нарушения функции почек.
Ограничениями настоящей работы являются небольшое число включенных пациентов, а также отсутствие учета факторов, ранее показавших значимое влияние на содержание I-FABP (состояние мезентериального кровотока, сердечная недостаточность и другая коморбидная патология). Кроме того, дизайн кросс-секционного исследования исключает возможность анализа причинно-следственных взаимосвязей.
Заключение
Совокупный анализ полученных нами данных и результатов других аналогичных исследований показывает, что содержание I-FABP повышено у пациентов с нарушением функции почек вследствие значимого влияния на его концентрацию в крови сниженной СКФ. Клиницистам и исследователям следует принимать во внимание этот аспект при использовании I-FABP в качестве биомаркера повреждения энтероцитов у лиц с почечной недостаточностью.



