В структуре обструктивных уропатий гидронефроз занимает ведущее место: частота его обнаружения составляет 1 : 500–1 : 800 новорожденных. У девочек данная патология встречается в 1,5 раза чаще, чем у мальчиков [1–3]. По мнению Н.А. Лопаткина, большинство тяжелых заболеваний почек у взрослых оказывается следствием несвоевременно распознанных заболеваний и пороков развития мочевой системы у детей [4, 5]. Особенно сложным считается объективная оценка морфологических и гистохимических изменений в паренхиме при гидронефрозе. Считается, что диспластические изменения в почках при гидронефрозе являются результатом нарушения синтеза и активности множества факторов роста в нефрогенезе. Интерес к гидронефротической трансформации объясняется тем, что предоставленный естественному течению, он заканчивается гибелью почки или почечной недостаточностью. Сложный механизм структурных изменений в почке и верхних мочевых путях при гидронефротической трансформации имеет индивидуальные особенности и зависит от многих причин. Нарушения уродинамики верхних мочевых путей ввиду общности иннервации почечной паренхимы, чашечно-лоханочной системы и мочеточника вызывают ответную реакцию почки и ее сосудов. Этим и объясняются значительные уродинамические нарушения почки, которые возникают при обструкции мочеточника. Интерес к данному заболеванию обусловлен недостаточной информацией этиологических, патогенетических, клиникоморфологических аспектов гидронефроза. Одним из таких вопросов является недостаточная изученность морфологических изменений стенки мочеточника и его интрамурального нервного аппарата, что послужило основанием к настоящему исследованию.
Под нашим наблюдением находились 67 детей в возрасте от 3 месяцев до 16 лет. Для диагностики гидронефроза проведено комплексное УЗИ почек (фармакоэхография, допплерография сосудов почек и мочеточниково-пузырного выброса мочи), экскреторная, магнитно-резонансная урографии и КТ-ангиография. С целью определения функциональной способности почек выялена скорость клубочковой фильтрации, рассчитанная по клиренсу эндогенного креатинина (формула Шварца). Забор материала для гистологических исследований проведен интраоперационно. Материал (резецированная часть лоханки или мочеточника) фиксировался в 10 %-ном растворе нейтрального формалина, затем заливался в парафин по общепринятой методике. С парафиновых блоков изготавливались срезы толщиной 3–5 мкм, которые окрашивались гематоксилином и эозином, Массон-трихромом и пикрофуксином по методу Ван Гизона.
 Исследования проведены с помощью компьютерного комплекса «Аксиоскоп 40 ФЛ» и видеотеста «Морфология-5», представляющего собой специализированную систему анализа изображений. При интраоперационной ревизии прилоханочного отдела мочеточника наиболее частой причиной гидронефроза являлось его сужение, причем короткий непротяженный стеноз (до 0,5 см) наблюдался в 43 (64,0 %) случаях, стеноз мочеточника на протяжении не более 1,5 см – в 24 (36,0 %).
Исследования проведены с помощью компьютерного комплекса «Аксиоскоп 40 ФЛ» и видеотеста «Морфология-5», представляющего собой специализированную систему анализа изображений. При интраоперационной ревизии прилоханочного отдела мочеточника наиболее частой причиной гидронефроза являлось его сужение, причем короткий непротяженный стеноз (до 0,5 см) наблюдался в 43 (64,0 %) случаях, стеноз мочеточника на протяжении не более 1,5 см – в 24 (36,0 %).
В нормальных физиологических условиях структура почечной лоханки и мочеточника, как и всех полостных органов, включает четыре оболочки: слизистую, подслизистую, мышечную и наружную (адвентициальную). Для нормальной уродинамики наибольшее значение имеет оптимальное структурное соотношение мышечной оболочки и эластического компонента соединительной ткани, составляющее основу слизистой и подслизистой оболочек, а также соединительнотканных прослоек между мышцами. Мышечная оболочка лоханки и мочеточников представлена двумя слоями гладкой мышечной ткани: внутренним (продольным) и наружным (циркулярным). Пучки этих мышц переплетаются с прослойками рыхлой неоформленной соединительной ткани, подразделяющими слои мышц на структурно-функциональные единицы, содержащие по 15–30 миоцитов. При морфологическом изучении резецированных ЛМС у детей с врожденным гидронефрозом нами выявлено, что в основе обструкции ЛМС лежат структурные изменения, ограниченные зоной физиологического сужения, преимущественно врожденного характера – даже в тех случаях, когда ЛМС визуально не был изменен.
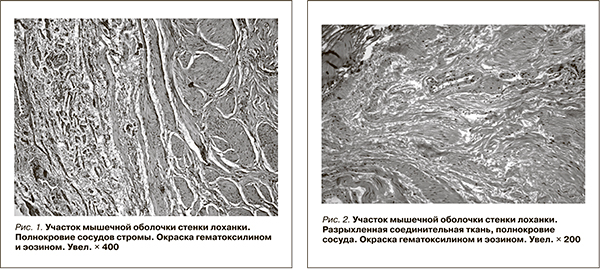
Граница между слизистой и подслизистой оболочками была практически неразличима. Эластический каркас слизистой и подслизистой оболочек был слабо развит, определялись лишь единичные волокна. В составе соединительной ткани преобладали коллагеновые волокна. Мышечная оболочка лоханки и мочеточника была четко представлена двумя слоями: продольным и циркулярным. В некоторых участках пучки миоцитов были перемешаны и их разграничение между слоями отсутствовало; они сливались в один толстый мышечный слой, в котором пучки миоцитов располагались хаотически в разных направлениях. У двух пациентов мышечная оболочка лоханки была гипертрофирована, имела значительную толщину с преобладанием продольно расположенных миоцитов, которые были слабо выражены, не оформлены в пучки, соединительнотканных прослоек между ними было недостаточно. Патоморфологические изменения в ЛМС характеризовались нарушением гемоциркуляции в виде неравномерного полнокровия сосудов, участками отмежевания плазмы от форменных элементов крови, плазморрагиями с развитием паравазального отека и десквамации переходного эпителия (рис. 1).
В артериях среднего и мелкого калибров наблюдали признаки полнокровия. Отмечены отек подслизистой основы, участки кровоизлияний, полнокровие новообразованных сосудов (рис. 2).
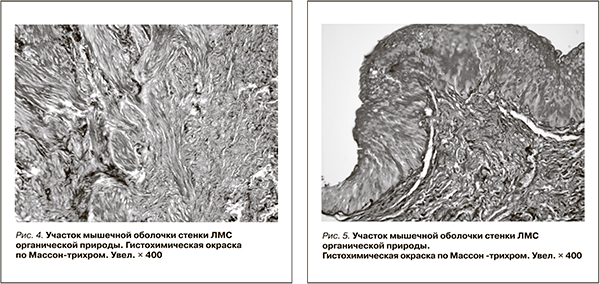
Отмечено нарушение соотношения гладкомышечных и соединительнотканных элементов в пользу последних. Обнаружены обширные поля соединительной ткани. Гистохимическое исследование на коллагеновые и соединительнотканные волокна выявило положительную реакцию в измененных участках (рис. 3–5).
Таким образом, результаты морфологических исследований ЛМС показали наличие широкого спектра врожденных и приобретенных почечных изменений, связанных с врожденной обструкцией мочевого тракта. При гидронефрозе, обусловленном органическим сужением зоны ЛМС, ведущими морфологическими признаками явились разрастание соединительнотканных элементов при полной атрофии миоцитов.