Введение
Нефротический синдром (НС) относится к редким, но тяжелым вариантам гломерулопатий у детей. Его распространенность составляет 1,9–2,6 на 100 тыс. детского населения [1–4]. Этническая гомогенность украинской популяции позволяет предположить, что уровень НС в нашей стране приближается к той же цифре. В большинстве случаев дети с НС являются чувствительными к стандартному лечению глюкокортикоидами (ГК) и заболевание у них имеет благоприятное течение [1, 5, 6]. Отсутствие ответа на ГК или стероид-резистентность (СР), наблюдаемое в 10–20 % случаев, ассоциируется с высоким риском развития хронической почечной недостаточности (ХПН) [2, 7]. Главной проблемой формирования сохраняющей и адекватной терапевтической стратегии при НС является гетерогенность течения СР и стероид-чувствительных (СЧ) вариантов заболевания при схожести клинических признаков и гистологической картины. Однако если при наличии СЧ существующие сегодня программы терапии можно считать стандартизованными, то поиск путей оптимизации лечения СР НС продолжается, при этом постоянно анализируется эффективность разных комбинаций иммунотропных препаратов и сроков их использования [3, 5, 8–12]. Определение факторов прогнозирования СР, идентификация факторов риска развития ХПН на ранних стадиях заболевания имеют важное значение для клинической нефрологии [3, 4, 10, 11, 13–15]. Целью настоящей работы стало исследование функции выживания у больных с СР-вариантом гломерулонефрита (ГН) с НС в Украине, выявление факторов риска развития ХПН у данной категории больных.
Материал и методы
Дизайн исследования – динамическое ретроспективное, объект – пациенты с СР НС, наблюдавшиеся в клинике детской нефрологии ГУ “Институт нефрологии” АМН Украины (клиническая база – ДКБ № 7 Киева) в 1980–2006 гг. на протяжении не менее трех лет.
Диагноз заболевания был установлен при наличии клинико-лабораторного симптомокомплекса НС – протеинурии (> 3 г/сут, в младшей возрастной группе > 1 г/м2), гипоальбуминемии (< 25 г/л), гиперхолестеринемии (> 6,5 ммоль/л), отеков. Гематурия диагностована при эритроцитурии > 5000
(в 1 мл утренней мочи из средней порции), гипертензия – при повышении артериального давления (систолического и/или диастолического) > 95th перцентилей с учетом возраста, пола больного и весового коэффициента. Нарушение функции почек начального периода (НФП) документировано при увеличении уровня сывороточного креатинина (100–460 μмоль/л), сопровождавшемся снижением скорости клубочковой фильтрации по Schwartz [16]. Развитие ХПН подтверждалось при замедлении клубочковой фильтрации < 60 мл/мин/1,73 м2 на протяжении трех месяцев и более (хроническое заболевание почек III ст. и выше).
Все больные получили комбинированную иммуносупрессивную терапию (алгоритм терапии представлен на рис. 1) [17].
В индукционной терапии применялись ГК в течение 6 недель (в дозе по преднизолону 1,5–2,0 мг/кг/сут в 2–3 приема, не более 50 мг/сут). Затем дозу снижали до половинной (каждые сутки на 5 мг) и пациентов переводили на поддерживающую терапию в альтернирующем (через день) или интермиттирующем (три последовательных дня в неделю) режиме. Начальная поддерживающая доза ГК составляла 30–50 % от максимальной (12,5–17,5 мг в зависимости от веса ребенка) и снижалась на
2,5 мг каждые 6–8 недель до 5 мг.
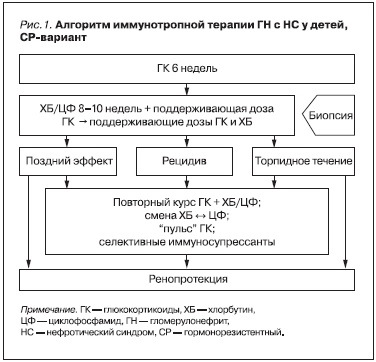
Отсутствие нормализации анализов мочи на фоне максимальных доз препарата в течение 6 недель расценивалось как СР (частичная или полная). В ряде случаев в протокол лечения был включен метилпреднизолон в виде “пульс”-терапии (препарат вводили внутривенно в дозе 20–30 мг/кг/сут, не более 1 г на введение через день три раза) [18].
В качестве первой линии ЦС при СР НС использовались алкилирующие агенты (хлорбутин – ХБ или циклофосфамид – ЦФ) в максимальных дозах в условиях стационара 8–10 недель [19]. Расчетная доза ХБ составляла 0,15–0,2 мг/кг/сут per os (кумулятивная доза – 8,5–10 мг/кг). ЦФ применялся в режиме “пульс”-терапии (внутривенно в дозе 10–25 мг/кг/введение, не более 1000 мг на введение 1 раз в 3 недели, № 3, кумулятивная доза – 30–36 мг/кг) или внутримышечно (6–9 мг/кг/введение 1 раз в 3 дня, кумулятивная доза – 120–150 мг/кг). После лечения в максимальной дозе ЦС все больные переводились на поддерживающую терапию ХБ (0,1 мг/кг/сут) еще на протяжении 9 месяцев (кумулятивная
доза – 20–27 мг/кг) на фоне цикловой или альтернирующей дачи ГК.
В части случаев были использованы ЦС второй линии – селективные иммунодепрессанты: микофенолата мофетил (ММФ) в дозе 500–600 мг/м2/день или циклоспорин А (ЦсА) в дозе 5–6 мг/кг/день (под контролем концентрации препарата в цельной крови – 90–120 нг/мл) [20]. Как правило, это были пациенты с высокими кумулятивными дозами ЦС в ходе предшествовавшей терапии или со значительными побочными эффектами.
Общая длительность ГК- и ЦС-терапии составляла 12–15 месяцев, в случае применения селективных иммуносупрессантов срок ГК ограничивался 6–9 месяцами. После 2004 г. в отсутствие противопоказаний с 6-й недели лечения всем больным назначался препарат группы ингибиторов АПФ
на 18–24 месяцев (2,5–5 мг/сут/на ночь в расчете на дозу эналаприла).
Для уточнения эволюционных особенностей заболевания в зависимости от сроков первичной госпитализации изучаемая когорта была распределена на два временных интервала: 1980–2000 и 2001–2006 гг. Такая структуризация была обусловлена особенностями терапевтической стратегии на каждом этапе. В частности, 2001–2006 гг. характеризовались редукцией кумулятивных доз иммунодепрессантов, более частым использованием “пульс”-режимов и ингибиторов АПФ. Предыдущему периоду (1980–2000) были присущи поиск терапевтических подходов и формирование собственных протоколов с пролонгацией ГК- и ЦС-терапии.
У части пациентов была проведена нефробиопсия. В данное исследование было включено 25 биопсий, выполненных в 2004–2006 гг., и 114 препаратов более раннего периода, которые было возможно изучить повторно с учетом современных гистологических подходов. Из общего количества биоптатов 38/27,3 % были получены не позднее 6 месяцев от начала заболевания, а 42/30,2 % – у пациентов с анамнезом три года и более.
Полученные результаты обработаны с использованием методов вариационной статистики и непараметрических подходов (SigmaPlot 2000 for Windows Version 6.00, 1986–2000 SPSS Inc.; SPSS Statistics 17.0, 1989–2008 SPSS Inc., IBM Company). Количественные переменные представлены как медиана/25 : 75 перцентилей. Вес отдельных переменных в формировании ХПН изучен с помощью техники Cox реСРессии с определением Hazard risk ratios (HR) и 95 % доверительным интервалом
(confidence interval – CI) в два этапа – первоначально вес каждого признака оценивался индивидуально (унивариантная модель), затем исследовали взаимосвязь статистически весомых переменных (мультивариантная модель) [21]. Статистически достоверными считались различия в результатах при уровне p < 0,05.
Результаты и обсуждение
В исследование были включены 646 детей в возрасте от 1,5 до 16 лет и длительностью заболевания до поступления в клинику от 1 до 168 месяцев. Общая характеристика больных в изучаемые временные интервалы представлена в табл. 1.
В 2001–2006 гг. среди СР-пациентов преобладали мальчики в отличие от первого временного периода, когда соотношение мальчиков и девочек составляло 1,0 к 1,1. Не было различий в медиане возраста пациентов на момент дебюта НС (9 лет). Хотя общепринятым пиком манифестации классического НС у детей считается возраст 3–4 года; развитие СР-варианта характерно для старших пациентов [2, 3].
Достоверные различия выявлены в клинической презентации заболевания (табл. 2). Большая часть пациентов в каждом интервале времени имели кроме признаков “классического” НС гематурию и/или гипертензию. В 2001–2006 гг. доля больных с гипертензией и сочетанием гематурии и гипертензии
значительно возросла (р = 0,026 и 0,017 соответственно), а частота выявления изолированной гематурии снизилась (р = 0,002). Увеличилось также число пациентов с НФП начального периода (р = 0,002).
Наличие этих не типичных для НС признаков (гематурии, гипертензии, НФП) было обусловлено спецификой работы клиники, концентрирующей наиболее сложные в прогностическом плане случаи НС. Однако не исключено, что повышение в 2001–2006 гг. доли пациентов с отягчающими прогноз клиническими признаками могло не только быть связано с особенностями формирования исследуемой когорты, а являться следствием эволюционного процесса в течении заболевания.
Таблица 1. Характеристика больных, включенных в исследование (1).
Клиническое ведение СР НС в значительной мере зависит от гистологического паттерна заболевания. Морфогистологическое исследование 130 нефробиоптатов выявило доминирование мезангиопролиферативного ГН (МзПГН) и фокально-сегментарного гломерулосклероза (ФСГС) (табл. 2). Доля МзПГН у наших пациентов была значительно выше, чем в исследованиях других авторов [1, 3, 7], что с наибольшей вероятностью обусловлено возможностями лаборатории (например, отсутствием иммунофлюоресцентного исследования до 2004 г.). Значительный рост различных типов ФСГС в 2001–2006 гг., обнаруженный нами, перекликается с сообщениям ведущих нефропатологов мира об увеличении доли ФСГС среди пациентов с НС [1, 2, 13, 22–24]. Обращало внимание, что в каждом 6–7-м случае биопсии был диагностирован фибропластический ГН (глобальный склероз в большинстве гломерул, сочетающийся с фибропластическими и атрофическими изменениями интерстиция) как драматический исход других гистологических повреждений. Такой стабильно высокий уровень фибропластического ГН был связан как с “агрессивной” клинической картиной заболевания, так и со сроками проведения биопсии почки.
К сожалению, использование нефробиопсии в качестве диагностической опции в Украине во многом лимитировано социально-экономическими условиями. Это ограничение в сочетании с практически отсутствующей возможностью заместительной почечной терапии в Украине для детей способствовало разработке собственных протоколов терапии СР НС (см. выше), призванных затормозить ухудшение ренальных функций, обусловленное активностью НС. Их отличительной от международных стандартов особенностью стали пролонгированное назначение ГК и относительно более высокие кумулятивные дозы ЦС.
Несмотря на различия международных и украинских программ применения иммунотропных препаратов при НС, эффективность их схожа. Частота ХПН как исхода СР НС в нашей когорте в 1980–2000 гг. составила 204/17,6 %, а во втором интервале времени снизилась до 21/11,2 % (p = 0,008). Терминальная стадия ХПН была документирована в 168/14,5 и 12/6,4 % случаев соответственно, что совпадает с данными других авторов, свидетельствующими об уровне почечной выживаемости, составившей от 65 до 92 % [3, 4, 8, 10, 13–15, 22].
Для оценки динамики риска развития ХПН среди больных с СР НС мы использовали технику Kaplan-Meier survival function, демонстрирующую кумулятивную возможность развития ХПН, но нивелирующую преждевременную (до 60 месяцев) “потерю” из наблюдения части пациентов (рис. 2). Заключительный расчетный пятилетний риск развития ХПН составил 39,7 % для СР-пациентов, наблюдавшихся между 1980 и 2000 гг., и 27,7 % для больных, поступивших в клинику в 2001–2006 гг. (logrank = 2,67, p = 0,008). Таким образом, получено достоверное снижение риска развития ХПН в 2001–2006-е гг., несмотря на более тяжелые клинические характеристики заболевания и использование более “щадящих” режимов иммунотропной терапии.
Наиболее важным предиктором прогноза НС признано отсутствие ответа на ГК-терапию. Однако комбинации и других факторов имеют прогностическую нагрузку. Большинство исследований по идентификации предикторов ХПН гетерогенны и ограничены малыми выборками [3, 22, 25]. Нами была использована модель Cox regression, конечным вариантом для построения которой стал риск развития
ХПН в конкретном интервале времени на протяжении всего периода наблюдения с учетом нескольких исходных переменных (табл. 3). Четыре переменных из изученных (пол – женский, возрастные группа – дети до 3 лет и старше 9, наличие артериальной гипертензии и НФП начального периода) в качестве индивидуальных прогностических факторов риска развития ХПН оказались высокозначимыми в 1980–2000 гг. Для уточнения взаимосвязи исследуемых переменных анализ был дополнен техникой мультивариантной Cox regression, подтвердившей, что достоверными предикторами риска ХПН в 1980–2000 гг. стали НФП начального периода и гипертензия.
Таблица 2. Характеристика больных, включенных в исследование (2).
Рисунок 2. Kaplan-Meier-анализ риска развития ХПН при СР НС у детей.
К сожалению, ни одна из исследуемых переменных не стала значимой при построении унивариантной модели для 2001–2006 гг., что нивелировало необходимость построения мультимодели. Отсутствие достоверных признаков бесспорно связано как с более коротким временным интервалом, так и с меньшим числом пациентов. Однако, хотя статистически весомых факторов в 2001–2006 гг. не было обнаружено, выявлено, что риск ХПН среди мальчиков вырос на 22 % (HR = 0,78), тогда как в первый временной интервал он был на 32 % ниже индифферентной отметки и свидетельствовал о достоверно
высоком риске развития ХПН у девочек с СР НС (HR = 1,32, p = 0,046). Кроме того, в 1980–2000 гг. HR был наименьшим (с наименьшим риском развития ХПН) у больных в возрасте от 3 до 6 лет (HR = 0,42). В 2001–2006-е гг. эта возрастная группа продемонстрировала самый неблагоприятный HR (1,80). Ранее данная комбинация факторов (мужской пол и возраст от 3 до 6 лет) не рассматривалась как неблагоприятная в случае СР НС.
Таблица 3. Факторы риска развития ХПН при СР НС у детей.
Клинический риск таких переменных, как гематурия, гипертензия, НФП в дебюте заболевания, имел стабильно схожий уровень HR в оба временных интервала, но за счет меньшего числа больных, включенных в исследование в 2001–2006-е гг., удлинялся CI, и эти вариации оказались незначимыми в
прогнозе ХПН.
Данное исследование является одним из наибольших ретроспективных исследований, проведенных в рамках одного центра, и единственным, выполненным в Украине. Несмотря на определенные ограничения, не позволяющие проецировать результаты данной работы на всю детскую популяцию, заслуживают внимания выявленные качественные изменения в развитии СР НС у детей в 2001–2006 гг.
Так, более часто встречалось нетипичное течение заболевания, сочетающееся с артериальной гипертензией, НФП начального периода. Кроме того, ни один из значимых прогностических факторов риска развития ХПН в 1980–2000 гг. (начало заболевания до 3 лет, женский пол, наличие артериальной гипертензии, НФП в дебюте НС) не был весомым в 2001–2006 гг., зато выявлено повышение риска развития ХПН у мальчиков в возрасте 3–6 лет. Полученные результаты усложняют использование традиционных протоколов иммунотропной терапии у детей и требуют их адаптации к
современным условиям.



