Введение
Хроническая болезнь почек (ХБП) занимает особое место среди хронических неинфекционных болезней, поскольку она широко распространена, связана с резким ухудшением качества жизни и высокой смертностью [1–3]. По данным эпидемиологических исследований, распространенность ХБП среди взрослого населения США, Западной Европы, Австралии, Китая находится в диапазоне от 11 до 16 % [4–7]. Данные о распространенности ХБП среди населения России отсут-ствуют, поскольку не проводилось соответствующих крупных популяционных исследований. Однако исследования, выполненные в отдельных категориях населения, позволяют предполагать, что распространенность ХБП в нашей стране очень высока. Так, по данным обследования пожилых пациентов, наблюдавшихся в городской поликлинике № 107 Москвы в 2008 г., у лиц старше 60 лет признаки ХБП отмечались в половине случаев, а в более старших возрастных группах – у 66,3 % [9]. Среди пациентов трудоспособного возраста, проходивших обследование в отделениях терапии Коломенской ЦРБ, частота ХБП, которая диагностировалась по наличию снижения скорости клубочковой фильтрации (СКФ), составляла 16 %, а у лиц, страдающих сердечно-сосудистыми заболеваниями, – 26 % [10]. Признаки ХБП отмечаются более чем у трети больных хронической сердечной недостаточностью [11].
Верхушку «айсберга» ХБП, привлекающую наибольшее внимание медицинского сообщества и организаторов здравоохранения, составляют больные терминальной почечной недостаточностью (ТПН), характеризующейся высокой смертностью и коморбидностью, требующей дорогостоящей заместительной почечной терапии (ЗПТ) – диализа или трансплантации почки [12–14]. В нашей стране с 1998 по 2007 г. число людей, получавших ЗПТ, увеличилось в 2,5 раза, однако и сейчас обеспеченность населения данными видами лечения остается в 3–7 раз ниже, чем в странах Евросоюза, в 10 раз ниже, чем в США [15]. Однако успешное решение проблемы ХБП путем только развития ЗПТ невозможно. Первостепенное значение имеют раннее выявление ХБП и своевременное назначение нефропротективной терапии, а также проведение комплекса профилактических мероприятий среди лиц, входящих в группу риска [16].

Диагностика ХБП строится на двух критериях: наличии маркеров почечного повреждения, среди которых ведущее место занимает повышенная альбуминурия (АУ), и/или снижение СКФ [8]. Повышение уровня АУ служит наиболее ранним и чувствительным маркером почечного повреждения и может наблюдаться даже при полном отсутствии протеинурии [17]. Ранние стадии ХБП (1 и 2) характеризуются нормальным или незначительным снижением СКФ и повышенной АУ [17, 18], которая имеет в данном случае решающее значение для диагностики. При СКФ ниже 60 мл/мин/1,73 м2 уровень АУ не имеет решающего значения для диагностики ХБП, однако он сохраняет свою роль в прогнозировании скорости прогрессирования ХБП и развития сердечно-сосудистых осложнений [19]. Более того, все шире высказывается мнение, будто изолированное (т.е. без повышения АУ) снижение СКФ в пределах 45–59 мл/мин/1,73 м2, особенно у пожилых, не требует вмешательства, поскольку из-за очень низких темпов дальнейшего падения функции почек ожидаемое время развития ТПН у них значительно превосходит ожидаемую продолжительность жизни [20].
Таким образом, исследование АУ имеет первостепенное значение для ранней диагностики ХБП, когда отсутствуют протеинурия и снижение СКФ, а также для оценки риска ее прогрессирования и развития сердечно-сосудистых осложнений – как на ранних, так и на более поздних стадиях. Простота и доступность метода – его важное достоинство, необходимое для проведения скрининговых исследований.
В настоящее время широко обсуждается, какой уровень АУ считать нормальным, поскольку и при ее значениях ниже 30 мг/г, прежде считавшихся нормальными, сохраняется корреляция между величиной АУ и риском сердечно-сосудистых осложнений [17]. Поэтому на сегодняшний день нормальным считают уровень АУ ниже 10 мг/г, а ее величину 10–29 мг/г определяют как незначительное или начальное повышение. Уровень АУ, превышающий 30 мг/г, является безусловным отклонением от нормы, маркером ХБП и фактором риска ее прогрессирования [17].
Действующие клинические рекомендации предписывают регулярное определение уровня АУ у пациентов, длительно страдающих сахарным диабетом, гипертонической болезнью [17]. Однако даже в этих группах, находящихся под пристальным наблюдением специалистов-эндокринологов и кардиологов, на практике мониторинг маркеров ХБП не всегда проводится должным образом. Лица, не страдающие данными заболеваниями, но имеющие другие факторы риска ХБП, вообще не получают внимания.
Cкрининг всего населения на предмет наличия повышенной АУ считается нерациональным из-за организационных трудностей и огромных финансовых затрат [21], поэтому представляется актуальной разработка методики, позволяющей проводить разносторонний и комплексный анализ всей совокупности факторов риска ХБП и выделять группу лиц, нуждающихся в проведении теста на АУ в первоочередном порядке.
В нашей стране в 2009 г. в рамках программы «Здоровая Россия» было открыто 502 центра здоровья для взрослого населения, деятельность которых направлена на выявление факторов риска социально значимых заболеваний, формирование здорового образа жизни населения и отказ от вредных привычек. Каждый желающий может пройти в них бесплатное обследование. Центры здоровья в своей деятельности используют в основном скрининговые технологии, не требующие инвазивных вмешательств, к которым относится взятие крови из вены, что исключает возможность определения уровня креатинина крови и СКФ. Однако определение АУ методом сухой химии (тест-полосок), не требующее взятия крови, не представляет технических трудностей в условиях центров здоровья, не связано с большими затратами и в случае внедрения могло бы дать большие возможностей для раннего выявления ХБП и оценки сердечно-сосудистого риска.
Целью данного исследования были выявление путем анкетирования посетителей центров здоровья Московской области наличия факторов риска ХБП, определение у них частоты повышенной АУ как маркера ХБП; оценка ее связи с исследованными факторами риска и на основании полученных данных разработка многофакторной регрессионной модели, позволяющей рассчитывать риск развития ХБП и определять показания к проведению теста на АУ.
Материал и методы
Проведено обследование 1623 человек: 390 (24 %) мужчин, 1233 (76 %) женщин; средний возраст составил 46 ± 16 лет. В исследование были включены лица, не наблюдавшиеся у нефролога, которые обратились в центры здоровья Московской области для составления индивидуального плана по укреплению здоровья и рекомендаций по коррекции факторов риска. Исследование прошло в 24 городах Московской области.
Всем обследованным выполнены анализы разовой порции мочи с помощью тест-полосок МикроАльбуфан производства компании Лахема (Чехия). Диагностические полоски МикроАльбуФан предназначены для полуколичественного измерения концентрации альбумина в моче. Тест для измерения альбумина в моче основан на принципе изменения цвета кислотно-основного индикатора под влиянием белков. Исследовались разовые порции мочи. Уровень АУ > 30 мг/л расценен как высокий.
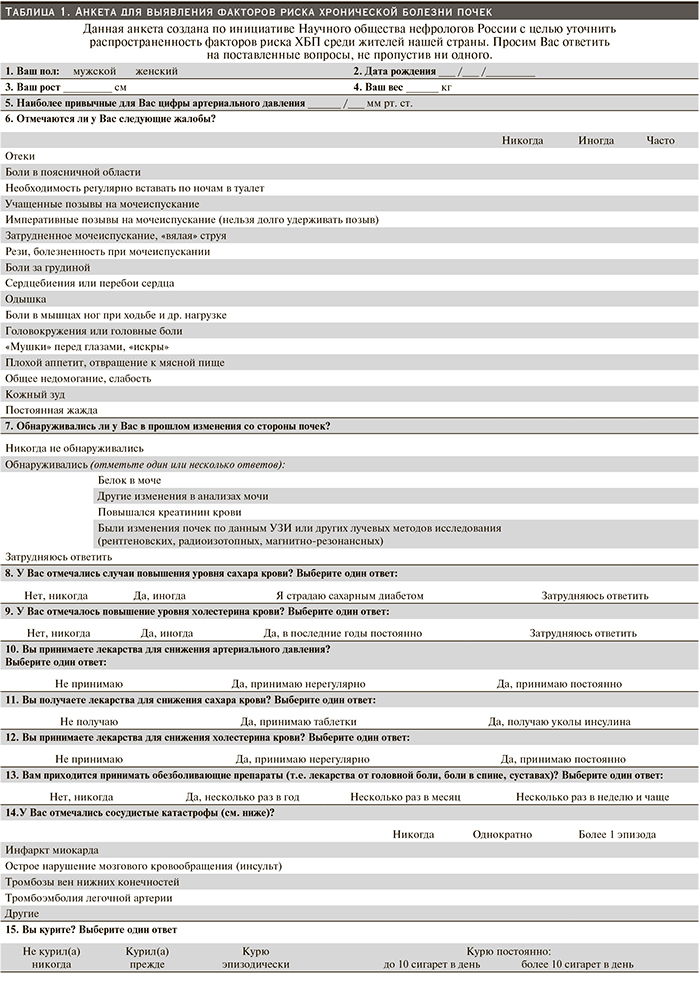
Для оценки возможных факторов риска ХБП нами была разработана анкета (табл. 1), отражающая пол, возраст, антропометрические данные пациентов, наличие сопутствующих заболеваний, приверженность здоровому образу жизни, курение. Произведен также расчет индекса массы тела (ИМТ).
В зависимости от значения ИМТ определен питательный статус: нормальный ИМТ – 20–25 кг/м2, избыточная масса тела (предожирение) – 26–30 кг/м2, ожирение > 30 кг/м2. Артериальную гипертонию (АГ) определяли как наличие систолического АД ≥ 140 мм рт. ст. и/или диастолического АД ≥ 90 мм рт. ст. и/или постоянный прием антигипертензивных препаратов.
Анкета включала вопросы, касающиеся жалоб на момент обследования, данных анамнеза: наличие в прошлом сахарного диабета или эпизодов повышения сахара, холестерина, изменений в анализах мочи, а также наличие сахарного диабета, АГ и заболеваний почек у прямых родственников.
Статистическая обработка полученных данных проведена с использованием компьютерной программы SPSS Statistics 18,0. Для проверки статистической значимости различий частотных показателей использован критерий 2 по Пирсону. Статистически достоверными считались различия в результатах при уровне р < 0,05. Для выявления и оценки связей между исследуемыми показателями применен непараметрический корреляционный анализ по методу Спирмена.
С учетом наличия внутренних корреляций между исследуемыми параметрами был использован многофакторный анализ. По данным многофакторного анализа была составлена регрессионная модель, куда были включены все показатели, обладающие достоверной связью с ХБП. Затем методом пошагового отброса переменных была создана конечная модель, наиболее достоверно предсказывающая развитие АУ > 30 мг/л и содержащая переменные, имеющие самостоятельное прогностическое значение. Соотношение чувствительности и специфичности получаемых при этом прогностических моделей оценено с помощью ROC-кривых.
Результаты и обсуждение
Частота АУ > 30 мг/л среди лиц мужского и женского пола была одинаковой (43 и 41 % соответственно). Среди лиц более старшего возраста (> 50 для мужчин и > 55 лет для женщин) АУ > 30 мг/л встречалась достоверно чаще, чем среди лиц молодого и среднего возраста, – 48 и 39 %, р < 0,001. Полученные нами данные подтверждают результаты ранее проведенных исследований, согласно которым пожилой возраст служит одним из ведущих факторов риска ХБП [22–24]. С одной стороны, более высокая частота повышенной АУ у пожилых могла отражать наличие известных факторов риска ХБП – избыточного веса, сахарного диабета, АГ, атеросклероза, сердечной недостаточности, злоупотребления анальгетиками, большого стажа курения. С другой стороны, это могло быть связано с возрастными инволютивными изменениями почечной ткани, когда уменьшение числа функционирующих клубочков приводит к развитию гиперфильтрации в остаточных нефронах, что сопровождается повышением АУ.
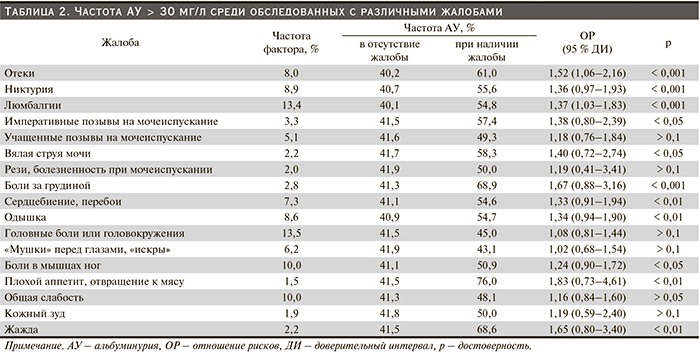
По результатам анкетирования среди жалоб, ассоциированных с АУ > 30 мг/л, на первом месте были таковые на отеки, боли за грудиной, плохой аппетит, отвращение к мясной пище, постоянную жажду. Полные данные о частоте АУ среди лиц с различными жалобами представлены в табл. 2.
В то же время жалобы на учащенное мочеиспускание, рези, болезненность при мочеиспускании, головокружение, головные боли, «мушки», «искры» перед глазами, общую слабость, кожный зуд не были ассоциированы с повышенной АУ.
Наибольшей специфичностью характеризовались жалобы, непосредственным образом связанные с поражением почек, мочевых путей и с уремией, такие как жажда, плохой аппетит, отвращение к мясу, вялая струя мочи, императивные позывы на мочеиспускание. Однако их чувствительность в отношении риска АУ > 30 мг/л была относительно низкой. Наиболее чувствительными предикторами были жалобы, связанные с поражением сердечно-сосудистой системы, такие как отеки, боли в мышцах ног, одышка. Жалобы на отеки, которые могут отмечаться как при самостоятельном заболевании почек, так и при сердечной недостаточности, характеризуются сочетанием высокой чувствительности и специфичности.
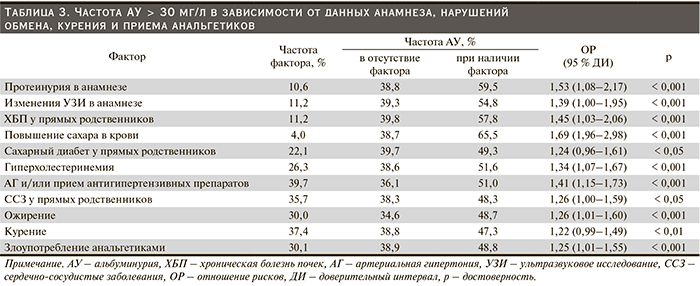
Следующий блок вопросов анкеты касался нефрологического анамнеза. На момент анкетирования АУ > 30 мг/л встречалась значительно чаще среди людей с обнаружением протеинурии в прошлом по сравнению с лицами, у которых протеинурия никогда прежде не выявлялась (табл. 3).
При наличии изменений почек по данным ультразвуковых исследований (УЗИ), проведенных в прошлом, частота АУ > 30 мг/л составила 54,8 %; у лиц без изменений в почках при УЗИ она достигла 39,3 %. До настоящего времени место УЗИ в диагностике ХБП остается не до конца определенным.
С одной стороны, наличие структурных изменений относится к признакам почечного повреждения и входит в диагностические критерии ХБП [5, 8, 18, 19]. С другой стороны, изменения в почках, по данным УЗИ, встречаются с высокой частотой (в нашем исследовании 11,2 % опрошенных отметили, что в прошлом имели место изменения по данным УЗИ), однако считается, что они, как правило, не связаны с риском развития ТПН, за исключением наиболее тяжелых и относительно редких нарушений (сморщивание почки, гидронефроз, злокачественная опухоль, коралловидный камень, поликистоз). Популяционные исследования по выявлению ХБП строились на данных лабораторных исследований – определении СКФ и АУ, но, как правило, не включали данные УЗИ. Наше исследование учитывало лишь данные анамнеза и не дает представления о том, какие конкретно симптомы структурных изменений почек при УЗИ отмечены у опрошенных. Однако выявленная связь этих изменений с АУ представляется важной. На основании полученных данных можно говорить о целесообразности для всех лиц с изменениями в почках по данным УЗИ проведения не только консультации уролога, но и нефрологического обследования с определением АУ и оценкой СКФ.
Достоверно чаще АУ > 30 мг/л также встречалась среди людей, прямые родственники которых, по данным анкеты, имели заболевания почек.
АУ была тесно связана с наличием у обследованных нарушений обмена веществ или наследственной предрасположенности к ним. Так, при наличии сахарного диабета или эпизодов повышения сахара в прошлом частота АУ > 30 мг/л составила 65,5 %. В 49,3 % случаев АУ > 30 мг/л была выявлена у людей, прямые родственники которых страдали сахарным диабетом. При нормальной массе тела и ожирении АУ > 30 мг/л была выявлена в 38,7 и 48,7 % случаев соответственно, р < 0,001. Полученные результаты соответствуют данным литературы о роли ожирения как фактора риска ХБП [25, 26]. АУ > 30 мг/л была выявлена в 51,6 % случаев у обследованных с гиперхолестеринемией в анамнезе, которая также может обсуждаться в качестве фактора риска ХБП [27, 28].
Роль АГ как одного из важнейших факторов риска развития и прогрессирования ХБП общеизвестна [2, 29–31]. Результаты ряда исследований свидетельствуют о взаимосвязи АУ с уровнем АД, особенно систолического, а также с недостаточным снижением уровня АД в ночные часы [32–34]. В нашем исследовании частота АУ > 30 мг/л у лиц с АГ составила 51 %, несмотря на то что большинство из них постоянно принимали антигипертензивные препараты, а у лиц, имеющих прямых родственников с сердечно-сосудистыми заболеваниями, частота АУ > 30 мг/л была достоверно выше, чем у лиц, не отягощенных семейным анамнезом по сердечно-сосудистым заболеваниям.
Оценивая образ жизни обследуемых, мы уделяли внимание таким факторам, как курение, злоупотребление анальгетиками, потребление жидкости и занятие физкультурой. У курящих людей и у тех, кто курил в прошлом, АУ > 30 мг/л встречалась достоверно чаще, чем у тех, кто никогда не курил (47,3 и 38,8 % соответственно, р < 0,01). Наши данные согласуются с таковыми ряда эпидемиологических исследований, которые свидетельствуют, что курение является дозозависимым фактором риска снижения СКФ и появления АУ [35–37]. При этом негативное влияние курения на состояние почек наблюдается как у мужчин, так и у женщин [38]. Наиболее ярко этот эффект проявляется при сочетании АГ и курения [36].
У людей, принимающих анальгетики минимум раз в неделю, АУ > 30 мг/л встречалась достоверно чаще (48,8 %), чем у тех, кто не принимает анальгетические препараты или принимает редко (38,9 %, р < 0,001). Частый прием анальгетиков представляет непосредственную угрозу для почек, т.к. данные препараты могут оказывать токсическое воздействие на эпителий почечных канальцев, а также способствуют их ишемическому повреждению за счет подавления продукции простагландинов [39]. Кроме того, частый прием пожилыми обезболивающих по поводу цефалгий нередко отражает плохой контроль АГ и низкую приверженность регулярной антигипертензивной терапии.
Низкая физическая активность также была связана с повышением АУ. При занятиях физическими упражнениями не менее 40–60 минут в неделю частота АУ > 30 мг/л была наименьшей – 34 %; у лиц, уделявших физическим упражнениям около 15 минут ежедневно, частота АУ > 30 мг/л составила 41 %; у тех, кто занимался физическими упражнениями эпизодически или не занимался вообще, частота АУ > 30 мг/л была 45 % (р < 0,01). С одной стороны, гиподинамия, вызывающая эндотелиальную дисфункцию, может непосредственным образом влиять на развитие ХБП [40]. С другой стороны, поскольку среди обследованных присутствовала значительная часть людей пожилого возраста, низкая физическая активность могла отражать наличие у них сердечно-сосудистых заболеваний, связанных с риском развития ХБП.
Отмечена ассоциация АУ > 30 мг/л с уровнем потребления жидкости. У лиц, потреблявших жидкость в ограниченном количестве, частота АУ > 30 мг/л была достоверно выше, чем у тех, кто потреблял много жидкости (54 и 43 % соответственно, р < 0,05). Потребление жидкости в объеме не менее двух литров в сутки на сегодня принято в качестве нормы здорового образа жизни. Ограничение потребления жидкости, ведущее к гиповолемии, может приводить к уменьшению перфузии почек и развитию их хронической ишемии, патологической активации ренин-ангиотензиновой системы и системы аргинин–вазопрессин [41, 42]. В то же время ограничение потребления жидкости значительной частью обследованных больных, среди которых немало лиц пожилого возраста, может быть связано с наличием склонности к отекам вследствие сердечной недостаточности, заболеваний мочевых путей, приводящих к императивным позывам.
Таким образом, нами был выявлен ряд факторов, связанных с повышенным риском ХБП (табл. 2, 3). Однако очевидно, что многие из них взаимосвязаны. Для комплексного оценки всей совокупности факторов, ассоциированных с АУ > 30 мг/л, и выявления среди них независимых переменных был использован многофакторный анализ.
В регрессионную модель были включены все факторы, достоверно связанные с развитием АУ > 30 мг/л: отеки, люмбалгия, никтурия, императивные позывы на мочеиспускание, вялая струя мочи, боли за грудиной, сердцебиение, перебои, одышка, боли в мышцах ног, плохой аппетит, отвращение к мясу, жажда, протеинурия в анамнезе, изменения УЗИ в анамнезе, ХБП у прямых родственников, повышение сахара в крови, сахарный диабет у прямых родственников, гиперхолестеринемия, АГ и/или прием антигипертензивных препаратов, ССЗ у прямых родственников, ожирение, курение, злоупотребление анальгетиками.
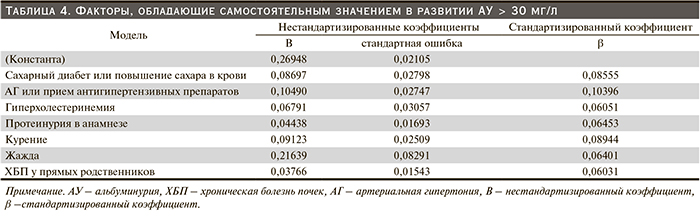
В результате применения многомерного линейного регрессионного анализа были выделены факторы, обладающие самостоятельным значением в развитии АУ > 30 мг/л и разработана математическая формула, с помощью которой осуществляется прогноз риска высокой АУ как раннего маркера ХБП в общей популяции (табл. 4).
Среди факторов, независимым образом связанных с АУ, на первом месте стоят АГ и сахарный диабет, что соответствует современным представлениям о нозологической структуре ХБП. Однако они были не единственными самостоятельными факторами риска. Неожиданным результатом была независимая связь между АУ и гиперхолестеринемией. При этом число обследованных с очень высокой АУ (более 300 мг/л) было незначительным (менее 2 %), что исключает «почечный» генез гиперлипидемии. Независимым образом с поражением почек были связаны курение, жалобы на жажду, наличие ХБП у прямых родственников.
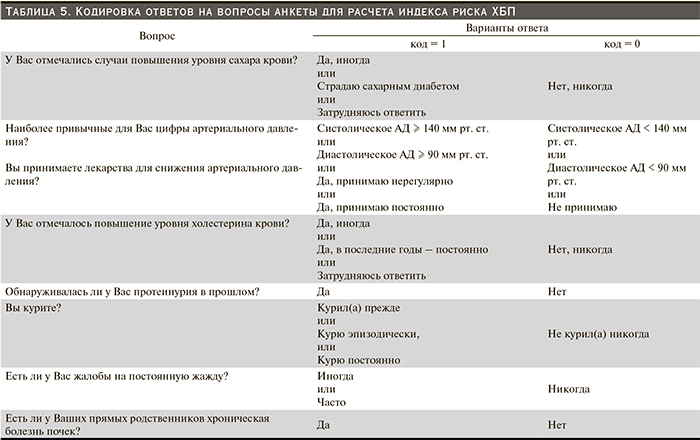
На основании полученных результатов нами был разработан индекс риска (ИР) ХБП, который рассчитывается по следующей формуле: ИР = 0,26948 + 0,08697*[СД или повышение сахара в крови] + 0,1049*[АГ и прием антигипертензивных препаратов] + 0,06791*[Гиперхолестеринемия] + 0,04438*[Протеинурия в анамнезе] + 0,09123*[Курение] + 0,21639*[Жажда] + 0,03766*[ХБП у прямых родственников].
При вводе данных в формулу используется цифровая кодировка переменных в зависимости от выбранного варианта ответа на вопросы анкеты (табл. 5).
Значительная часть опрошенных затруднялись ответить на вопросы, касающиеся уровня сахара и холестерина, что свидетельствует об отсутствии приверженности регулярным медицинским обследованиям, которые являются важной составляющей здорового образа жизни. Действительно по нашим данным вариант ответа на эти вопросы «затрудняюсь ответить» сочетался с риском повышения АУ. Это же касается и тех, кто отмечал у себя лишь «эпизодическое» повышение глюкозы и холестерина. Поэтому такие варианты ответа были объединены в «неблагоприятную» группу наряду с теми, кто имел диагноз сахарного диабета и стойкую гиперхолестеринемию. Не было получено существенных различий по влиянию на АУ между разными вариантами положительного ответа на вопрос о курении. «Курил(а) прежде», «курю эпизодически», «курю постоянно» – все эти варианты были также объединены в одну «неблагоприятную» группу.
ИР < 0,375 оценивается как низкий (при этом АУ > 30 мг/л наблюдается менее чем в 25 % случаев), ИР – 0,375–0,400 оценивается как повышенный, ИР > 0,400 – высокий (при этом АУ > 30 мг/л наблюдается более чем в половине случаев).
В соответствии с этим мы предлагаем следующую тактику дальнейшего ведения обследованных:
- При низком ИР проведение теста на АУ необязательно. Обследованному с целью нефропрофилактики дается информация об общих принципах ведения здорового образа жизни, вреде для почек курения, злоупотребления солью, высококалорийными продуктами, обезболивающими препаратами и пищевыми добавками, о пользе физической активности и расширенного водного режима.
- При повышенном ИР необходимо определить АУ методом тест-полосок. В случае отрицательного результата – соблюдение общих принципов здорового образа жизни, нефропрофилактика. В случае обнаружения АУ методом тест-полосок показано применение более точного количественного метода исследования мочи. При подтверждении высокого уровня АУ (> 30 мг/л) количественным методом показаны консультация нефролога, обследование, включающее оценку функции почек, определение нозологического диагноза и разработку индивидуальной программы нефро- и кардиопротекции с учетом риска прогрессирования заболевания и развития сердечно-сосудистых осложнений.
- При высоком ИР сразу же рекомендуется определение АУ количественным методом. В случае обнаружения высокого уровня АУ (> 30 мг/л) провести повторное исследование мочи количественным методом; при подтверждении высокого уровня АУ показана консультация нефролога с назначением дополнительного нефрологического обследования с целью постановки диагноза и выработки дальнейшей тактики ведения.
Заключение
Предложенный нами метод позволяет в условиях центров здоровья или при других профилактических обследованиях изучать разнообразные факторы риска развития ХБП и определять показания к лабораторному обследованию, что имеет важное значение как для улучшения выявления ХБП, особенно на ранних ее стадиях, так и для рационального назначения лабораторных тестов. Разработанная анкета не только дает возможность учитывать ведущие причины повышения АГ в популяции – сахарный диабет и АГ, но и привлекает внимание к факторам риска, которым не уделяют должного внимания: курению, гиперлипидемии, данным семейного анамнеза, обладающим, по нашим данным, пожилых самостоятельным значением в развитии ХБП.
Представляется немаловажным, что, заполняя анкету и проходя последующее собеседование с врачом, обследуемый получает представление о факторах, неблагоприятно влияющих на почки, у него формируется более осознанное отношение к необходимости ведения здорового образа жизни с целью профилактики ХБП, понимание необходимости регулярных профилактических медицинских обследований. Данные анкеты позволяют не только оценивать риск ХБП, но и составлять индивидуальную программу нефропрофилактики и нефропротекции с учетом особенностей, нашедших в ней отражение.
Учтя широкую распространенность АУ > 30 мг/л (более 40 % обследованных), считаем важным использование данного теста в практике центров здоровья и других медико-профилактических учреждений, а также рекомендуем анкетирование условно здорового населения для выявления факторов риска ХБП и определения показаний к нефрологическому обследованию.



