Несмотря на прогресс в диагностике, антибактериальной терапии и хирургических технологиях за последние 30 лет, заболеваемость и смертность от инфекционного эндокардита (ИЭ) не уменьшились [1–4]. Более того, в литературе имеются данные об увеличении доли больных подострым ИЭ [5, 6].
Инфекционный эндокардит часто ассоциируется с неблагоприятным прогнозом в связи с тяжелыми осложнениями - массивным тромбоэмболическим синдромом, застойной сердечной недостаточностью, хронической почечной и печеночноклеточной недостаточностью, которые наряду с другими
системными проявлениями нередко становятся первыми проявлениями заболевания [7–9]. При наличии осложнений эффективность терапии ИЭ снижается, а смертность достигает 90 % [10, 11].
По данным различных авторов, частота поражения почек при ИЭ колеблется от 2 до 78 % [10, 12–16]. При подостром течении ИЭ наиболее часто развиваются интерстициальный нефрит, токсическая нефропатия, острый тубулярный некроз, гломерулонефрит (ГН), кортикальный некроз. Причинами
поражения почек (ПП) при ИЭ являются застойная сердечная недостаточность, нежелательные реакции на антибактериальную терапию, иммунопатологические нарушения [17]. У многих больных ИЭ поражение почек может определенное время оставаться бессимптомным, что ведет к несвоевременной диагностике этого осложнения, снижает эффективность лечения и ухудшает прогноз. Смертность больных ИЭ с вовлечением почек значительно повышается [10]. На аутопсии поражение почек при ИЭ обнаруживают заметно чаще, чем in vivo [18].
Известно, что нарушения в системе гемостаза играют важную роль в патогенезе осложнений ИЭ. Тромбоэмболический и тромбогеморрагический синдромы носят системный характер и проявляются множественным поражением сосудов – артерий, вен, капилляров. При ИЭ отмечают инфаркты различной локализации: сердца, почек, легких, селезенки, головного мозга. Для ИЭ также характерен геморрагический синдром, который проявляется кровоизлияниями различной величины в кожу, слизистые оболочки, внутренние органы, головной мозг и кровотечениями из носа, десен, желудочно-кишечного тракта, кровохарканьем, гематурией [10, 12, 19, 20].
При подостром течении ИЭ наиболее распространенными являются церебральные эмболии с развитием ишемических и геморрагических инсультов, эмболии почечных сосудов с болевым синдромом и гематурией, острые очаговые изменения в миокарде (инфаркты миокарда), связанные с эмболией коронарных сосудов [21]. У 20 % больных ИЭ эмболии носят бессимптомный характер [22, 23]
Целью настоящего исследования стало определение особенностей и оценка роли нарушений в системе гемостаза в развитии ПП при подостром ИЭ.
Материал и методы
Обследовали 120 больных подострым ИЭ: I группа (93 больных – 77,5 %) – с ПП, II группа (27 больных – 22,5 %) – без ПП. В исследование включены больные достоверным ИЭ в соответствии с модифицированными Duke-критериями [24]. Всем больным в динамике выполняли стандартные
клинические, лабораторные и инструментальные методы исследования. Лабораторные методы включали общий анализ крови, мочи, уровень креатинина в сыворотке крови; бактериологические (посевы крови, мочи на стерильность с определением чувствительности микроорганизмов к антибиотикам), морфологические методы. Методы оценки сосудисто-тромбоцитарного звена гемостаза: подсчет количества тромбоцитов в крови (фазовоконтрастная микроскопия); гемолизат – агрегационный тест (ГАТ), определение фактора фон Виллебранда (ФВ). Методы исследования коагуляционного звена системы гемостаза: количественное определение фибриногена, активированное парциальное тромбопластиновое время (АПТВ). Методы оценки фибринолитической
системы крови: количественное определение уровня растворимых фибринмономерных комплексов (РФМК) в плазме по ортофенантролиновому тесту (ОФТ).
Двумерную трансторакальную ЭхоКГ, цветное допплеровское картирование кровотока выполняли по стандартной методике на аппарате “Sonolayer” SSA-140А, SSA-270А “Toshiba”, чреспищеводную ЭхоКГ – “Acuson” 128 XP/10. Ультразвуковое исследование почек выполняли на аппарате
“Ultramark-4 Plus” “ATL”.
Проведен статистический сравнительный анализ клинических и лабораторных признаков нарушений гемостаза в двух группах больных ИЭ. Достоверность их различий оценивали по критерию Стьюдента. Проведен корреляционный анализ показателей мочевого осадка и показателей гемостаза в группе больных ИЭ с ПП. Статистическую обработку проводили с применением пакета программ “Microsoft Excel 2007” и “Statistica 6.0”.
Результаты и обсуждение
В первой группе ИЭ с ПП преобладали больные с вторичной формой (52 %), высокой степенью активности (III степень – 49 %, II степень – 41 %, I степень – 10 %). При эхокардиографическом исследовании вегетации обнаружены у 88 % больных. Аортальный клапан поражался наиболее часто (90 % больных). Поражение двух клапанов сердца выявлено у 42 % больных, трех клапанов – у 32 %.
Изменения мочевого осадка отмечены у 90,3 % больных. Гематурию наблюдали у 87 % больных, наиболее выраженную – у больных с вторичной формой ИЭ высокой степени активности. Согласно нашим ранее проведенным исследованиям, гематурия наблюдалась у 35–100 % больных ИЭ с поражением почек. Макрогематурия отмечена у 39,1 % больных. У 18 % больных ИЭ гематурия была проявлением очагового нефрита, у 67,9 % – диффузного гломерулонефрита (мезангиопролиферативного – 75 %, мезангиокапиллярного – 10 %, мембранозного – 15 %). Изолированная кратковременная болевая, часто рецидивирующая макрогематурия у 21,1 % больных ИЭ связана с ИП. У 18 % больных макрогематурия была проявлением гематурического варианта диффузного гломерулонефрита. Нередко изменения мочевого осадка, в частности микрогематурия, были обусловлены латентным, медленнопрогрессирующим хроническим гломерулонефритом. При диспансерном наблюдении у 13,8 % больных ИЭ периодически выявляли изменения мочевого осадка с микрогематурией, которые рассматривали как латентно протекающий гломерулонефрит [10, 25].
В анализируемой группе протеинурия выявлена у 50 % больных ИЭ, в сочетании с нефротическим синдромом – у 3,2 %. Лейкоцитурия отмечена у 55 % больных ИЭ, что несколько выше, чем в других исследованиях [14, 25, 26].
При ИЭ чаще встречаются очаговый, диффузный мезангиопролиферативный, мезангиокапиллярный, мембранозный, мембранознопролиферативный морфологические варианты ГН [10]. По данным S. Kannan, T.K. Mattoo (2001), наиболее частая гистопатологическая форма поражения почек при ИЭ –
диффузный пролиферативный и экссудативный, реже – ГН с полулуниями, сопровождающийся быстрым развитием ХПН [27].
Проведенный анализ 10 летальных случаев ИЭ с ПП показал, что у всех умерших больных развился ГН (мезангиокапиллярный – у 8, мезангиопролиферативный – у 2). Инфаркт почки выявлен у 6: в сочетании с мезангиокапиллярным ГН – у 4, мезангиопролиферативным – у 2 больных.
Почечная недостаточность относится к наиболее частым осложнениям и в 11–43 % случаев является дебютом ИЭ [9, 14, 26, 28–30]. Острая почечная недостаточность, по мнению некоторых авторов, – приоритетный независимый фактор
риска летального исхода ИЭ [7].
В нашей серии наблюдений ХПН развилась у 31 (33,3 %) больных подострым ИЭ с ПП: I ст. – у 7 (22,6 %), II ст. – у 8 (25 %), III ст. – у 16 (51,6 %) больных. Среди больных первичной формой ИЭ ХПН отмечена чаще (17,0–54,8 % больных, против 14,0–45,2 % при вторичной форме). Однако у больных
вторичной формой ИЭ ХПН протекала тяжелее: II ст. – у 3 (21,4 %), III ст. – у 11 (78,4 %) по сравнению с первичной формой ИЭ: I ст. – у 7 (41,2 %), II ст. – у 5 (29,4 %), III ст. – у 5 (29,4 %).
Инфаркт почки диагностируют у 5–17 % больных ИЭ на разных этапах заболевания, чаще – до начала антибактериальной терапии [13, 31, 32]. По нашим данным, при ультразвуковом исследовании у 10 % больных ИЭ с ПП обнаружены признаки ИП.
При ИЭ тромбоэмболии сосудов почки часто сочетаются с тромбогеморрагическими осложнениями другой локализации. У 43 (46,2 %) больных ИЭ ПП сочеталось с тяжелыми нарушениями гемостаза: инфаркт легких (61 %), инфаркт почки (44 %), тромбоз периферических сосудов (23 %), острое нарушение мозгового кровообращения (16,3 %), подкожные кровоизлияния (6,9 %), тромбоз мезентериальных сосудов (4,7 %). Такие сочетания имеют неблагоприятное прогностическое
значение при ИЭ.
Проведено исследование гемостаза для оценки его роли в развитии ПП при подостром ИЭ. Средние значения показателей гемостаза представлены в табл. 1 и 2, из которых видно, что с увеличением степени активности инфекционного процесса отмечается уменьшение количества тромбоцитов, повышение активности фактора фон Виллебранда, увеличение содержания РФМК и фибриногена в крови. Изменения агрегационной способности тромбоцитов и показателей АПТВ носят разнонаправленный характер.
Таблица 1. Результаты исследования сосудисто-тромбоцитарного гемостаза при подостром инфекционном эндокардите.
Таблица 2. Результаты исследования коагуляционного звена гемостаза и системы фибринолиза при подостром ИЭ.
Результаты корреляционного анализа свидетельствуют о наличии корреляционной связи (КС) между показателями гематурии и показателями сосудисто-тромбоцитарного, коагуляционного звеньев гемостаза при разных степенях активности подострого ИЭ с ПП.
Так, при исследовании выраженности гематурии и количества тромбоцитов крови определяется обратная слабая или умеренная достоверная КС: сила связи растет с увеличением активности инфекционного процесса, достигая максимума при III степени (I степень: r = -0,64, p < 0,05; II степень: r = -0,68, p < 0,001; III степень: r = -0,78, p < 0,001).
При сравнении выраженности гематурии и агрегационной активности тромбоцитов при I стерени активности ИЭ КС не выявлено. При II степени активности подострого ИЭ отмечена обратная слабая достоверная КС: с субпороговой дозой гемолизата (СДГ) – r = -0,67, p < 0,01; с максимальной дозой гемолизата (МДГ) – r = -0,68, p < 0,01. При III степени активности подострого течения ИЭ кривая гематурии имеет вид параболы (рис. 1). Это свидетельствует о том, что гипо- и гиперагрегации тромбоцитов сопровождаются гематурией. При наличии спонтанной агрегации и гиперагрегации тромбоцитов чаще наблюдается макрогематурия, обусловленная ИП. Так, у 9 больных ИЭ с ИП выявлена гематурия. Из них у 7 была III степень, у 2 больных – II степень активности ИЭ. Из семи больных у четверых наблюдалась спонтанная агрегация тромбоцитов, у двоих – гиперагрегация тромбоцитов, у одного – гипоагрегация тромбоцитов. При умеренной степени активности ИЭ
макрогематурия у одного больного сопровождалась гиперагрегацией тромбоцитов, у одного – спонтанной агрегацией тромбоцитов.
Оценка выраженности гематурии и фактора фон Виллебранда выявила прямую достоверную корреляционную связь, выраженность которой уменьшалась по мере роста активности инфекционного процесса, достигая минимума при III степени активности ИЭ (I степень активности: r = 0,81, p < 0,05; II
степень активности: r = 0,79, p < 0,001; III степень активности r = 0,68, p < 0,001). Это позволяет предположить уменьшение роли сосудистого компонента в развитии поражения почек при подостром ИЭ высокой степени активности.
Результаты корреляционного анализа показателей гематурии и АПТВ выявили прямую слабую достоверную корреляционную связь при III степени активности ИЭ (r = 0,53, p < 0,001). При II степени активности инфекционного процесса кривая гематурии имеет вид параболы (рис. 1). При I степени активности ИЭ отмечена обратная сильная достоверная корреляционная связь (r = -0,84, p < 0,05).
Корреляционный анализ выраженности гематурии и содержания РФМК обнаружил прямую нарастающую от умеренной до сильной достоверную корреляционную связь (при I степени активности ИЭ – r = 0,76, p < 0,05; при II степени – r = 0,81, p < 0,001; при III степени – r = 0,85, p < 0,001). Это свидетельствует об усилении системы фибринолиза при нарастании степени активности патологического процесса.
Рисунок 1. Данные корреляционного анализа показателей гемостаза и степени гематурии при подостром ИЭ.
Корреляционный анализ степени гематурии и уровня фибриногена крови выявил прямую умеренную и сильную достоверную корреляционную связь (при I степени активности ИЭ – r = 0,75, p = 0,05; при II степени – r = 0,87, p < 0,001; при III степени – r = 0,74, p < 0,001).
Корреляционный анализ других изменений мочевого осадка, встречающихся при ИЭ, таких как лейкоцитурия, протеинурия, с указанными выше показателями гемостаза достоверной корреляционную связь не обнаружил, за исключением таковой с сывороточным уровнем фибриногена. Так, корреляционный анализ лейкоцитурии и уровня фибриногена крови выявил прямую умеренную и сильную достоверную корреляционную связь (при I степени активности ИЭ – r = 0,70, p<0,05; при II
степени – r = 0,68, p < 0,001; при III степени – r = 0,80, p < 0,001). Корреляционный анализ протеинурии и уровня фибриногена крови выявил прямую умеренную недостоверную корреляционную связь при I степени активности ИЭ: r = 0,78, p > 0,05 и прямую сильную достоверную корреляционную связь при II и III степенях активности ИЭ: r = 0,83, p < 0,001 и r = 0,89, p < 0,001 соответственно.
Во II группе больных ИЭ без ПП (27 больных – 23 %) преобладала первичная форма болезни (22–81 %), I степень активности (16–59 %). Средние значения показателей гемостаза, варианты изменений агрегационной активности тромбоцитов и коагуляционного гемостаза у больных II группы представлены в таблицах 1–2, из которых видно, что в отсутствие поражения почек отмечаются менее выраженные изменения показателей гемостаза. Тяжелые нарушения гемостаза наблюдались у 5 больных II группы и клинически проявлялись тромбозами периферических сосудов.
Приводим клиническое наблюдение.
Больная Щ. 62 лет госпитализирована в клинику по экстренным показаниям с жалобами на одышку, лихорадку до 39 °С. В возрасте 45 лет проведена операция протезирования митрального клапана по поводу ревматического митрального стеноза. При осмотре состояние тяжелое. Кожные покровы
бледные, температура – 38,4 °С. В легких в проекции нижней доли правого легкого отмечается притупление перкуторного звука, над той же областью выслушиваются влажные разнокалиберные хрипы. Частота дыхательных движений – 26 в минуту. Границы сердца расширены влево до передней подмышечной линии. Тоны сердца приглушены, ритмичные; систоло-диастолический шум на верхушке. ЧСС – 102 в минуту, АД = 110/60 мм рт. ст. Размеры печени 16 × 12 × 9 см, селезенки 12 × 6 см. Кровь: лейкоциты 16 × 109/л, э – 1 %, п – 5 %, с – 80 %, л – 12 %, м – 2 %; тромбоциты 130 × 109/л, СОЭ – 52 мм/ч. Трехкратный посев крови на стерильность дал рост S. epidermidis. Гемостаз: гиперагрегация тромбоцитов, гиперкоагуляция, ФВ –240 %, АПТВ – 48 с, РФМК 17 × 10-2 г/л, фибриноген – 6,1 г/л.
Моча: протеинурия (0,165 г/л), макро-, микрогематурия, лейкоцитурия. Рентгенограмма органов грудной клетки: очаг затемнения в нижней доли правого легкого, застой по малому кругу кровообращения II cтепени. Трансторакальная ЭхоКГ: рыхлые, подвижные вегетации на створках аортального и трикуспидального клапанов, параанулярный абсцесс митрального клапана, расширение полостей левых предсердия и желудочка. УЗИ органов брюшной полости: гепатоспленомегалия. Несмотря на проведенную терапию антибиотиками, антиагрегантами, антикоагулянтами, состояние больной ухудшалось: сохранялась субфебрильная температура, усилилась одышка, появилась макрогематурия, сопровождавшаяся болью в поясничной области, произошел инсульт в бассейне средней мозговой артерии. Заключительный клинический диагноз: ВИЭ с поражением митрального, аортального, трикуспидального клапанов, подострое течение III степени активности. ХСН II ст. Массивный тромбогеморрагический синдром: ишемический инсульт в бассейне средней мозговой артерии, правосторонняя нижнедолевая инфаркт-пневмония, инфаркт почки (рис. 2 и 3). При патологоанатомическом исследовании диагноз подтвердился.

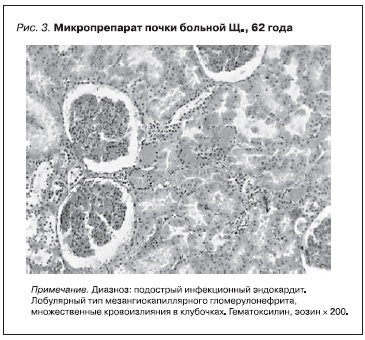
Приведенное наблюдение показывает, что течение подострого ИЭ осложнилось развитием массивного тромбогеморрагического синдрома с развитием инфарктов в жизненно важных органах: головном мозге, легких, почках. Поражение почек сопровождалось изменением мочевого осадка с макро-,
микрогематурией и выраженными нарушениями во всех звеньях гемостаза.
Таким образом, поражение почек при подостром ИЭ характеризуется развитием мочевого синдрома с умеренно выраженной гематурией, лейкоцитурией, протеинурией. Почечная недостаточность – частое осложнение подострого ИЭ. Наиболее распространенный морфологический вариант ГН при ИЭ – мезангиокапиллярный. При подостром ИЭ с поражением почек отмечаются более выраженные нарушения во всех звеньях гемостаза, что подтверждается данными лабораторных методов исследования. Степень нарушений в системе гемостаза коррелирует с выраженностью изменений мочевого осадка. С нарастанием степени активности уменьшается роль сосудистого компонента и увеличивается значение коагуляционного звена гемостаза в развитии поражения почек
при подостром ИЭ.



