В последние годы значительно возрос интерес к поиску “мочевых” биомаркеров, количественное определение которых позволяет мониторировать выраженность структурно-функциональных нарушений в нефроне. К одним из таких показателей относится синтезируемый подоцитами белок нефрин. По современным представлениям, основным барьером гломерулярного фильтра для попадания плазменных белков в мочу являются подоциты и межподоцитарная щелевая диафрагма [1]. После повреждения различными факторами (гемодинамическими, медиаторами воспаления) подоциты подвергаются структурно-функциональным изменениям (т. н. подоцитопатия) с появлением в моче как целых клеток (феномен подоцитурии), так и специфических подоцитарных маркеров. Среди подоцитарных белков большое значение в поддержании целостности гломерулярного барьера имеет нефрин. С одной стороны, он участвует в связывании с актиновым цитокелетом подоцитов, с другой стороны, через взаимодействие экстрацеллюлярных доменов между собой – в формировании межподоцитарной щелевой диафрагмы [2]. В эксперименте на животных моделях и при изучении биоптатов почек человека было показано, что уменьшение экспрессии нефрина в щелевой диафрагме отмечается не только в случае мутации гена NPHS1 при врожденном НС финского типа, но и при различных приобретенных заболеваниях почек – диабетической нефропатии, гипертоническом нефроангиосклерозе, ХГН [3–5]. Обсуждается, что появление очаговых дефектов щелевой диафрагмы вследствие отщепления нефрина от клеточного цитоскелета подоцитов с последующим попаданием его в мочу является одним из механизмов развития протеинурии (ПУ) при ряде нефропатий [6].
В настоящее время появились различные методы определения нефрина в моче (иммуноблоттинг, иммуноферментный анализ, ПЦР), однако имеются лишь немногочисленные клинические работы этого направления, большинство из которых выполнено на больных сахарным диабетом, и единичные исследования – у больных хроническим гломерулонефритом (ХГН) [7]. Значение этого мочевого показателя у больных протеинурическими формами ХГН остается до конца неясным.
Цель исследования – определить выраженность нефринурии (НУ) как показателя тяжести структурно-
функциональных нарушений гломерулярного фильтра у больных протеинурическими формами ХГН и уточнить значение этого теста для оценки активности и прогноза ХГН.
Материал и методы
Обследованы 74 больных различными формами ХГН: 37 (50 %) женщин и 37 (50 %) мужчин в возрасте от 18 до 74 лет (средний возраст – 39,0 ± 14,6 года). Контрольную группу составили 10 здоровых лиц, сопоставимых по полу и возрасту с обследованными пациентами. Морфологически диагноз был подтвержден у 33 больных (у 12 выявлен мезангиопролиферативный ГН, у 6 – мезангиокапиллярный ГН, у 8 – мембранозная нефропатия, у 2 – фокальный сегментарный гломерулосклероз (ФСГС), у
5 – нефросклероз).
Результаты исследования НУ сравнивали в трех группах больных ХГН. Группу I составили 18 пациентов
с неактивным течением заболевания: 6 – латентным ХГН, 7 – ХГН гематурического типа вне обострения, 5 – с полной ремиссией ХГН нефротического типа после успешной иммуносупрессивной терапии. У больных этой группы выявлена ПУ до 1 г/сут (0,2 [0,06–0,60] г/сут), у 3 из них – изолированная, у остальных – в сочетании с эритроцитурией. Функция почек у 10 больных была в
пределах нормы, у 8 отмечены признаки хронической почечной недостаточности – стойкое снижение скорости клубочковой фильтрации (СКФ) (47 [34–50] мл/мин) и повышение креатинина сыворотки крови (1,7 [1,3–2,4] мг/дл). Артериальная гипертензия (от 150/ 90 до 170/100 мм рт. ст.) наблюдалась у 8 пациентов.
Во II группу включены 18 больных с выраженным МС: 16 больных, у которых ХГН изначально протекал с выраженным МС и персистировал в течение 15 (8–24) месяцев, а также двое больных, у которых МС
был результатом неполной ремиссии нефротического синдрома (НС) в течение 7–24 месяцев. Клинически эта группа больных характеризовалась ПУ до 3,0 (1,75 [1,20–2,08]) г/сут; у 5 пациентов выявлена изолированная ПУ субнефротического уровня, у 13 – ПУ сочеталась с умеренной эритроцитурией. Функция почек у 9 больных этой группы была в пределах нормы (СКФ – 84 [67–110] мл/мин, креатинин – 1,1 [0,8–1,3] мг/дл). У 9 больных отмечено стойкое нарушение функции почек (СКФ – 38 [30;48] мл/мин, креатинин – 2,3 [1,85–2,63] мг/дл). Артериальная гипертония (от 150/90 до 220/120 мм рт. ст.) выявлена у 9 больных.
В III группу вошли 38 больных с НС – отеками различной степени и локализации, ПУ до 18 (4,55 [2,9–6,3]) г/сут, гипоальбуминемией (2,86 [2,3–3,4] г/дл). У 9 пациентов активность гломерулонефрита была наиболее высокой, что проявилось сочетанием НС и остронефритического синдрома (ОНС) (с артериальной гипертензией, эритроцитурией и преходящей почечной недостаточностью (креатинин сыворотки крови – от 1,5 до 2,7 (2,28 [1,86–2,42]) мг/дл, в т. ч. быстропрогрессирующей у 1 больного). У 6 больных III группы наряду с сохраняющейся активностью ХГН (ПУ –4,7 [3–5,6] г/сут) отмечено уже стойкое нарушение функции почек (СКФ – 22 [16–40] мл/мин, креатинин – 3,35 [2,7–4,0] мг/дл), высокая артериальная гипертензия (максимально до 220/100 мм рт. ст.), а при морфологическом исследовании ткани почки выявлен значительный фиброз.
У 23 больных активным ХГН с НС в зависимости от уровня НУ был оценен ответ на проводимую в дальнейшем (от 6 месяцев до 2 лет) иммуносупрессивную терапию: преднизолон (ПЗ) per os, в т. ч. в сочетании с “пульсами” ПЗ и циклофосфана внутривенно, циклоспорин А, микофенолат мофетил per os. Полной ремиссией НС считалось уменьшение ПУ ниже 0,3 г/сут со стабильной функцией почек, частичной ремиссией – уменьшение ПУ на 50 % и более от исходной при стабильной функции
почек, нормальные показатели альбумина и общего белка сыворотки крови.
Уровень экскреции нефрина с мочой исследовали методом непрямого иммуноферментного анализа (ELISA): 10 мл утренней мочи собирали в сухие пластиковые пробирки и центрифугировали (при 3000 об./мин) в течение 15 минут при комнатной температуре. Надосадочную часть мочи замораживали при температуре -20 ºС. Для определения уровня нефрина в моче больных ХГН использовали систему Uscnc Life Science Inc. Wuhan, ELISA Kit for human nephrin, China. В лунки, покрытые первичными конъюгированными с биотином поликлональными антителами к нефрину человека, добавляли по 100 μl размороженных образцов мочи и инкубировали 2 часа при температуре 37 ºС. После первой инкубации в лунки вносили по 100 μl стрептавидин-пероксидазы, конъюгированной с авидином для образования иммуноферментного комплекса, затем добавляли стабилизированный хромогенный субстрат (TMB) (инкубация – 30 минут). Интенсивность окраски в каждой лунке измерялась при длине волны спектрофотометра 450 нм. После определения величины оптической плотности стандартных растворов с известной концентрацией нефрина его уровень в исследуемых образцах мочи больных ХГН рассчитан путем построения калибровочной логарифмической кривой с помощью программы
STATISTICA 6,0.
Статистический анализ данных проведен с применением стандартных статистических методик с помощью программы STATISTICA 6,0. Для сравнения двух групп использован непараметрический критерий Манна–Уитни. Различия в частоте биноминального признака оценены по критерию Фишера. Корреляционный анализ проведен методом ранговой корреляции Спирмена. Для оценки эффективности иммуносупрессивной терапии у больных с различными показателями НУ применен метод Каплан–Майер, достоверность различий оценена по критерию Гехана и лог-ранговому критерию, для разных уровней НУ рассчитывано отношение шансов по достижению
ремиссии.
Результаты
Показатели экскреции нефрина с мочой у больных ХГН характеризовались высокой вариабельностью – от 0,5 до 58,0 нг/мл. Средние уровни НУ в группах больных активными протеинурическими формами ХГН (II, III группы) были выше, чем при латентном течении заболевания (I группа) и у здоровых. У больных с НС (III группа) он значимо превышал таковой у пациентов с менее выраженной ПУ (II группа) (табл. 1).
Таблица 1. Уровень нефринурии у больных хроническим гломерулонефритом.
Таблица 2. Клиническая характеристика больных ХГН с НС в подгруппах с различной степенью нефроинурии (n = 38).
Установлена прямая достоверная корреляция (Rs = 0,27, p < 0,05) между показателем НУ и величиной суточной ПУ у больных II и III групп ХГН. По нашим данным, влияние на показатель экскреции нефрина с мочой у больных ХГН оказывает артериальная гипертензия. Так, у больных с активным течением ХГН (как во II, так в III группах) при наличии повышенного артериального давления НУ была значимо выше (16,1 [12,5–27,8] нг/мл), чем у пациентов с нормальным артериальным давлением (10 [8,4–14,6] нг/мл), p < 0,01. Выявлена прямая корреляция между показателем НУ и цифрами среднего артериального давления (II и III группы, Rs = 0,3, p = 0,032). Та же закономерность выявлена и у больных с латентным течением ХГН: при одинаково низкой ПУ показатель НУ был достоверно выше у больных с артериальной гипертензией по сравнению с пациентами без нее (9,3 [7,7–11,0] и 6,0 [1,2–6,8] нг/мл
соответственно, р < 0,01).
При рассмотрении уровня нефрина в моче больных активным ХГН с уже стойким нарушением функции почек (у 9 – II и у 6 – III групп) значимых различий отмечено не было (12,5 [8,4–16,1] нг/мл) по этому показателю при сравнении с больными с сохранной функцией почек (у 9 – II, и у 23 – III групп) (14,0 [9,1–20,7] нг/мл, p = 0,41).
Мы более детально проанализировали экскрецию нефрина с мочой у больных с НС – в группе с клинически наиболее выраженным повреждением гломерулярного фильтра. Показатели НУ у данной категории пациентов, как и в общей группе больных ХГН, характеризовались высокой вариабельностью. Для определения основных закономерностей, влияющих на величину НУ, был выбран
дискриминационный уровень – 17 нг/мл, превышающий медиану в этой группе больных. У 19 из 38 (50 %) больных с НС отмечены высокие значения экскреции нефрина – более 17 нг/мл (подгруппа III А). У другой половины больных уровень НУ был менее 17 нг/мл (подгруппа III Б). При одинаковой в обеих подгруппах степени выраженности ПУ и НС среди пациентов с НУ > 17 нг/мл чаще отмечалось активное прогрессирующее течение нефрита (в эту подгруппу вошли 7 из 9 больных ХГН с сочетанием НС и ОНС, НС и быстропрогрессирующей ПН), НС характеризовался большей длительностью (в подгруппе Б – 5 месяцев, в подгруппе А – в 2 раза дольше, в среднем – около года до момента исследования; p < 0,01) (табл. 2).
Мы не выявили зависимости величины НУ от морфологической формы ХГН, но наиболее высокие в
нашем исследовании показатели отмечены у 3 больных с мембранозной нефропатией (49,0; 51,2; 56,7 нг/мл) и у 1 с мезангиокапиллярным ГН (51 нг/мл). Мы оценили экскрецию нефрина с мочой в зависимости от наличия и распространенности склеротических изменений в клубочках почек. Так, не отмечено достоверного уменьшения НУ у больных клинически активным ХГН с выявленными в биоптатах почки признаками фибропластической трансформации клубочков (U = 88,5, p = 0,68), а также достоверной корреляции между уровнем нефрина в моче и процентом полностью склерозированных клубочков (Rs = -0,32, р = 0,13). Сохранение высокой НУ у пациентов со склеротическими изменениями клубочков, по-видимому, отражает активное поражение еще сохранившихся подоцитов (что также находит подтверждение в персистирующей у данных больных высокой ПУ) и может рассматриваться как дополнительный аргумент в пользу активной терапии данных больных.
Для оценки уровня НУ как показателя прогноза ХГН мы проанализировали ответ на последующую иммуносупрессивную терапию 23 больных с НС с исходно разным уровнем НУ (11 больных – с показателем нефрина в моче <17 нг/мл и 12 – с НУ > 17 нг/мл). У 9 из 11 (82 %) больных с
низкой (< 17 нг/мл) экскрецией нефрина с мочой ремиссия НС была достигнута в течение полугода лечения, причем у 5 больных этой подгруппы НС купирован достаточно быстро – в течение 4 месяцев (рис. 1).
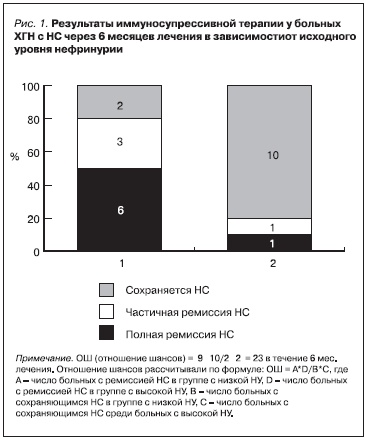
В то же время среди 12 пациентов с высокими (> 17 нг/мл) показателями НУ только у 2 к 6 месяцам лечения наступила частичная ремиссия НС (рис. 1), еще у 2 больных удалось купировать НС в результате более длительной иммуносупрессивной терапии (в течение 10 и 27 месяцев) (рис. 2). У 8 из 12 (67 %) больных с высокой НУ не был получен ответ на адекватную терапию различными
иммуносупрессивными препаратами (включая введение сверхвысоких доз преднизолона и циклофосфана, лечение циклоспорином и микофенолата мофетилом), проведенную в течение длительного срока – от 9 месяцев до 2,5 лет (рис. 2).
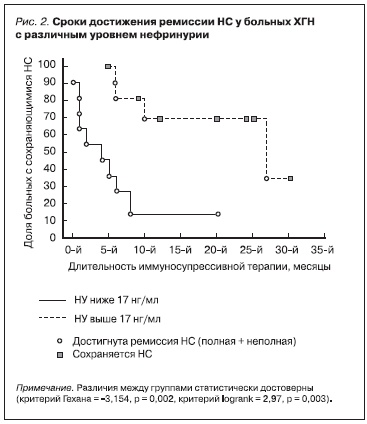
Таким образом, у больных с НС уровень нефрина в моче позволяет прогнозировать ответ на дальнейшее лечение иммуносупрессивными препаратами. Рассчитав отношение шансов, мы показали, что в отсутствие эффекта иммуносупрессивной терапии через 6 месяцев у больных с НУ > 17 нг/мл шансы достичь ремиссии НС в дальнейшем снижаются в 7 раз. Напротив, у больных с НУ < 17нг/мл
вероятность достижения ремиссии НС в течение первых 6 месяцев лечения очень высока – в 23 раза выше, чем у больных с высоким ее уровнем (отношение шансов = 22,5, p < 0,05).
Обсуждение
В последние десятилетия активно изучаются механизмы избирательной проницаемости гломерулярного фильтра для различных белков плазмы. Существенное значение в этих процессах придают подоцитам и подоцит-ассоциированным молекулам щелевой диафрагмы [1]. Выполняя важную роль в поддержании структуры и функции почечного клубочка в норме, подоциты имеют первостепенное значение при повреждении клубочка и прогрессировании почечного заболевания. Своеобразной “платформой” передачи сигналов, необходимых для поддержания функций подоцитов (правильной организации цитоскелета, поляризации, эндоцитоза, дифференцировки, ограничения пролиферации и жизнеспособности клетки в целом), служит межподоцитарная щелевая диафрагма [8, 9] .
В настоящее время установлено, что изменение структуры и функции подоцита (подоцитопатия), ранее считавшееся специфическим признаком болезни минимальных изменений, встречается при различных нефропатиях: гломерулонефрите, гипертонии, диабетической нефропатии, а также при всех формах НС (врожденного и приобретенного) [10]. Повреждение подоцитов приводит к нарушению синтеза подоцитарных адгезивных белков, отделению этих клеток от гломерулярной базальной мембраны и в конечном счете – к подоцитурии. Изменение экспрессии белков щелевой диафрагмы при всех протеинурических нефропатиях является стереотипной реакцией подоцита на
повреждение [11], поэтому уровень экскреции нефрина с мочой можно рассматривать в качестве маркера активного повреждения межподоцитарной щелевой диафрагмы и выраженности подоцитурии.
Благодаря экспериментальным исследованиям последних лет было показано, что повышение экскреции нефрина с мочой вследствие повреждения подоцитов и тесно связанной с ними щелевой диафрагмы происходит под влиянием антител, иммунных комплексов, конечных компонентов активации комплемента (мембранно-атакующего комплекса) и провоспалительных цитокинов [12].
Например, в экспериментальной модели мембранозной нефропатии (Хеймановский нефрит) внедрение в мембрану подоцитов компонентов комплемента (С5в-9) приводит к повреждению его актинового цитоскелета (F-актина) с отщеплением экстрацеллюлярной части молекулы нефрина и экскреции ее с мочой [4, 13]. При этом в ткани почки при электронной иммуномикроскопии еще до развития ПУ отчетливо визуализируются фокусы деструкции щелевой диафрагмы, соответствующие участкам сглаженных отростков подоцитов и сниженной экспрессии нефрина. В более поздний период при развитии массивной ПУ количество этих дефектов резко возрастает, причем они характеризуются неравномерным распределением и чередуются с абсолютно сохранными областями щелевой диафрагмы [14]. Таким образом, в основе развития ПУ лежит повреждение белков щелевой диафрагмы, в первую очередь нефрина, и нарушение гломерулярного фильтра в ходе активного иммунного воспаления в клубочке.
В проведенном нами исследовании уровень экскреции нефрина с мочой был достоверно выше у больных с активным течением гломерулонефрита, чем у больных с неактивным нефритом. Высокие показатели НУ отмечены у больных с НС. Нами замечена корреляция между НУ и ПУ больных активным гломерулонефритом, причем значение имели активность воспаления в клубочке и повреждения гломерулярного фильтра на момент исследования. Подтверждением тому служат и низкие значения НУ у больных ХГН с минимальной ПУ до 1 г/сут, сопоставимые с этим показателем у здоровых лиц. В работе S. Doublier et al. (2001) у больных IgA-нефропатией с минимальной ПУ не было отмечено снижения экспрессии нефрина также и в ткани почки [12].
В то же время у больных НС значения НУ варьировались. Мы установили, что для развития высокой НУ у этих больных большое значение имела длительность НС, при этом персистирующее активное воспаление в клубочках почки приводит к пролонгированному повреждению и создает условия для вовлечения все большего числа подоцитов с развитием массивной НУ.
По нашим данным, повышение артериального давления независимо от активности нефрита и выраженности ПУ приводило к увеличению экскреции нефрина с мочой больных ХГН. Дополнительное повреждающее воздействие системной артериальной гипертензии, а также внутриклубочкового давления на подоциты и экспрессию генов белков щелевой диафрагмы, в т. ч. нефрина, было продемонстрировано во многих исследованиях при диабетической нефропатии и гипертоническом нефроангиосклерозе [15, 16]. Установлено, что внутриклубочковая гипертензия может приводить к механическому растяжению подоцитов, повреждать комплекс адгезивных белков, закрепляющих
подоциты на БМК и разрушать компоненты щелевой диафрагмы [17]. Кроме того, на поверхности подоцитов обнаружены рецепторы к ангиотензину I и II типов, и введение ангиотензина в эксперименте у крыс помимо развития артериальной гипертензии сопровождалось апоптозом подоцитов, а также уменьшением экспрессии нефрина [18]. Введение крысам другого компонента
ренин-ангиотензиновой системы (РААС) – альдостерона – также вызывало подоцитарное повреждение и снижение экспрессии нефрина, как полагают, за счет усиления окислительных процессов и активации фосфорилирования белков [19]. Следовательно, наряду с факторами воспаления значительное повреждающее воздействие на подоциты может оказывать активированная, в т. ч.
локальная внутрипочечная РААС.
Наиболее высокие значения НУ в нашем исследовании отмечены у больных с тяжелым прогрессирующим течением нефрита – сочетанием НС и ОНС, быстропрогрессирующей почечной недостаточностью, т. е. яркими клиническими проявлениями активного иммунного воспаления, приводящего к распространенному повреждению подоцитов и щелевой диафрагмы. Механизмы
повреждения актинового цитоскелета подоцитов под действием провоспалительных факторов в настоящее время уточняются. Предполагают, что повреждение подоцита различными факторами воспаления сопровождается дефицитом аденозинтрифосфата (АТФ) в клетке, дефосфорилированием адгезивных белков и агрегацией (или распадом) актиновых микрофиламентов цитоскелета [20]. Еще одной причиной, приводящей к повреждению подоцита в условиях дефицита АТФ, является первичная патология его актинового цитоскелета, обусловленная генетическими особенностями [21]. И в нашем исследовании у больных с высокой НУ, резистентных к лечению иммуносупрессивными препаратами, наряду с воздействием воспалительных медиаторов можно предположить влияние и генетических факторов, способствующих повышению чувствительности подоцита к повреждению.
Нарушение фосфорилирования самой молекулы нефрина, например, при дефиците фактора самозащиты почки – эндотелиального сосудистого фактора роста (VEGF), участвующего в регуляции функции эндотелиального слоя гломерулярного барьера, ослабляет связывание нефрина с подоцином, приводит к отщеплению экстрацеллюлярной части молекулы нефрина от мембраны подоцита и
повышению экскреции этого белка с мочой. Повреждение эндотелия и подоцитов со снижением экспрессии белков щелевой диафрагмы и возникновением ПУ при дефиците VEGF было впервые показано у женщин с преэклампсией [22]. Однако в последних экспериментальных исследованиях A. Hara et al. (2006) продемонстрировали, что создание дефицита VEGF путем блокирования гена у
здоровых крыс приводит к развитию артериальной гипертонии и умеренной ПУ, а при анти-БМК-нефрите – к более тяжелому его течению с массивной ПУ вследствие повреждения подоцитов и нефрина [23]. В проведенных нами ранее работах уровень VEGF, экскретируемого с мочой, был значительно снижен у больных с тяжелыми прогрессирующими формами нефрита: с высокой ПУ,
артериальной гипертензией и нарушением функции почек, в т. ч. при быстропрогрессирующем гломерулонефрите [24]. Выявленные в настоящем исследовании высокие показатели НУ в сопоставимой группе больных позволяют предполагать, что нарушение механизмов самозащиты почки с дефицитом VEGF могут приводить к дополнительному повреждению эндотелия, подоцитов и нефрина и более тяжелому течению нефрита.
Мы не выявили достоверного снижения НУ у больных с более поздней стадией ХГН: стойкой почечной недостаточностью и наличием распространенных склеротических изменений в ткани почки. Это может быть связано с сохранением у этих больных клинико-лабораторных признаков активности ХГН, свидетельствующих о продолжающемся активном воспалении и дальнейшем прогрессировании подоцитопатии, несмотря на выраженный фиброз в ткани почки.
Уровень экскреции нефрина с мочой был также сопоставим и при различных морфологических формах
нефрита. Полученные результаты согласуются с данными литературы об уменьшении его экспрессии в ткани почки независимо от морфологической формы – при минимальных изменениях, ФСГС, мембранозной нефропатии, МКГН, МПГН, диабетической нефропатии, а также при волчаночном нефрите [11, 12, 25, 26]. Вместе с тем в нашем исследовании у больных с мембранозной нефропатией
(МН) отмечены самые высокие показатели НУ. Возможно, накапливающиеся при МН субэпителиальные депозиты иммунных комплексов оказывают дополнительное повреждающее воздействие на подоциты [11].
По данным все большего числа экспериментальных и клинических исследований критическое снижение количества подоцитов (подоцитопения) в клубочках является основным фактором прогрессирования гломерулосклероза и снижения клубочковой фильтрации [27, 28]. Поскольку подоциты являются высокодифференцированными клетками с ограниченным пролиферативным потенциалом, уменьшение числа подоцитов приводит к необратимому дефекту гломерулярного фильтра, способствует формированию синехий между капиллярными петлями и Боуменовой капсулой клубочка, является пусковым механизмом для начала склерозирования клубочков.
Так, мы установили, что у большинства больных с высокой НУ подавление активного воспаления в ткани почки с помощью адекватной иммуносупрессивной терапии не привело к исчезновению НС и восстановлению барьерной функции гломерулярного фильтра. Следовательно, высокая НУ, особенно у больных с длительно персистирующим НС, с указанием на повреждение подоцитов, массивную
подоцитурию, тяжелый дефект гломерулярного барьера является неблагоприятным прогностическим признаком, в т. ч. в отношении эффективности дальнейшей иммуносупрессивной терапии. Поэтому выявление признаков декомпенсированной подоцитопатии по мочевым тестам (в частности, по уровню НУ) очень важно с клинических позиций для мониторирования течения, оценки прогноза, определения эффективности иммуносупрессивной терапии и выбора тактики лечения ХГН.



