Анемия наблюдается у подавляющего большинства больных с хронической почечной недостаточностью (ХПН). Главной причиной ее развития считается недостаточная продукция эндогенного эритропоэтина (ЭПО) сморщенными почками. Кроме того, вклад в возникновение анемии вносят дефицит железа, фолатов и витамина В12, желудочно-кишечные кровотечения, тяжелый гиперпаратиреоз, хроническое воспаление, укорочение продолжительности жизни эритроцитов. Повышение уровня паратгормона и воспаление подавляют эритропоэз в костном мозге [2]. Средняя продолжительность жизни эритроцитов при уремии вдвое короче, чем при нормальной функции почек, и составляет 60 дней [22].
До конца 1980-х гг. коррекция анемии у больных на диализе была возможной только за счет частых гемотрансфузий, которые сопровождались высоким риском инфицирования (гепатиты, ВИЧ-инфекция и т. п.), и иммунизации пациентов. Благодаря появлению (1985 г.) и внедрению в практику (лицензированы в 1988 г.) препаратов рекомбинантного человеческого эритропоэтина практически полностью удалось отказаться от переливаний крови в качестве долговременного метода коррекции анемии у больных с ХПН. Препараты рчЭПО I поколения отличаются коротким периодом полувыведения, что диктует необходимость их частого введения – как правило, 3 раза в неделю. Не вызывает сомнений удобство применения короткодействующих препаратов у больных на гемодиализе, в то время как у больных в преддиализной стадии ХПН и у больных на перитонеальном диализе это связано с рядом трудностей, обусловленных необходимостью частого посещения лечебного учреждения для получения препарата рчЭПО.
Следующим этапом в создании стимулирующих эритропоэз лекарственных средств стала разработка рчЭПО II поколения – дарбэпоэтина альфа (зарегистрирован в Европе для применения в нефрологии в 2001 г.). В этом препарате к молекуле рчЭПО были дополнительно присоединены 2 углеводородные
цепи с увеличением остатков сиаловых кислот с 14 до 22. Подобное изменение молекулы привело к увеличению периода полувыведения при в/в введении в 3 раза (25,3 часа), а при подкожном – в 2 раза (48 часов). Внедрение дарбэпоэтина позволило удлинить интервалы между введением препарата до
2 недель без потери эффективности препарата. С 2005 г. стала доступной новая генерация препаратов рчЭПО III поколения с длительной активацией рецепторов эритропоэтина, первым
представителем которых является метоксиполиэтиленгликольэпоэтин бета.
CERA был получен в результате присоединения к молекуле эпоэтина бета большой молекулы метоксиполиэтиленгликоля (молекулярная масса – 30 кДа), что привело к увеличению массы вещества вдвое – до 60 кДа [17, 19]. По сравнению с эпоэтином у CERA в 50–100 раз меньше сродство к эритропоэтиновым рецепторам, главным образом за счет непрочного соединения с ними [11]. CERA, стимулируя эритропоэтиновые рецепторы, не вызывает их интернализации, что обусловливает возможность их повторной стимуляции. В результате этих особых свойств CERA имеет длительный период полувыведения, составляющий около 130 часов [18]. Путь введения CERA практически не оказывает влияния на скорость его элиминации, и период полувыведения при подкожном и внутривенном введении примерно равен (139 и 134 часа соответственно).
За последние 5–6 лет были проведены широкомасштабные исследования по применению CERA у больных на диализе (на перитонеальном и гемодиализе). Исследование AMICUS было посвящено оценке возможности коррекции анемии у диализных больных, не получавших ранее терапии препаратами рчЭПО, при помощи CERA 1 раз в 2 недели в/в. Это исследование было открытым многоцентровым и рандомизированным в параллельных группах. В него был включен 181 пациент. Их рандомизировали в соотношении 3 : 1 (по группам, получавшим CERA 1 раз в 2 недели и эпоэтин 3 раза в неделю). Эффективность терапии была зарегистрирована в обеих группах: 93,3 % – у больных, получавших CERA, и 91,3 % – у больных, получавших эпоэтин. Средний уровень гемоглобина в группах CERA и эпоэтина к концу периода коррекции составил соответственно 12,0 ± 1,11 и 12,1 ± 1,35 г/дл. Среди получавших CERA было меньше лиц с превышением установленного верхнего уровня Hb (13 г/дл) в первые 8 недель лечения (8,2 и 17,4 % соответственно). Число нежелательных явлений статистически не различалось в обеих группах за весь период наблюдения [12]. Результаты данного исследования свидетельствуют об эффективности и безопасности применения CERA 1 раз в 2 недели в фазе коррекции анемии.
Логичным было проведение следующего многоцентрового (92 центра) открытого контролируемого и рандомизированного исследования эффективности применения CERA для обеспечения стабильного уровня гемоглобина у больных на диализе при прямой конверсии с эпоэтинов короткого действия (PROTOS). 572 пациента, получавших стабильные дозы эпоэтина от 1 до 3 раз в неделю, были рандомизированы в 3 группы (1 : 1 : 1): 1-я группа продолжила лечение CERA п/к 1 раз в 2 недели,
2-я – CERA п/к 1 раз в месяц, 3-я группа – лечение эпоэтинами короткого действия. Целью исследования было поддержание уровня гемоглобина в пределах ±1 г/дл от исходного уровня. Доля пациентов со стабильным уровнем гемоглобина в пределах 10–13 г/дл составила 91,5 % на CERA 1 раз в 2 недели; 88,1 % пациентов на CERA 1 раз в месяц и 88,1 % на эпоэтине. Средние значения уровня Hb в группах во время оценочного периода были схожими (CERA 1 раз в месяц – 11,5 г/дл; CERA 2 раза в месяц –11,7 г/дл; эпоэтин – 11,5 г/дл). Анализ данного исследования показал, что применение CERA п/к 1 или 2 раза в месяц успешно поддерживает стабильные уровни Hb после прямой конверсии с терапии эпоэтинами при низкой частоте нежелательных явлений [26].
Аналогичное исследование RUBRA у больных на диализе (n = 336), выполненное в 2 параллельных группах (1 : 1), было также посвящено изучению эффективности применения CERA 1 раз в 2 неделю при прямой конверсии с эпоэтинов альфа и бета 1–3 раза в неделю. Среднее изменение уровня Hb в группе CERA и эпоэтинов составило 0,088 и -0,030 г/дл, конечный Hb – 11,93 и 11,86 г/дл соответственно. Было сделано заключение об успешном применении CERA в режиме 1 раз в 2 недели
для поддержания стабильного уровня гемоглобина [25].
Еще одно многоцентровое (96 центров) открытое рандомизированное исследование поддерживающей терапии анемии у больных на диализе было посвящено изучению эффективности
в/в введения CERA (MAXIMA). В исследование были рандомизированы 673 пациента, выделены 3 группы в соотношении 1 : 1 : 1, получавшие терапию CERA 1 раз в 2 недели в/в; 1 раз в 4 недели в/в или эпоэтином альфа (бета) в прежней дозе 3 раза в неделю. Исходная средняя концентрация Hb не различалась между группами. Анализ показал, что средние концентрации Hb у пациентов, получавших CERA1 раз в 2 и 4 недели, после непосредственного перевода с терапии эпоэтином у 86 % остаются стабильными. Таким образом, была доказана эффективность редкого (1 раз в 4 недели) в/в введения CERA для лечения анемии [14].
Были проведены исследования и по изучению эффективности CERA в сравнении с препаратами рчЭПО II поколения (дарбэпоэтином альфа). В исследовании STRIATA сравнивались 2 группы больных на диализе: 1-я группа (n = 156) получала в/в дарбэпоэтин альфа (ДА) 1 раз в 1–2 недели; 2-я группа
(n = 157) – в/в CERA 1 раз в 2 недели [4]. Средний уровень гемоглобина во время периода оценки был 12 г/дл для CERA и 11,8 г/дл для ДА. Было сделано заключение, что эффективность CERA (1 раз в 2 недели) не уступает таковой у ДА (1 раз в 1–2 недели).
В следующем исследовании (PATRONUS) изучалась возможность поддерживающей терапии анемии у больных, получавших гемодиализ, с помощью CERA 1 раз в месяц в сравнении с ДА [25]. В исследовании участвовали 490 стабильных больных, леченных гемодиализом не менее 16 недель до рандомизации,
со стабильным уровнем гемоглобина и нормальным уровнем железа. Согласно протоколу, все больные первые 4 недели получали терапию ДА, затем были рандомизированы в 2 равные по численности группы: 1-я группа продолжала получать ДА 1 раз в месяц, 2-я группа была переведена на лечение
CERA в режиме 1 раз в месяц. Анализ результатов показал, что повышение дозы препарата потребовалось 6,8 % пациентов из группы CERA, и 58,8 % пациентов с ДА. Несмотря на такое увеличение дозы ДА, эффективность терапии CERA для поддержания целевого Hb была выше по сравнению с ДА при введении препаратов 1 раз в месяц.
Завершая краткий обзор проведенных клинических исследований по применению CERA у больных, получающих диализ, необходимо отметить, что во всех исследованиях по применению данного препарата (n = 2737) был показан сравнимый уровень безопасности применения CERA с другими препаратами рчЭПО [16].
Цель нашего исследования – оценка эффективности, безопасности и переносимости CERA при внутривенном введении 1 раз в месяц для поддержания стабильного уровня гемоглобина у пациентов с хронической почечной анемией на программном гемодиализе, ранее получавших терапию препаратами рчЭПО I поколения (Эпокрин, Рекормон).
Материал и методы
В проспективное исследование были включены 30 стабильных больных (14 мужчин и 16 женщин) с ТПН, средний возраст – 58,5 ± 14,6 года, получавших лечение программным ГД в отделении гемодиализа ГКБ им. С.П. Боткина. Средняя длительность лечения ГД составила 3,38 ± 2,03 года. Причиной
ТПН стали хронический гломерулонефрит – 9, обструктивная нефропатия – 5, сахарный диабет – 6, гипертоническая болезнь – 5, поликистозная болезнь – 5 больных.
Критерии включения в исследование: согласие на участие в исследовании, возраст – старше 18 лет, уровень Hb – 10–13 г/дл, стандартная поддерживающая терапия препаратами рчЭПО I поколения (альфа или бета) в/в после процедуры ГД; адекватный обмен железа (сывороточный ферритин > 100 нг/мл и КНТ > 20 %) и адекватный (Kt/V ≥ 1,2) программный ГД по 4–5 часов 3 раза в неделю не менее 3 месяцев.
Критерии исключения:
• тяжелая артериальная гипертензия (АД ≥ 180/100 мм рт. ст.), не поддающаяся медикаментозной коррекции;
• гемотрансфузии в течение последних 3 месяцев;
• состояния с высоким риском развития геморрагических осложнений и непосредственно геморрагические осложнения (оперативные вмешательства, кровотечения, тромбоцитопения);
• онкологические заболевания;
• тромбоциты > 500 × 109/л;
• парциальная аплазия красного костного мозга;
• эпилептические припадки в анамнезе.
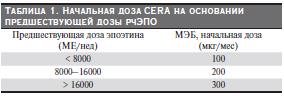
После включения в исследование всех больных перевели на лечение CERA. Препарат вводился в/в в начальной дозе 100, 200 или 300 мкг CERA 1 раз в месяц в зависимости от предшествовавшей дозы эпоэтина альфа или бета, полученных до назначения исследуемого препарата (табл. 1).
Целью терапии стало поддержание уровня Hb в заданном диапазоне 100–130 г/л. Затем дозу титровали в зависимости от уровня гемоглобина. При превышении уровня Hb > 140 г/л либо снижали дозу CERA на 100 мкг, либо пропускали очередную инъекцию препарата, при снижении Hb < 90 г/л
дозу препарата увеличивали на 100 мкг.
Необходимым условием достижения и поддержания целевых уровней Hb являлся адекватный статус железа, который поддерживался на протяжении всего периода исследования в/в введением препаратов железа (преимущественно венофер по 100 мг в месяц). В случае железодефицита (уровень сывороточного ферритина < 100 нг/мл и коэффициент насыщения трансферрина железом [КНТ] < 20 %) дозу венофера увеличили до 1 раза в неделю до устранения железодефицита.
Для предотвращения развития токсичности препаратов железа у больных с сывороточным ферритином > 800 нг/мл или КНТ >50 % препараты железа временно отменяли до достижения уровня ферритина < 800 нг/мл или КНТ < 50 %.
Безопасность CERA оценивали по следующим параметрам:
• серьезные нежелательные явления, общее их число, случаи смерти;
• общее состояние больного оценивалось на каждом визите 3 раза в неделю (жалобы, ЧСС, функционирование АВ фистулы);
• мониторирование АД 3 раза в неделю во время процедуры ГД;
• лабораторные показатели: уровни Hb, общий анализ крови оценивали каждые 2 недели, показатели обмена железа – 1 раз в 8 недель, уровни аспартатаминотрансферазы, аланинаминотрансферазы, щелочной фосфатазы, калия, фосфора, концентрация альбумина, общего белка, креатинина – 1 раз в 4 недели;
• адекватность процедуры ГД по формуле Даугирдаса ежемесячно;
• ЭКГ 2 раза в год и по показаниям.
Продолжительность исследования составила 12 месяцев. Рассчитывали средние значения анализируемых параметров и стандартное отклонение SD. Достоверность различий исследуемых показателей определяли с использованием методов непараметрической статистики при помощи программы Statistica 6.0 для Windows.
Результаты исследования
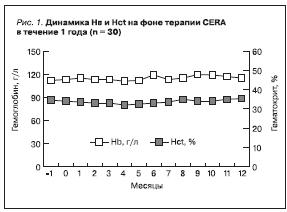
Исходно средний уровень гемоглобина у наших больных составил 113,96 ± 6,81 г/л, колебания его в течение исследования не были значимыми и через 12 месяцев средний уровень гемоглобина составил 115,47 ± 13,22 г/л. Средние величины гематокрита (Hct) также значимо не изменились на терапии CERA (32,90 ±2,90 % и 33,37 ± 3,25 % соответственно) (рис. 1). Как определено критериями включения, у всех больных в начале лечения CERA (0 недель) уровни Hb находились в пределах целевого диапазона 100–130 г/л. Большинству (70–97 %) больных удавалось поддерживать уровни Hb в этом целевом диапазоне на протяжении года. В то же время в более узком диапазоне 110–120 г/л уровни Hb находились в начале исследования только у 70 % больных и сохранялись в этом диапазоне более чем у половины больных на протяжении исследования. В табл. 2 представлена доля больных с уровнями гемоглобина в пределах этих двух целевых диапазонов по месяцам. Из общего числа анализов крови в 85 % Hb соответствовал целевому диапазону 100–130 г/л и в 54 % – 110–120 г/л.
Таблица 2. Доля больных с уровнями Hb (г/л) в пределах двух целевых диапазонов.
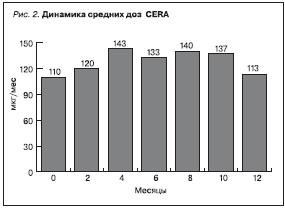
Средняя доза CERA в начале исследования составила 110 ±31 мкг/мес и достигла максимального значения к 4-му месяцу – 143 ± 51 мкг/мес, а к концу исследования (12 месяцев) составила 113 ± 61 мкг/мес (рис. 2). В среднем модификация дозы у пациентов составила 2,64 эпизода/год.
Показатели обмена железа поддерживались на протяжении всего исследования на должном уровне, как видно из табл. 3.
Адекватность гемодиализа, рассчитанная по формуле Даугирдаса, была с тенденцией к некоторому увеличению: 1,40 ± 0,35 – в начале и 1,57 ± 0,22 – в конце исследования (табл. 4). Концентрация креатинина в крови значимо не изменялась: 953 ± 254 и 980 ± 257мкмоль/л соответственно. Также не было значимых изменений уровней сывороточного калия (5,56 ± 1,32 и 5,47 ± 0,69) и альбумина (38,8 ± 2,2 и 39,90 ± 2,07).
За время исследования серьезных нежелательных явлений не зафиксировано. Летальных исходов не было. Гемодинамические показатели (табл. 5) сохранялись стабильными в течение периода наблюдения: систолическое АД – 147 ± 25 и 148 ± 26 мм рт. ст., диастолическое АД – 82 ±12 и 85 ± 14 мм рт. ст.; среднее АД – 104 ± 16 и 106 ± 17 мм рт. ст.; ЧСС – 70 ± 9 и 72 ± 10 ударов в 1 минуту (в начале исследования и в конце соответственно). Тромбозы артериовенозной фистулы зафиксированы у двоих больных (6,6 %).
Обсуждение
В представленном исследовании средняя доза препаратов рчЭПО I поколения до перехода на CERA была 5172 ± 2172 МЕ/нед, что значительно ниже средних доз этих препаратов в диализной популяции в Европе и США, где средние дозы составляют более 10 тыс. МЕ/нед, и сопоставима со средней
дозой рчЭПО (5118 ± 2819 МЕ/нед) в недавно опубликованном отечественном исследовании А.Ю. Земченкова и соавт. [1]. Ясного объяснения этому факту нет, но смеем предположить, что отечественные врачи более экономно и осторожно относятся к применению данных препаратов.
Средняя доза CERA в начале лечения составила 110 ± 31 мкг/мес и была максимальной к 4-му месяцу – 143 ± 51 мкг/мес, а к концу года наблюдения составила 113 ± 61 мкг/мес. Средние дозы CERA также были значительно ниже, чем в большинстве исследований, перечисленных выше. Этот факт, на наш взгляд, требует дальнейших объяснений.
Таблица 3. Динамика показателей обмена железа на фоне применения CERA.
Таблица 4. Динамика показателей адекватности гемодиализа, калия и альбумина на фоне применения CERA.
Таблица 5. Динамика АД и ЧСС на фоне применения CERA.
Наши данные демонстрируют, что при назначении CERA в режиме 1 раз в месяц в/в удавалось поддерживать среднюю концентрацию гемоглобина в целевом диапазоне 100–130 г/л в течение года в среднем у 83 % пациентов. Средние уровни гемоглобина в начале и конце исследования (113,96 ± 6,81 и 115,47 ± 13,22 г/л) значимо между собой не различались. Это позволяет сделать однозначный вывод об эффективности CERA в поддержании целевого уровня гемоглобина у исследуемых пациентов и подтверждает результаты многочисленных международных исследований.
Известно, что у больных на гемодиализе, особенно имеющих сопутствующую патологию, часто развиваются осложнения, связанные с применением разнообразных медикаментов [20]. 45 % осложнений обусловлены непосредственно введением медицинских препаратов, 33,5 % их которых обусловлены неправильной дозой, а 20,7 % связаны с нежелательной побочной реакцией на медикамент. Ошибки при применении препаратов рчЭПО в 4,3 % случаев связаны с недостаточно-
стью дозы, а в 14,4 % с ее превышением. Данные результаты были подтверждены анализом 7 исследований, выполненных в 1962–2004 гг. [21]. Показано, что ошибки в дозах препаратов составляют 20,4 % от всех проблем, связанных с назначением медикаментов (неназначение препарата, отсутствие адекватного лабораторного контроля, назначение препарата без показаний, неправильный выбор препарата, побочные реакции на медикамент, передозировка, недостаточная доза препарата). В среднем частота модификации дозы у наблюдаемых нами пациентов составила 2,64 эпизода/год. Такая редкая потребность в модификации дозы выгодна с двух позиций: 1) уменьшается риск ошибки и введения неправильной дозы препарата; 2) поддерживается более стабильный уровень гемоглобина. Это положение подтверждается практически отсутствием вариабельности гемоглобина у наших больных (рис. 1, табл. 3). Частой причиной вариабельности гемоглобина является именно необоснованное изменение дозы рчЭПО у больных. Так, А.Ю. Земченков и соавт. [1], изучавшие применение эритропоэтина альфа, показали, что из 38 модификаций дозы 24 были необоснованными. Колебания гемоглобина отмечаются более, чем у 90 % больных в течение года, получающих рчЭПО I поколения [25]. В нашем же исследовании применение CERA позволило кардинально уменьшить этот показатель и в среднем у 83 % больных в течение года поддерживать целевой гемоглобин. Повышение гемоглобина, по данным литературы [10], связано с необоснованным повышением дозы в 84 %, снижение гемоглобина – с удержанием дозы в 15 % и уменьшением дозы в 62 %, в то время как снижение гемоглобина вследствие инфекции наблюдается только в 6 % случаев. Такие частые колебания гемоглобина могут быть, в частности, связаны с отсутствием гибкости протоколов в коррекции анемии. Отсутствует разделение пациентов на высокочувствительных и резистентных к терапии рчЭПО. Поэтому у больных, высокочувствительных к эпоэтинам, увеличение дозы рчЭПО на 25 % при снижении Hb < 11 г/л может привести к резкому повышению гемоглобина. Быстрое же повышение гемоглобина вместе с повышением дозы рчЭПО приводит к увеличению летальности [13].
За последнее десятилетие в большинстве стран средний уровень гемоглобина у больных на ГД повысился с <100 г/л до >120 г/л, однако это не привело к существенному уменьшению смертности [6,15, 24]. Было также показано, что увеличение гемоглобина выше 130 г/л приводит к увеличению кардиоваскулярных осложнений. С учетом этого положения внимание ряда исследователей привлекла проблема вариабельности гемоглобина и ее влияние на выживаемость. Хотя ряд исследований свидетельствует в пользу отсутствия влияния вариабельности гемоглобина на смертность пациентов [8, 27], множество других исследований доказывают обратное положение [7, 23, 28]. Как следует из анализа данных [22], полученных в ходе исследования DOPPS (Dialysis Outcomes and Practice Patterns Study) у 26 510 пациентов и из центров Medicare (193 291 пациент), уровень смертности больных прямо коррелировал c интенсивностью колебания гемоглобина и уровнем гемоглобина не в пределах целевых значений. Показано, что каждое увеличение вариабельности на 10 г/л приводит к увеличению смертности на 33 %, а в пределах 15 г/л – на 53 %. При этом не было обнаружено корреляции с уровнем гемоглобина [28]. На наш взгляд, имеется неопровержимый факт, что стабильный уровень гемоглобина не вызывает негативных последствий, а любые колебания показателей гомеостаза не могут негативно не влиять на организм. Так, колебания гемоглобина приводят к изменениям в доставке кислорода к тканям и органам. Эти эпизоды могут и приводят к ишемии и дисфункции органов, а также к их повреждению [3, 9]. В первую очередь страдает миокард, возникают факторы, приводящие к гипертрофии левого желудочка.
В нашем исследовании нежелательные явления, связанные с терапией CERA, регистрировались крайне редко. Среднее АД у больных на фоне применения CERA не увеличилось, дополнительно гипотензивные препараты в ходе исследования не назначались. У двоих больных из 30 зафиксированы тромбозы артериовенозной фистулы (6,6 %).
Заслуживает внимание и тот факт, что применение CERA 1 раз в месяц позволило избежать характерных для частого применения эпоэтинов I поколения ошибок в дозировании препарата и сэкономить время медицинского персонала нашего центра.
Выводы
1. Применение CERA позволяет поддерживать уровень гемоглобина в заданном узком диапазоне.
2. Требуется редкое изменение дозы препарата (2,64/год), что позволяет избегать ошибок при введении препарата, по сравнению с эпотинами I поколения.
3. Нежелательные явления при применении CERA встречаются редко.



