Введение
Результаты многих исследований последних лет доказали, что жировую ткань следует рассматривать как активный эндокринный орган. Среди биологически активных веществ, вырабатываемых жировой тканью и участвующих в патогенезе нефропатий, особое внимание уделяется лептину и адипонектину [1].
В настоящее время активно обсуждается роль адипокинов в патогенезе хронической болезни почек [2]. Хорошо известно, что адипокины отвечают за гомеостаз ткани, регулирование энергии, уровня глюкозы, метаболизма липидов, а также за развитие воспаления, в связи с этим они обладают противовоспалительными, антиатерогенными и антидиабетическими свойствами, однако дисбаланс их продукции может обусловливать прогрессирование тканевого воспаления, дезадаптивной гипертрофии и фиброза [3].
В связи с этим целью нашего исследования, проведенного в отделении наследственных и приобретенных болезней почек Московского НИИ педиатрии и детской хирургии, явилась оценка роли гормонов жировой ткани (лептина и адипонектина) в поражении почек при стероидрезистентном нефротическом синдроме (СРНС) у детей.
Материал и методы
Больные, включенные в исследование, были разделены на 2 группы: 1-ю группу (основную) составили 23 ребенка со стероидрезистентным нефротическим синдромом (СРНС) в активную стадию (10 мальчиков и 13 девочек). Во 2-ю группу (сравнения) вошли 11 детей с СРНС без отеков, биохимических изменений крови и с протеинурией менее 500 мг/сут, ранее получавших курс иммуносупрессивной терапии (6 мальчиков и 5 девочек). Длительность заболевания у больных основной группы составила
4,61 ± 4,6 года, группы сравнения – 4,04 ± 3,04 года. Диагноз СРНС верифицировался на основании клинико-анамнестических данных, результатов объективного и лабораторно-инструментального обследований. Различия по соотношению мальчики/девочки, возрасту и росту между основной и группой сравнения были статистически незначимы (р > 0,05).
В основной группе 21 ребенку выполнена биопсия почки, с помощью которой были диагностированы фокально-сегментарный гломерулосклероз (6 детей [28,58 %]), мезангио-пролиферативный гломерулонефрит (10 [47,62 %] больных), мембранопролиферативный гломерулонефрит (5 детей [23,8 %] больных). В группе сравнения десятерым выполнена биопсия почки. У 1 (10 %) представителя этой группы диагностирован фокально-сегментарный гломерулосклероз, еще у 1 (10 %) – нефропатия минимальных изменений, 1 (10 %) больной страдал мембранопролиферативным гломерулонефритом, 7 (70 %) – мезангиопролиферативным гломерулонефритом. Частота морфологических вариантов почечного поражения в обеих группах достоверно не различалась.
После ночного двенадцатичасового голодания были взяты образцы крови для измерения в сыворотке биохимического анализ крови, включая общий белок и уровень альбумина. Для оценки липидного профиля проводилось исследование сывороточной концентрации общего холестерина (ХС), триглицеридов (ТГ), холестерина липопротеинов высокой плотности (ХС ЛВП), холестерина липопротеинов низкой плотности (ХС ЛНП) ферментативным колориметрическим методом с использованием наборов реагентов фирмы HUMAN (Германия). Расчет коэффициента атерогенности (КА) проводился по общепринятой формуле (А.Н. Климов, 1977): КА = (ХС–ХС ЛВП)/ХС ЛВП. У всех больных была оценена суточная экскреция белка с мочой.
Образцы сыворотки крови для определения концентрации лептина и адипонектина хранили при -70 °С до проведения анализа.
Уровни лептина и адипонектина в сыворотке крови определяли методом ИФА с использованием коммерческих наборов фирмы DSL (США) (лептин) и BioVendor (Чехия) (адипонектин).
Статистический анализ проводили с использованием пакета прикладных программ STATISTICA 6.0 for Windows. Поскольку для большинства данных гипотеза о нормальности выборок отвергалась по критерию Колмогорова–Смирнова, результаты представляли в виде средних значений и стандартного отклонения (для нормально распределенных признаков) и в виде медианы М, а также ее доверительного интервала (ДИ) (для ненормально распределенных признаков). Сравнение независимых выборок производили в непрерывных переменных между двумя группами с помощью T-критерия Стьюдента или, где это применимо, критерием Манна–Уитни и Вилкоксона. Коэффициенты корреляции Пирсона и Спирмана вычислялись в пакете программ Statistica 6.0. Достоверными считали различия при р < 0,05.
Результаты и обсуждение
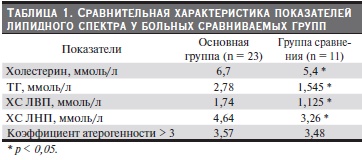
Среди детей основной группы прослеживалась тенденция к более высоким показателям ТГ, ХС ЛНП, ХС ЛВП, ХС. Коэффициент атерогенности в основной группе составил 3,57, в группе сравнения – 3,48 (табл. 1). Таким образом, у пациентов с обострением СРНС нарушения обмена липопротеидов были заметно более выраженными. Как видно из табл. 1, среди представителей основной группы существенно чаще обнаруживалось повышение уровня ТГ, ХС ЛВП, ХС ЛНП, общего холестерина.
Сывороточные уровни лептина и адипонектина, определенные методом ИФА, демонстрировали, что при обострении СРНС адипонектинемия имеет четкую тенденцию к нарастанию (медиана – 22,1
мг/мл) по сравнению с теми, у кого СРНС находился в ремиссии (медиана – 14,75 мг/мл, р = 0,01 vs группа с обострением СРНС).
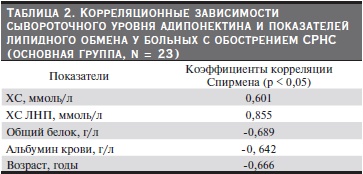
Среди детей с СРНС выявлено существование сильных положительных корреляций между уровнем адипонектина сыворотки и сывороточной концентрацией общего холестерина (r = 0,601, p < 0,05), ЛНП (r = 0,855, p < 0,05). Сывороточный уровень белков (r = -0,689, p < 0,05), альбумина (r = -0, 642, p < 0,05) и возраст (r = -0,666, p < 0,05), напротив, оказались обратно пропорциональными адипонектинемии (табл. 2).
У детей с обострением СРНС (основная группа) величина отношения лептин/адипонектин была статистически значимо выше, чем у детей с ремиссией СРНС, относящихся к группе сравнения (0,64 против 0,35, p < 0,05). Таким, образом, можно говорить, что при обострении СРНС продукция адипокинов характеризуется отчетливым нарастанием.
Гиперпродукция адипокинов, установленная нами у больных с обострением СРНС, в определенной степени может быть отражением компенсаторной реакции на массивную протеинурию, гипоальбуминемию и гиперлипидемию – основополагающие компоненты нефротического синдрома. Необходимо подчеркнуть, что наряду с собственно интенсификацией прогрессирования почечного поражения гиперпродукция адипонектина может отражать увеличение риска сердечно-сосудистых осложнений. В качестве непосредственного триггера активации продукции адипонектина может выступать протеинурия: так, продемонстрировано, что адипонектин экскретируется с мочой. Таким образом, установлено [7], что на поздних стадиях диабетической нефропатии возрастает как продукция адипонектина, так и его мочевая экскреция; при снижении протеинурии сывороточный уровень адипонектина уменьшается. В нашем исследовании удалось констатировать достоверное снижение адипонектинемии у детей с ремиссией СРНС по сравнению с теми, у кого наблюдалось
обострение почечного процесса. Можно предполагать, что увеличение продукции адипонектина, наблюдающееся при обострении СРНС, может быть адаптивным и компенсировать выраженные нарушениям обмена липопротеидов, свойственные собственно НС. Кроме того, при обострении СРНС рост сывороточной концентрации адипонектина может быть, по крайней мере частично, обусловлен нарушениями его экскреции с мочой, свойственными активности почечного поражения [3]. Отмеченное нами снижение продукции адипонектина по мере увеличения возраста больных СРНС требует специального изучения, в т. ч. оценки взаимосвязи адипонектинемии с основными
антропометрическими параметрами [8]. В целом результаты нашего исследования свидетельствуют о том, что при СРНС продукция адипокинов возрастает; клиническое и прогностическое значения
данного феномена требуют дальнейшего уточнения.



