Введение
Прогрессирование всех почечных болезней характеризует одна общая черта – клеточная пролиферация с последующим накоплением внеклеточного матрикса и сморщиванием (фиброзом) ткани [1, 2]. При этом гломерулосклероз и фиброз интерстиция являются ключевыми элементами в развитии терминальной
стадии почечной недостаточности [3]. Исследования последних лет указывают на возможность влияния ряда факторов (гуморальных и клеточных) на процесс фиброгенеза.
В основе процессов, определяющих воспалительно-репаративные изменения, лежат как местные, так и общепатологические реакции, адекватность которых регулируется интегральной системой межклеточных взаимодействий посредством синтеза комплекса биологически активных соединений (цитокинов, факторов роста, липидных медиаторов воспаления, ренин-ангиотензинальдостероновой системы, металлопротеиназ и т. д.) [4, 5].
Согласно этой концепции, повреждение тубулярных эпителиальных клеток приводит к разрушению узловых комплексов Е-кадгерина, транслокации в ядро клетки β-катенина, уменьшению экспрессии цитокератина. Иными словами, клетки теряют классические эпителиальные признаки и приобретают
мезенхимальный фенотип, подразумевающий экспрессию α-гладкомышечного актина и виментина, расплавление базальной мембраны матриксными металлопротеиназами (ММП)-2 и -9 с последующим проникновением модифицированных эпителиальных клеток в пространство интерстиция. Подобная
эпителиально-мезенхимальная трансформация, по мнению ряда авторов, и лежит в основе развития хронической болезни почек и прогрессирования нефросклероза [6–8].
Основным молекулярным компонентом фиброза является коллаген, присутствующий не только в коллагеновых волокнах и базальной мембране, но и в аморфном веществе соединительной ткани. Процесс коллагеногенеза в репаративной стадии воспаления регулируется рядом биологически активных соединений. Особая роль при этом принадлежит комплексу матриксных цинксодержащих ферментов – металлопротеиназ, в частности ММП-2 и -9, расщепляющих основные компоненты экстрацеллюлярного матрикса (ЭЦМ) [9,10].
Тканевые ингибиторы металлопротеиназ (ТИМП) инактивируют ММП в условиях адекватного патофизиологического ответа на острое повреждение. Однако большинство болезней почек характеризуется выраженным нарушением баланса ММП и ТИМП. Так, при развитии интерстициального фиброза преобладают процессы синтеза белков внеклеточного матрикса и коллагеногенеза [11, 12].
Воспалительные заболевания органов мочевой системы, в частности П, считаются одними из самых распространенных заболеваний у детей после респираторных инфекций и зачастую приводят к склерозированию почечной ткани [13–15]. Так, у трети (36,4 %) больных первого года жизни после 1-го эпизода П обнаруживаются признаки нефросклероза [16, 17]. В связи с этим изучение молекулярных аспектов патогенеза нефросклероза при П становится особенно важным, что и предопределило цель настоящего исследования – определение экскреции с мочой ММП-2 и -9 матриксных металлопротеиназ-2 и -9 и ТИМП-1 для оценки их роли в развитии инфильтративно-
воспалительных процессов в почках при П у детей.
Материал и методы
Обследованы 80 детей с П в возрасте от 5 до 15 лет (средний возраст – 8,79 ± 0,26 года). В зависимости от варианта течения болезни больные были разделены на четыре группы. Первую
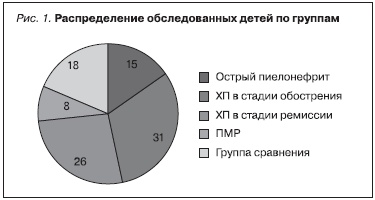
группу (n = 15) составили больные с острым П (ОП). Во вторую группу (n = 31) вошли пациенты с обострением хронического П (ХП). Третья группа (n = 26) представлена детьми с ХП в стадии клинико-лабораторной ремиссии без нарушений уродинамики. В четвертую группу (n = 8) включены дети с ХП в сочетании с аномалиями развития мочевой системы (пузырно-мочеточниковый рефлюкс, гидронефроз, мегауретер и т. д.). У 4 из них (50%) по результатам статической нефросцинтиграфии выявлен очаговый нефросклероз. Референтную группу составили 18 здоровых детей, сопоставимых с больными П по полу и возрасту (рис. 1).
Поскольку динамика показателей ММП и ТИМП в моче в большей степени отражает характер и интенсивность процессов в почечной паренхиме, всем обследованным больным и детям референтной группы определена концентрация металлопротеиназ и ТИМП в моче методом иммуноферментного анализа (ИФА). Исследование детей с активностью П проводилось дважды (в начале и после 10–14 дней антибактериальной терапии).
Для получения сопоставимых результатов были соблюдены следующие условия:
• обследование больных в стационаре;
• установление точного диагноза П с использованием необходимых клинико-лабораторных, ультразвуковых, радио- и рентгенологических методов исследования;
• стандартизация методики сбора, хранения, обработки мочи, определение показателей биологически активных соединений в образцах.
Для стандартизации результатов рассчитывалось соотношение ММП-2, -9, ТИМП-1 к уровню креатинина в разовых утренних порциях мочи.
Статистический анализ результатов проводился с использованием PCAMD (Athlon) XP 2000+, оснащенным пакетом программ MicrosoftOffice “Excel” и “Statgraf”.
Результаты и обсуждение
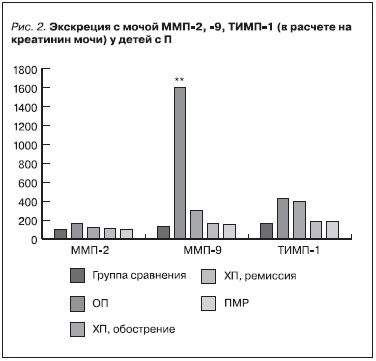
У всех больных П отмечено повышение экскреции с мочой металлопротеиназ и их тканевого ингибитора. Пациенты с острым микробно-воспалительным процессом в почках (1-я группа) отличались резко выраженной гиперпродукцией ММП-9 (в 17 раз больше данного показателя в референтной
группе, p < 0,001, и в 5 раз больше по сравнению с больными с обострением ХП, p < 0,01) (рис. 2).
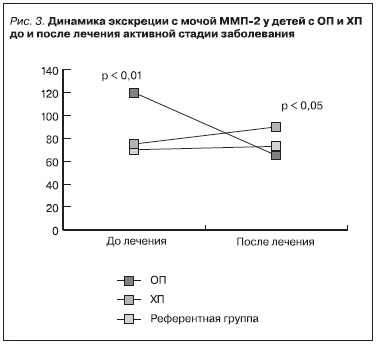
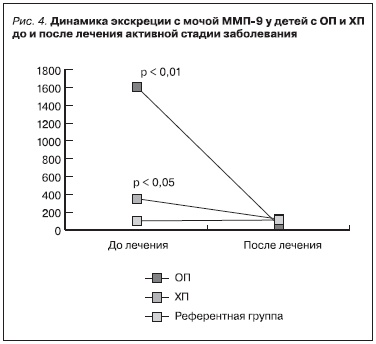
После антибактериального лечения детей с ОП (1-я группа) отмечено снижение концентрации в моче металлопротеиназ по сравнению с исходными значениями (ММП-2 – в 2 раза, p < 0,01; ММП-9 – в 38 раз, p < 0,001; ТИМП-1 – в 2 раза, p < 0,01). После антибактериальной терапии у пациентов с
обострением ХП (2-я группа) концентрация ферментов достигала референтных значений, а уровень ММП-9 был даже ниже таковых (рис. 3 и 4).
Мочевая экскреция металлопротеиназ у больных с ХП в стадии клинико-лабораторной ремиссии без нарушений уродинамики существенно не отличалась от уровня ферментов в референтной группе, в то время как особенностью пациентов 4-й группы было достоверное снижение продукции ММП-2 в сравнении с больными в ремиссии ХП и референтными значениями (ММП-2/мКр – 59,9 ± 0,9; 67,9 ± 1,1; 68,9 ± 0,8 соответственно, p3,4 < 0,05, p4, реф. < 0,05) при повышенном содержании в моче ТИМП-1.
Дети с очаговым нефросклерозом в средних значениях ММП-2, -9, ТИМП-1/мКр не отличались от больных с ХП и детей референтной группы (p > 0,05) (см. таблицу). Тем не менее у одного ребенка с двусторонним пузырно-мочеточниковым рефлюксом 3-й степени, двусторонней рефлюкс-нефропатией
и длительным анамнезом заболевания показатели экскреции с мочой металопротеиназ и ТИМП-1 существенно превышали таковые в целом по группе (ММП-2/мКр – 136,2; ММП-9/мКр – 403,5; ТИМП-1/мКр – 302,1).
Таблица Экскреция ферментов с мочой у детей с нефросклерозом и хроническим пиелонефритом.
Таким образом, результаты проведенного исследования свидетельствуют о существенных изменениях системы матриксных белков у детей с микробно-воспалительным процессом в почечной паренхиме, что согласуется с результатами исследования других авторов, подтверждающих значение дисфункции
металлопротеиназ и их ингибиторов в развитии почечного фиброза у детей с П [18].
Преимущественное повышение содержания в моче ММП-9 у больных ОП, с одной стороны, может быть результатом интенсивной миграции нейтрофилов в очаг воспаления.
С другой стороны, не исключена роль ММП-9 в качестве компенсаторного ингибитора процессов апоптоза при остром повреждении почки в условиях выраженного воспаления и оксидативного стресса [19].
Существенное снижение продукции матриксных белков у детей с активностью П (острого или хронического) после курса антибактериальной терапии свидетельствует об эффективности проведенного лечения. Однако преимущественное уменьшение концентрации в моче ММП-9 у детей с хроническим воспалительным процессом также может свидетельствовать о присоединении процесса фиброгенеза, требующего назначения ренопротективной терапии [20].
Отсутствие существенных изменений системы цинксодержащих ферментов у детей с ХП в стадии клинико-лабораторной ремиссии может свидетельствовать об истощении резервных компенсаторных возможностей пораженной ткани, прогрессирующем накоплении экстрацеллюлярного матрикса, что синтеза матричных протеинов на фоне сниженной их деградации. Известно, что снижение активности ММП (особенно ММП-2 и ММП-9) приводит к избыточному накоплению белков внеклеточной мембраны [6, 10].
Помимо этого доказано, что точкой приложения ММП являются не только элементы ЭЦМ, но и факторы роста (трансформирующий фактор роста β, фактор роста фибробластов и др.), про- и противовоспалительные цитокины, а также другие соединения, участвующие не только в накоплении и деградации ЭЦМ, но и в реакциях воспаления, клеточного роста пролиферации и фиброзирования [21].
Значительное снижение продукции ММП-2, под воздействием трансформирующего фактора роста способствующей миграции эпителиоцитов в интерстиций и трансдифференцировке их в миофибробласты, у детей с аномалиями развития мочевой системы может свидетельствовать о развитии необратимых структурно-функциональных нарушений в паренхиме органа с формированием рубцовой ткани. Наше предположение согласуется с результатами экспериментальных исследований S. Cheng et al. (2006), подтвердивших значение ММП-2 в процессах воспаления и фиброгенеза, в частности показавших, что ингибирование металлопротеиназы-2 на ранней “префибротической” стадии болезни поможет замедлить или остановить прогрессирование нефросклероза [4].
Следовательно, матриксные белки (ММП-2, ММП-9, ТИМП-1) можно рассматривать в качестве ключевых медиаторов воспаления и фиброгенеза почечной ткани у больных с П. Дальнейшие исследования молекулярных механизмов регуляции процессов воспаления, коллагено- и фиброгенеза почечной паренхимы будут способствовать более глубокому пониманию патофизиологии нефросклероза у детей с микробно-воспалительным поражением почек.



