Введение
Обструктивная уропатия – комплекс структурных и функциональных изменений мочевыводящих путей из-за нарушения оттока мочи вследствие обструкции. Обструкция, возникшая антенатально на ранних сроках эмбрионального развития, приводит к формированию дисплазии, гипоплазии, обструктивным кистозным изменениям. Антенатальная обструкция на более поздних этапах гестации приводит к гидронефрозу, уретерогидронефрозу [1, 2].
Врожденные обструктивные уропатии составляют 41 % среди всех причин, приведших к формированию хронической почечной недостаточности (ХПН) в детском возрасте в России [3].
Успехи в изучении естественного течения и последствий урологических пороков развития, а также прогресс и усовершенствование медицинских навыков и хирургической техники привели к необходимости интердисциплинарного подхода ко многим урологическим состояниям [4, 5]. Во многих центрах мира эффективная кооперация детского нефролога, радиолога и уролога обусловила прогресс успешного лечения большинства пациентов.
В современных условиях отработаны тактика пренатальной диагностики аномалий развития органов мочевой системы и
этап постнатального их выявления, закрепленные в приказах и стандартах наблюдения за детьми первого года жизни [1, 6, 7]. Сформировалось понимание того, что дети с аномалиями развития мочевой системы нуждаются в длительном наблюдении не только уролога, но и нефролога, который
должен определять стратегию нефропротективной терапии. Эта тактика хорошо отработана при рефлюкс-нефропатиях [8]. Однако в современной практике урологическая часть проблемы обструктивных уропатий заключается в контроле над результатами проведенного вмешательства по восстановлению тока мочи, пластики мочевых путей. Нефрологическая часть становится очевидной при развитии вторичного хронического пиелонефрита, артериальной гипертензии, ХПН. Существует определенный временной разрыв между благополучно проведенной операцией и манифестацией
таких осложнений, как ХПН. Именно в этом промежутке времени возможно латентное формирование хронической болезни почек (ХБП) и ее прогрессирование. Сделать этот процесс контролируемым позволят междисциплинарный подход к оценке здоровья ребенка и проведение профилак-
тики ХБП.
По данным литературы, внутриутробная задержка развития плода и недоношенность связаны с повышенным риском тяжелой болезни почек. Л.С. Приходина, В.В. Длин, М.С. Игнатова [9] отмечают, что малая масса при рождении – фактор риска прогрессирования стероидрезистентного нефротического синдрома. С этих позиций представляет интерес взаимосвязь массы тела при рождении ребенка с обструктивной уропатией и развитием ХБП. В настоящее время ведущие урологи уделяют серьезное внимание механизмам раннего формирования ХБП у взрослых урологических пациентов, в частности при мочекаменной болезни [10]. Термин ХБП в педиатрии впервые применен R.J. Hogg [11] в 2003 г. как заимствованный из терапевтической практики. Определение ХБП, классификация ее по стадиям в педиатрии не отличаются от классификации у взрослых [11].
Цель исследования– проанализировать течение и исходы обструктивных уропатий у детей и на основе междисциплинарного подхода определить пути профилактики прогрессирования ХБП.
Материал и методы
Всего под наблюдением были 265 детей с обструктивными уропатиями в возрасте от 1 месяца до 17 лет. Изучен катамнез 145 детей с мегауретером, пролеченных и прооперированных в 1999–2006 гг. Проспективно наблюдались 120 детей, в т. ч. 102 с гидронефрозом, 18 с мегауретером. Наблюдение
выполнено в течение 2008–2010 гг. в отделениях детской урологии и нефрологии Самарской областной клинической больницы им. М.И. Калинина (СОКБ). Все дети были прооперированы.
В работе применялись клинико-анамнестические, лабораторные, инструментальные (рентгено-урологические), бактериологические методы исследования соответственно стандарту обследования детей с обструктивными уропатиями. Проведена оценка функций почек с определением скорости
клубочковой фильтрации (СКФ) как универсального маркера неблагоприятного прогноза [12]. Части детей выполнена динамическая сцинтиграфия, компъютерная томография почек. Применялись морфологические методы анализа удаленных лоханочно-мочеточниковых и пузырно-мочеточниковых
сегментов, а также почек. ХБП диагностирована согласно критериям K/DOQI, 2003.
Результаты и обсуждение
Для ретроспективного анализа взяты дети с мегауретером, особенно серьезной патологией по своим социальным последствиям, пролеченных в 1999–2006 гг. Данные о возрастном и половом составе детей представлены в табл. 1. Дети с первичным пузырно-мочеточниковым рефлюксом в исследование
не включались.
Пренатально выявлена обструктивная уропатия (выраженная пиелоэктазия и диаметр мочеточника превышал 1 см в диаметре) у 22 детей. Среди 17 детей мегауретер был двусторонним, 21 ребенка – с удвоенной почкой, 4 – с единственной. Все дети оперированы, в т. ч. 12 повторно. Операции включали пиелостомию, эндоскопическое стентирование мочеточника, уретероцистонеоанастомоз по
Коэну и Баирову. Было выполнено 5 нефрэктомий, 12 геминефруретерэктомий.
Известно, что у плодов с выраженным двусторонним гидронефрозом или двусторонним обструктивным мегауретером прогноз в плане сохранения почек всегда сомнителен [13]. Все это надо объяснять родителям на перинатальном консилиуме.
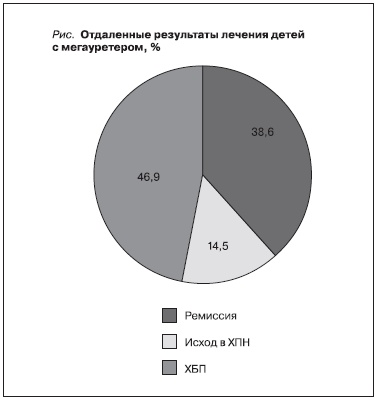
По данным катамнеза, среди 56 (38,6 %) детей была отмечена ремиссия. Отдаленные результаты лечения детей с мегауретером представлены на рисунке. У 8 детей диагностирована ХПН при
первом обращении, 4 из них умерли в сроки через 3–5 лет от терминальной недостаточности. У 11 детей развилась ХПН в последующие годы, и они включены в областной регистр детей с ХПН на додиализной стадии. Двум детям сделана трансплантация почек. Таким образом, всего у 21 (14,5 %) ребенка по данным катамнеза развилась ХПН. Оставшиеся 68 (46,9 %) детей после разных методов оперативного вмешательства по результатам катамнеза продолжают ежегодно наблюдаться в специализированном отделении. Им выполняются рентгенологические исследования и дважды в год УЗИ почек. Практически у всех через 5–6 лет сформировались ахалазия мочеточника в нижней
трети или вторичный пузырно-мочеточниковый рефлюкс в нижнюю треть мочеточника. Можно считать, что у этих детей не исключено развитие ХБП. Известно, что приобретенные формы пузырно-мочеточникового рефлюкса труднопредсказуемы по дальнейшему ходу событий. Дополнительный риск
для повреждения почек у этих пациентов создает развитие вторичного пиелонефрита практически у всех детей с риском рубцевания почек. Летальность в этой группе наблюдения составила 2,8 % (в абсолютных цифрах умерли 4 ребенка от терминальной ХПН.
Клинический пример 1. Мальчик 10 лет обследован в феврале 2011 г. в СОКБ. Жалобы на периодические боли в животе. Из анамнеза известно, что патология почек диагностирована
пренатально одновременно с врожденным пороком сердца, и ребенок родился с левосторонним уретерогидронефрозом, дефектом межжелудочковой перегородки. Прооперирован в
2 года по поводу мегауретера и в 5 лет – по поводу дефекта межжелудочковой перегородки. Наблюдался по месту жительства кардиологом, урологом. Проводилось лечение и профилактика инфекции мочевых путей. Ребенок доношенный, беременность протекала с угрозой прерывания. Грудное вскармливание до 6 месяцев. Родители здоровы. При осмотре состояние ребенка признано удовлетворительным. АД – 80/60 мм рт. ст. В общем анализе мочи лейкоцитов до 4 в п/зр, белок –
0,32 г/л, анализ крови без особенностей. СКФ – 38,6 мл/мин на 1,73 м2, канальцевая реабсорбция – 97,3 %. В пробе по Зимницкому – изо-, гипостенурия. Динамическая сцинтиграфия почек с технемагом выявила умеренное нарушение секреции справа, грубое нарушение функции левой оперированной
почки. По данным УЗИ почек – признаки нефросклероза слева. Экскреторная урография – признаки хронического пиелонефрита. По данным уретероцистографии – нейрогенный мочевой пузырь, теней рефлюксов нет. Заключение: у ребенка хронический вторичный обструктивный пиелонефрит, частичная клинико-лабораторная ремиссия, нейрогенная дисфункция мочевого пузыря. По состоянию СКФ – ХБП III–IV стадий. О системном нарушении функции почек свидетельствовали данные пробы Зимницкого, динамической сцинтиграфии. Лечение включало диету, курантил, эналаприл, уросептики.
Рекомендовано продолжить прием ингибиторов АПФ, проводить профилактику инфекций мочевых путей, контролировать АД. Мальчик включен в областной регистр детей с ХПН.
Таблица 1. Данные о возрастном и половом составе детей с обструктивными уропатиями.
На проспективном этапе наблюдения за 2008–2010 гг. пролечены 120 детей с обструктивными уропатиями (гидронефроз, мегауретер). Данные о возрасте и поле этой группы также представлены в табл. 1. Все дети были прооперированы. Характер проведенных операций: полная резекция
адинамического сегмента, пластика лоханочно-мочеточникового сегмента, стентирование анастомоза, временный дренаж лоханки (нефростомия); сделано 10 нефрэктомий.
Дети наблюдались урологом, нефрологом – одновременно или последовательно. Проводились УЗИ почек, профилактика инфекции мочевых путей. Симптоматическая терапия включала витаминотерапию, неспецифические стимуляторы иммунитета, виферон, нейромедин, энерготропные препараты. После определения СКФ в терапию при необходимости включали ингибиторы АПФ.
Пренатально обструктивная уропатия выявлена в 56 % случаев в возрасте от 3 месяцев и до года – в 16,6 %. У части пациентов врожденная патология была обнаружена при профилактических
осмотрах в детских садах и школах или при развитии осложнений – инфекции мочевых путей, на фоне абдоминального и болевого синдрома в поясничной области. Детей с гидронефрозом и мегауретером обследовали 1–2 в год. Всем пациентам проведено исследование СКФ по формуле Шварца. У трети (39 детей) пациентов выявлено снижение этого показателя по сравнению с нормой с колебаниями от
79,6 и до 11,8 мл/мин на 1,73 м2 поверхности тела (табл. 2). Самый низкий показатель (11,8 мл/мин) выявлен у мальчика Н. в возрасте 1 месяца.
Клинический пример 2. Мальчик Н. сразу после рождения попал под наблюдение с двусторонним мегауретером, кистозной дисплазией почек. Пороки развития были обнаружены пренатально, причем обследования проводились в медицинских центрах Москвы, но прервать беременность родители отказались. Ребенок родился недоношенным (37 недель) от второй беременности (первая – медицинский аборт), беременность протекала с угрозой прерывания, в 15 и 30 недель женщина
перенесла ОРВИ, в 33 недели – гестоз. После обследования новорожденного с первых же дней жизни выставлен основной диагноз: обструктивный мегауретер слева, рефлюксирующий мегауретер справа IV степени, кистозная дисплазия почек. Наложена пиелостома слева, поставлен постоянный уретральный дренаж. Уровень мочевины крови на тот момент составил 7,8 ммоль/л, креатинин – 258 мкмоль/л, СКФ – 11,8 мл/мин/1,73м2. Осложнения: вторичный пиелонефрит, рефлюкснефропатия, ХПН, или ХБП IV стадии с переходом в терминальнуй почечную недостаточность. Сопутствующий диагноз: перинатальное гипоксическое повреждение центральной нервной системы, генерализованные клонико-тонические судороги. Ребенок постоянно наблюдается урологом и нефрологом. В возрасте 11 месяцев при повторном обследовании констатируются все признаки ХПН: уровень мочевины – 11,8 ммоль/л, креатинина – до 322 мкмоль/л, эпизоды гиперкалиемии, СКФ остается низкой. Нефрогенная анемия – эритроцитов от 2,26 до 3,91 × 1012/л, гемоглобин – колебания от 54 до 104 г/л (после коррекции). Отмечена гипотрофия I–II степеней. Ребенок получает лечение – стол индивидуальный, кетостерил, капотен, кальций D3-никомед, депакин-сироп, ванкомицин, фурагин, инфузионную терапию. Прогноз неблагоприятный. Консультирован в Москве, в Российской детской клинической
больнице, по поводу возможности радикальной оперативной коррекции мегауретера с двух сторон. Рекомендовано консервативное симптоматическое лечение.
Клинический пример 3. Мальчик Р., у которого с первых дней жизни выявлены двусторонний мегауретер, дисплазия почек. В связи с этим были наложены нефростома справа, постоянный уретральный дренаж. Особенность данного случая – пренатальный скрининг проводился в частной клинике, УЗИ-специалист патологии плода не обнаружил. У ребенка с первых дней гиперазотемия, все клинико-лабораторные признаки ХПН. С двух сторон наложены нефростомы, постоянный
уретральный катетер. Консультирован в Центре трансплантации почек Москвы, рекомендована консервативная терапия по поводу ХПН. В настоящее время ребенку 4,5 года и вскоре будет выполнена трансплантация почки от матери. Получает гормон роста, эпокрин, актиферрин, кальций D3-никомед, кетостерил, другую симптоматическую терапию. Отстает в физическом развитии.
Таблица 2. Распределение детей с обструктивными уропатиями по стадиям ХБП.
Понижение функции почек, определенной по СКФ, у наблюдаемых нами пациентов соответствовало в основном ХБП II стадии (колебания от 67,2 мл/мин/1,73 м2 поверхности тела и до 79,6 мл/мин/1,73 м2), у 6 – ниже 60 мл/мин/1,73 м2, т. е. ХБП III стадии. Среди больных с пониженной функцией почек чаще встречался мегауретер.
В группе пациентов с сохраненной суммарной функцией почек преобладала гидронефротическая трансформация почек с односторонним поражением. Это, однако, не исключало значительного снижения функции почек на стороне поражения при проведении экскреторной урографии вплоть до отсутствия функции почек при резком истончении паренхимы почки. Это обстоятельство служило основанием для нефрэктомии, проведенной 10 детям. У каждого второго пациента в качестве
осложнения отмечено развитие вторичного пиелонефрита, но тяжелые формы этого осложнения встречались редко. У каждого четвертого ребенка отмечена легкой и средней степени тяжести анемия.
Возросла роль латентных форм течения вторичной инфекции мочевых путей (ИМП) и недифференцированного синдрома соединительнотканной дисплазии [14]. Поэтому лечению и
профилактике ИМП мы уделяли серьезное внимание, особенно с учетом возможности развития осложненной ИМП [15]. Для возникновения осложненных ИМП у наблюдаемых нами пациентов главное значение имели наличие в мочевых путях стента, постоянного уретрального катетера. Заболевание
протекало как бессимптомно, так и с выраженной симптоматикой, повышением температуры тела до фебрильных цифр. Значимыми были изменения в анализах мочи – лейкоцитурия, протеинурия, патологическая бактериурия, эритроцитурия. Отмечны лейкоцитоз нейтрофильного характера, ускоренная СОЭ, анемия. Повышался уровень С-реактивного белка. Возбудители – E. coli, Pseudomonas spp. и др. Восстановление уродинамики, антибактериальная терапия способствовали обратному развитию воспаления. У трети детей с обструктивными уропатими в качестве сопутствующей патологии отмечены перинатальные повреждения нервной системы. Дети с данной патологией нередко обследовались и лечились в отделении патологии новорожденных, где их параллельно наблюдал и уролог. Недоношенными при проспективном наблюдении родились всего семь детей, один из них был с мегауретером, поэтому сделать какие-либо выводы о значении данного фактора в развитии ХБП не представляется возможным.
В морфологических исследованиях удаленных лоханочно-мочеточниковых сегментов обнаружены фиброзная ткань без эпителиальной выстилки; очаговая атрофия эпителиальной выстилки; очаговый фиброз подслизистого и мышечного слоев; отсутствие элементов нервной ткани; очаговый фиброз и лимфоцитарная инфильтрация подслизистого слоя, выраженный фиброз. По данным Р.Ш. Мовлянова [16], наличие атрофии и фиброза в стенке мочеточника отражается на состоянии почек и сопровождается белковой дистрофией и очаговым некрозом канальцев почек. Эти данные подтверждают участие почек в патологическом процессе при обструктивных уропатиях.
В удаленных почках в наших наблюдениях при гидронефротической трансформации отмечены картина кортикально-медулярной дисплазии, признаки осложненной инфекции (пиелонефрита).
Таким образом, анализ отдаленных результатов лечения детей с мегауретером показывает развитие терминальной ХПН в 14,5 % случаев. У многих пациентов, особенно при возникновении вторичных пузырно-мочеточниковых рефлюксов, можно прогнозировать ХБП с исходом в ХПН. Применение
универсального теста в качестве прогноза – определение уровня СКФ при обструктивных уропатиях при проспективном наблюдении – показало дифференциацию пациентов по этому признаку. Используя критерии К/DОQI, можно отметить, что преобладала I стадия ХБП, далее следовала II стадия болезни, у небольшой части пациентов III и даже V стадии ХБП. Подразделения на стадии не зависели от возраста и пола, хотя среди пациентов на всех этапах преобладали мальчики. Дети с сохраненной функцией почек по уровню СКФ наблюдались с односторонним гидронефрозом. Сохранность функции почек отмечена у большинства детей даже в случаях нефрэктомии, выполненной при поздней диагностике обструктивной уропатии. Оперированная по поводу гидронефроза и сохраненная
почка при проведении динамической сцинтиграфии в последующем функционирует хуже, менее интенсивно растет, но суммарная функция длительно сохраняется нормальной. Мы согласны с мнением М.С. Игнатовой [1], что следует говорить об истинном прогрессировании ХБП только при снижении СКФ менее 60 мл/мин/1,73 м2. Однако применение ингибиторов АПФ надо начинать значительно раньше – при снижении СКФ до уровня II стадии ХБП. У пациентов первых месяцев жизни нередко оказание урологической помощи происходило на фоне сопутствующей патологии – чаще всего
перинатальных повреждений нервной системы, что требует своей коррекции.
Таким образом, можно отметить, что для формирования здоровья ребенка с обструктивными уропатиями и сохранности функции почек необходим междисциплинарный подход с участием уролога, нефролога, а в ряде случаев – неонатолога и невролога с ранним разделением пациентов на стадии ХБП, ориентируясь на рекомендации K/DOQI. Применение пациентами с обструктивной уропатией ингибиторов АПФ следует начинать при снижении СКФ менее 80 мл/мин/1,73 м2.
Несомненно, что в настоящее время улучшается пренатальная диагностика пороков развития, однако еще недостаточно эффективно работает перинатальный консилиум, в частности, в целях предупреждения рождения детей с двусторонним мегауретером.



