Поражение почек – типичный вариант поражения органовмишеней, встречается крайне часто как при гипертонической болезни (ГБ), так и у пациентов с другими сердечно-сосудистыми заболеваниями, особенно когда у них наблюдается сахарный диабет и/или сердечная недостаточность. Длительно единственным вариантом поражения почек при ГБ считали гипертонический нефросклероз (или нефроангиосклероз) – прогрессирующий глобальный нефросклероз, начинающийся со структур почечного клубочка. Однако не менее важной структурой является тубулоинтерстициальная ткань почки (ТИТ), которая выполняет ряд важных функций и, по мнению ряда исследователей, вовлекается в патологический процесс при кардиальной патологии раньше клубочкового аппарата [1], о чем свидетельствуют прямая корреляция выраженности интерстициального фиброза со снижением клиренса креатинина и наличие “атубулярных” нефронов. Таким образом, относительно сохранная клубочковая структура далеко не всегда подразумевает нормальное функционирование нефрона, поэтому при оценке почечной функции и ранней диагностике поражения почек при ГБ важно
использовать методы, оценивающие как функцию клубочка, так и состояние ТИТ. На различных этапах кардиоренального континуума выявляются соответствующие маркеры поражения почки. Чем раньше будет распознан патологический почечный процесс, тем быстрее можно будет на него воздействовать, тем самым замедлив прогрессирование поражения почек, а может быть, и останавив его.
В настоящее время для диагностики поражения почек при гипертонической болезни используются следующие показатели: креатинин сыворотки крови, клиренс креатинина и расчетная скорость клубочковой фильтрации (СКФ), нагрузочные пробы, экскреция белка с мочой и др.
Креатинин
Исследование концентрации креатинина (Кр) сыворотки является обязательным методом лабораторного обследования. Ввиду зависимости его концентрации от ряда факторов (см. таблицу) определение Кр сыворотки недостаточно для оценки функции почек.
Основное место синтеза креатинина – мышечная ткань, в связи с чем первым фактором, влияющим на содержание креатинина крови, является средняя скорость его образования. Не вызывает сомнения, что она выше у мужчин, у молодых, у негроидной расы. Кроме того, содержание креатинина в крови
зависит от ряда других факторов (см. таблицу). Известно, что 40 % лиц со сниженной СКФ имеют содержание креатинина сыворотки в пределах нормы для данной лаборатории [3]. В связи с этим само по себе определение сывороточной концетрации креатинина в настоящее время не рассматривают
как достаточно чувствительный маркер фильтрационной функции почек.
Клиренс креатинина
В 1926 г. Реберг предложил определять СКФ по экзогенному креатинину. Однако этот метод представлял определенные трудности, связанные с необходимостью внутривенного введения экзогенного креатинина. В 1936 г. Е.М. Тареев предложил исследовать СКФ по клиренсу эндогенного креатинина. Было установлено, что концентрация креатинина в плазме крови не подвергается существенным колебаниям и практически постоянна, что исключило необходимость внутривенного
введения экзогенного креатинина. Данные метод известен в практике как проба Реберга–Тареева. Недостаток расчета показателя фильтрации по эндогенному креатинину заключается в том, что креатинин при ряде заболеваний не только фильтруется, но и частично реабсорбируется и секретируется. И хотя обычно реабсорбция и секреция креатинина почти равны по величине, секреция может приводить к завышению истинного значения СКФ. Более точные значения клиренса
креатинина возможно получить у пациентов с легкой и умеренной степенью снижения СКФ после приема циметидина (H2-гистаминоблокатора), поскольку циметидин блокирует канальцевую секрецию креатинина [4, 5]. Этот метод известен с 1981 г., когда в эксперименте на крысах вначале T.D. Мс Kinny, P. Myers, K.V. Speeg исследовали фармакокинетику, фармакодинамику циметидина и секрецию циметидина канальцами почки, а затем М.К. Dutt, P. Moody, Т.С. Nortlifield впервые использовали принцип подавления канальцевой секреции циметидином для объективизации определения клиренса
креатинина в клинической нефрологии. [6] Проблема при оценке СКФ по КК состоит также в необходимости сбора мочи более 24 часов; для пациентов это крайне неудобно, и сбор мочи зачастую производится с погрешностями.
Таблица. Факторы, влияющие на концентрацию креатинина в сыворотке [2, 3].
Оценка клубочковой фильтрации по клиренсу инулина признается “золотым стандартом”, поскольку это физиологически инертное вещество свободно фильтруется клубочком и не секретируется канальцами, а также не подвергается канальцевой реабсорбции. Инулин не связывается с белками плазмы, а размер его молекул меньше размера поры клубочкового фильтра, что позволяет инулину беспрепятственно проникать через него. Поступившая в нефрон вода подвергается последующей
канальцевой реабсорбции, и концентрация в ней инулина резко возрастает. Таким образом, концентрация инулина во вторичной моче во столько раз больше его концентрации в первичной
моче, во сколько раз объем первичной профильтровавшейся мочи в единицу времени больше вторичной мочи, выделяющейся почками в единицу времени. Поскольку концентрация инулина в первичной моче равна его концентрации в плазме крови, в расчетах используют последнюю величину: Uin / Pin = Cin / V, где Uin – концентрация инулин во вторичной моче, Pin – концентрация инулина в плазме крови, Сin – СКФ (объем первичной мочи, фильтрующийся клубочками почек в единицу времени – 1 минута), V – объем вторичной мочи, выделяющейся за единицу времени – 1 минута. Из данной формулы следует, что Сin = (Uin/ Pin) х V.
В случае необходимости оценки СКФ каждой почки в отдельности используются методы прямого и непрямого определения ее по инулину. Метод прямого определения заключается в катетеризации мочеточников, при этом объем мочи и концентрация в ней инулина определяются в каждой порции отдельно. Сущность метода заключается в том, что при постоянном поддержании инулина в крови количество вводимого инулина будет равно количеству экскретируемого инулина обеими почками. Первоначально определяют плазменное очищение по формуле: PC’in = Ain / Pin, где PC’in – плазматическое очищение, Аin – количество вводимого инулина (мг/мин), Pin – концентрация инулина в плазме крови. Далее, получив мочеточниковым катетером мочу из одной почки, по известной формуле определяют СКФ в ней, а также в другой почке, произведя следующее вычисление: С’in = (Ain / Pin) – (U”in / Pin) × V”, где U”in – концентрация инулина в моче, полученной из интактной почки,
V” – объем мочи, полученной по катетеру в единицу времени – 1 минута. Сложной представляется точная регистрация объема мочи, выделенной почкой при катетеризации, в связи с этим был предусмотрен метод непрямого определения данного параметра. Зная концентрацию инулина в пузырной моче (UPin), моче, оттекающей из правого (U”in) и левого (U’in) мочеточников, а также объем мочи в мочевом пузыре (VPin), можно определить объем мочи, оттекающей по катетеру из правого мочеточника (V”in) по формуле: V”in = [(UPin - U’in) / (U”in - U’in)] × V”in [7].
Однако значительная трудность при использовании инулина (как и любого экзогенного вещества, свободно фильтрующегося в клубочках) заключается в том, что необходимо поддерживать постоянную концентрацию этого препарата в крови во время исследования. Определение СКФ таким способом обременительно как для пациента, так и для исследователя, а также требует больших финансовых затрат [8].
В последние годы возникал интерес к сывороточному цистатину С как эндогенному маркеру функционального состояния почек и сердечно-сосудистого риска [9]. Цистатин С характеризуется свободной клубочковой фильтрацией, не подвергается канальцевой секреции. Однако более высокая вариабельность его сывороточного уровня в сравнении с креатинином (75 против 7 %), недостаток информации о калибровке наборов для определения цистатина С и противоречивые результаты
исследований делают доступные данные недостаточными, чтобы рекомендовать измерение цистатина С для широкого клинического применения [10].
Предиктивные формулы
В связи с тем что креатинин сыворотки не является точным показателем уровня почечной функции, а другие методы не более точны, инвазивны или дорогостоящи, все большее распространение получают предиктивные формулы.
Одна из методологически наиболее корректных формул, полученная по данным измерений, выполненных 236 пациентам, была предложена в 1976 г. Кокрофтом и Голтом [11]:

Для женщин результат умножается на 0,85, 1 мг/дл = 88,6 мкмоль/л.
С помощью минимального количества информации о пациенте и одного доступного лабораторного показателя можно оценить функцию почек. Однако недостатком формулы Кокрофта–Голта является то, что она была разработана для клиренса креатинина, а не для СКФ. Крупнейшим оценивавшим формулу Кокрофта–Голта было исследование MDRD (Modification of Diet in Renal Disease Study). По результатам исследования, формула Кокрофта–Голта завышала СКФ на 23 % при клиренсе креатинина < 60 мл/мин. При наличии ожирения или отеков значение СКФ, напротив, занижается [9]. Кроме того, формула Кокрофта–Голта разработана на группе мужчин, а для женщин предложен корректирующий
коэффициент.
Поэтому в последние годы все большее признание получает формула, разработанная в ходе выполнения исследования MDRD. Данное проспективное рандомизированное многоцентровое исследование продолжительностью в среднем 2,2 года проводилось с целью изучения влияния ограничения поступления белка с пищей и жесткого контроля АД на прогрессирование почечной патологии [12].
В начальный период данного исследования были включены 1785 пациентов с хронической патологией почек, у 1628 из которых измерялись СКФ (как почечный клиренс 125 I-иоталамата), клиренс креатинина (с помощью определения экскреции креатинина в моче, собранной за 24 часа,
единократного измерения сывороточного креатинина) и основные показатели, влияющие на их отношение. Именно на основании анализа данных этих пациентов была проведена другая работа, целью которой явилась разработка уравнения из исследования MDRD, с помощью которого можно
улучшить предсказание СКФ по уровню креатинина сыворотки крови. Выведенная формула включила 6 достоверных переменных: возраст, пол, расу, креатинин сыворотки, азот мочевины сыворотки, азот мочевины мочи/уровень альбумина крови: КФ = 6,09 × (креатинин сыворотки в ммоль/л)-0,999 ×
(возраст)-0,176 × (0,762 для женщин) × (1,18 для афроамериканцев) × (мочевина сыворотки в ммоль/л)-0,17 × (альбумин сыворотки в г/л)0,318.
Больший возраст и женский пол были независимыми предикторами более низкой СКФ, отражающими хорошо известную зависимость мышечной массы от возраста и пола. Негроидная раса была независимым предиктором большей СКФ (из-за большей мышечной массы). Более низкая экскреция азота мочевины мочи также являлась независимым предиктором более низкой СКФ, что может отражать связь между меньшим потреблением белка с меньшей СКФ [13].
Преимущества формулы MDRD состоят в том, что она выведена на основании непосредственно измеренной СКФ методом определения мочевого клиренса 125I-иоталамата, изучения большой группы пациентов (более 500) с широким диапазоном заболевания почек, включения в исследуемую
группу белых и афроамериканцев, подтверждения в большой отдельной группе лиц (более 500) как части процесса разработки формулы. Отсутствие веса в формуле позволяет избегать ошибки при отеках и ожирении.
В дальнейшем было проведено дополнительное исследование для выведения формулы с меньшим количеством переменных для упрощенной оценки СКФ. Данное уравнение (4-вариабельное) включило возраст, пол, расу и сывороточный креатинин:

Cокращение формулы не снижает ее точности в предсказании СКФ, но исключение из формулы некоторых лабораторных данных снижает стоимость определения, снижается подверженность смещению оценок лабораторных данных из-за калибровки аналитических методов и изменений, вносимых в их результаты за счет другой, не почечной, патологии. Расчеты по данной формуле можно выполнить, используя доступные непосредственно в Интернете и загружаемые калькуляторы (web-сайт NKF-DOQI www.kdoqi.org.)
Однако расчет СКФ по данной формуле менее точен для пациентов с незначительным снижением почечной функции, нормальной или повышенной СКФ, поскольку за счет гиперфильтрации поддерживается нормальный уровень СКФ. Кроме того, в данном исследовании приняло малое число больных с СКФ более 90 мл/мин, поэтому вопрос о правомерности использования данной формулы для пациентов с нормальным и высоким уровнем СКФ спорен [14]. Установлено, что MDRD занижала значения СКФ по сравнению с измеренной на 6,2 % у пациентов с хроническим заболеванием почек и на 29 % при нормальном и высоком уровне СКФ. Таким образом, переоценивалась распространенность хронической почечной патологии в популяции [15].
Поэтому в клинике Mayo была разработана формула, для создания которой в исследование включались как пациенты с ХПН (320 человек), так и здоровые люди (580 человек) [16]:
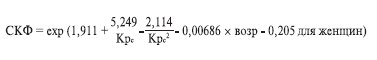
Преимущества формулы Mayo очевидны, она может использоваться для скрининга, когда диагноз хронического заболевания почек не установлен.
Нагрузочные пробы
Для выявления нарушения функции почек применяются также функциональные нагрузочные пробы, самым распространенным из которых является определение функционального почечного резерва (ФПР) путем использования белковой нагрузки. Способ определения ФПР с помощью белковой
нагрузки известен с 1951 г., когда Т. Addis впервые выявил повышение СКФ вследствие употребления высокобелковых диет. Однако использование белка в качестве нагрузочной пробы впервые вошло в практику лишь в 1983 г. (J.P. Bosh). J.P. Bosh впервые и предложил название “определение функционального почечного резерва” [17]. Позже и в других экспериментальных и клинических исследованиях показан значительный эффект влияния приема белка на СКФ [18]. Суть метода заключается в пероральном или парентеральном применении белка либо аминокислот (обычно в качестве нагрузки используют отварную несоленую говядину из расчета 5 г на 1 кг массы тела) с последующим сравнением нестимулированной СКФ (или клиренса креатинина) со стимулированной белком (через 2 часа после нагрузки в условиях адекватного водного режима). ФПР рассчитывают
по формуле: ФПР = ((R2–R1)/R1) × 100 %, где R1 – исходная величина СКФ, R2 – величина СКФ после проведения пробы [19]. Значения СКФ стандартизируют путем перерасчета на 1,73 м2 поверхности тела.
Сохранным считается ФПР более 10 %, сниженным – от 5 до 10 %, ФПР менее 5 % и при отрицательных его значениях – отсутствующим. Однако Luca De Nicola и соавт., исследовавшие ФПР на экспериментальных моделях (крысы с артериальной гипертензией [АГ]), подчеркивают, что снижение ФПР не всегда связано с клубочковой гипертензией и снижение проксимальной тубулярной реабсорбции значительно коррелирует с потерей ФПР, что указывает на важную роль функции канальцев на клубочковую гемодинамику и ответ на белковую нагрузку [20].
Определение почечного кровотока
Позволяет оценить состояние клубочков и выявить внутриклубочковую гипертензию. Определение почечного кровотока выполняется посредством прямых и непрямых методов. Прямой, или инвазивный, метод (почечная флоуметрия) используется редко, поскольку является весьма трудоемким. Существуют непрямые методы регистрации почечного кровотока, к которым относятся метод клиренса веществ,
секретируемых почечными канальцами (парааминогиппуровая кислота (ПАГ), гиппуран, диодраст), радионуклидный клиренс – тесты с использованием 131I-гиппурана, допплерография. В основе метода клиренс с ПАГ лежит способность клеток почечных канальцев к секреции ПАГ, при этом однократное
прохождение ПАГ через почки приводит к ее 90 %-ному извлечению из плазмы крови. Это позволяет рассчитывать эффективный почечный плазмоток, т. е. тот объем плазмы крови, который происходит через корковое вещество почки в единицу времени. Очищение от ПАГ определяется по формуле: Спаг = (Uпаг / Рпаг) × V, где Uпаг, Pпаг – концентрация ПАГ в моче и плазме крови. При вычислении эффективного почечного кровотока (ERF) учитывается гематокрит (Ht), поскольку клетки крови не содержат ПАГ: ERF = Спаг / (1 - Ht). При расчете общего почечного кровотока надо учитывать, что часть ПАГ остается в венозной крови после прохождения через почки, коэффициент извлечения ПАГ рассчитывается по формуле: Епаг = (Ра паг – Рв паг) / Ра паг, где Ра паг и Рв паг – концентрация ПАГ в артериальной и венозной крови почки. Зная Епаг, можно определить общий почечный кровоток по формуле: RF = Cпаг / [(1 - Ht) × Епаг]. В норме эффективный почечный кровоток составляет 600–655 мл/мин на 1, 73 м2 [7].
Не менее значимым показателем внутриклубочковой гипертензии является фильтрационная фракция (ФФ), которая определяется по формуле: ФФ = СКФ / (ПП × 100) %, где ПП – почечный плазмоток. В норме фильтрационная фракция составляет 18–20 %. При внутриклубочковой гипертензии происходит повышение фильтрационной фракции более 20–22 %.
Экскреция белка с мочой
Персистирующая повышенная экскреция белка обычно является маркером повреждения почки. В моче можно обнаружить как фильтруемые белки (α1-, α2-, β2-микроглобулины, лизоцим), так и образующийся в мочевом тракте белок Тамма–Хорсфалля (крупный гликопротеид, основной представитель белка, образующегося в мочевом тракте) и составляющий примерно 50 % всех белков мочи; секретируется толстой восходящий петлей Генле и является главным компонентом гиалиновых цилиндров, которые находят в нормальной моче) [21]. Экскреция определенных типов белка зависит от типа повреждения почки. Увеличенная экскреция альбумина является чувствительным маркером поражения клубочков при АГ. Существуют качественные и количественные методы оценки экскреции белка с мочой. Качественное определение экскреции белка с мочой для первоначальной оценки состояния почек выполняют с использованием тест-полосок. Для количественного определения экскреции альбумина с мочой используются радиоиммунные, иммуноферментные и иммунотурбидиметрические методы. Измерение экскреции белка за 24 часа долгое время считалось “золотым стандартом” для количественной оценки протеинурии. Альтернативным методом количественной оценки протеинурии служит измерение отношения белок/креатинин или альбумин/креатинин в нефиксированном по времени произвольном образце мочи. Соотношения белок/креатинин и альбумин/креатинин в моче дают точную оценку экскреции белков и альбумина с мочой и не подвержены влиянию гидратации. Предпочтительна первая утренняя порция мочи, поскольку она лучше коррелирует с 24-часовой экскрецией белка. Если первая утренняя порция
мочи недоступна, приемлем произвольный образец мочи [3]. Если на сегодняшний день не вызывает сомнения, что микроальбуминурия является ранним маркером поражения клубочка, важным вопросом остается наличие белков-маркеров поражения тубулоинтерстициальной ткани почек (ТИТ).
A.B. Magil в 1995 г. впервые выявил связь между уровнем протеинурии и морфологическими признаками тубулоинтерстициального повреждения [22]. В последующих исследованиях у пациентов с различными формами нефрита (IgA-нефропатией, мембранозным и мезангиокапиллярным ГН, ФСГС) была выявлена прямая корреляция между уровнем протеинурии и выраженностью инфильтрации интерстиция моноцитами и Т-лимфоцитами [23, 24]. Однако в последние годы наибольшее признание получила теория тубулоинтерстициального воспаления и ишемии, которые развиваются под действием на тубулярный эпителий профильтрованных белков и связанных с ними макромолекул [26–27]. О том, что повышенное количество белка, профильтрованного через гломерулярные капилляры, может обладать “внутренней нефротоксичностью” и способствовать прогрессированию почечной болезни, впервые
предположили T. Bertani и G. Remuzzi в 1986 г. [28, 29].
На экспериментальных моделях показано, что белковая нагрузка у крыс с уже имеющимся поражением ТИТ ведет к более быстрому и тяжелому повреждению почек, ранними и чувствительными маркерами чего являются два белка: ламинин указывает на повреждение базальной мембраны, а калликреин – на поражение дистальных канальцев [30]. Известно, что синтез ламинина стимулирует ТGF-beta, как и других белков экстрацеллюлярного матрикса.
Опыты in vitro и in vivo на крысах показали, что процесс реабсорбции фильтруемых белков активирует эпителий проксимальных канальцев. Биохимическая реакция, связанная с активацией клеток канальцев в ответ, приводит к повышению синтеза вазоактивных и воспалительных генов и синтезу
таких белковых субстанций, как эндотелий, моноцитарный белок-хемоаттрактант и регулируемые активацией нормально экспрессируемые и секретируемые Т-клетки (Regulated upon Activation, Normal T-cell Expressed and Secreted - RANTES). Это зависит от активности транскриптирующего нуклеарного фактора-бета (NF-B) через формирование свободных радикалов кислорода.
Функциональная активность фильтруемых белков или протеин-связанных молекул может вносить вклад в патогенетический потенциал усиленного движения белков. Воспалительные и вазоактивные вещества, секретированные в большом количестве проксимальными канальцами, выделяются по направлению к базолатеральному отделу клетки и вызывают рост воспалительной реакции в интерстиции, ведущей к сморщиванию почки. Ремоделирование архитектоники интерстиция также может возникнуть как результат фенотипической трансформации клеток канальцев, что было доказано на крысах со снижением почечной массой, у которых клетки эпителия канальцев превращаются в фибробласты в местах повреждения и начинают выделять фибробласт-специфические белки. Большинство таких процессов может ускоряться цитокинами, выделяемыми
клетками эпителия канальцев и воспалительными клетками, которые аккумулируются в интерстиции при протеинурии [31].
Медиаторы фиброгенеза и другие маркеры поражения тубулоинтерстициальной ткани почек
В настоящее время о поражении ТИТ нельзя судить по рутинным показателям: требуются более сложные и чувствительные маркеры. Большинство из них было изучено при гломерулонефритах, в то время как исследованию ТИТ при ГБ посвящено крайне мало работ. Особое внимание привлекает определение мочевой экскреции отдельных медиаторов фиброгенеза (в частности, трансформирующего фактора роста-β1 [TGF-β1] его продуктов (коллаген IV типа), сосудисто-эндотелиального фактора роста (VEGF) и компонентов эндотелий-зависимого звена гемостаза (ингибитор активатора плазминогена типа 1 – PAI-1). TGF-β – мультифункциональный цитокин, впервые выделенный из тромбоцитов в 1990-х гг. [32]. Свое название TGF-β получил благодаря способности стимулировать рост клеток и вызывать их трансформацию in vitro.
TGF-β в норме является важным регулятором клеточной пролиферации, дифференцировки, апоптоза, иммунного ответа, ремоделирования экстрацеллюлярного матрикса [33]. Высокий уровень TGF-β найден в тромбоцитах и костной ткани, in vitro он продуцируется клетками многих типов [34].
Выделено три типа специфических высокоаффинных рецепторов для TGF-β (I, II и III типа), которые экспрессируются многими клетками [32].
Несмотря на то что in vitro три изоформы TGF-β оказывают однонаправленный эффект на клетки, считают, что in vivo наиболее профиброгенным является TGF-β1, т. к. повышение синтеза этой изоформы показано у человека при заболеваниях, сопровождающихся выраженным фиброзом ткани почки. У пациентов с различными нефропатиями степень экспрессии TGF-β1 в ткани почки коррелирует с площадью интерстициального фиброза [35].
Однако T. Yamamoto и соавт. полагают [36], что все три изоформы TGF-β играют роль в прогрессировании гломерулосклероза и интерстициального фиброза. Иммуногистохимическим методом была отмечена выраженная экспрессия трех изоформ TGF-β в гломерулах и интерстиции при различных формах нефрита (IgA-нефропатии, фокально-сегментарном гломерулосклерозе, нефрите с полулуниями и диффузном пролиферативном волчаночном нефрите), сопровождающихся накоплением фибронектина, а также ингибитора активатора плазминогена-1(PAI-1). Повышение количества мРНК TGF-β всех изоформ отмечено в клубочках, а также в перигломерулярных и тубулоинтерстициальной областях, местах макрофагальной инфильтрации и отложений эндоплазматического ретикулума. В интерстиции TGF-β экспрессировался макрофагами, а также клетками канальцев с перитубулярной мононуклеарной инфильтрацией и артерий с утолщенной интимой [36].
МСР-1 был впервые идентифицирован как продукт секреции моноцитарных лейкемических клеток, стимулированных липополисахаридом, а также мононуклеарных клеток периферической крови [37]. МСР-1 является не только хемоаттрактантом, обеспечивающим миграцию и экстравазацию мононуклеарных клеток в очаг воспаления, но и медиатором воспаления, при этом активируя резидентные клетки. Увеличение количества МСР-1 в моче выявлено у животных с прогрессирующими
почечными заболеваниями, его уровень в моче коррелирует с экскрецией альбумина [38]. С помощью иммуногистохимических методов и гибридизации in situ показано, что в ткани почки человека МСР-1 экспрессируется тубулярными эпителиальными клетками, мононуклеарными клетками инфильтрата в зонах интерстициального воспаления и эндотелиальными клетками сосудов [39, 40]. Таким образом, согласно большинству исследований, проведенных при заболеваниях почек у животных и человека, МСР-1 играет важную роль в прогрессировании ГН и развитии почечной недостаточности, главным образом за счет формирования тубулоинтерстициального повреждения. Активация синтеза МСР-1 является общим патофизиологическим механизмом прогрессирования тубулоинтерстициального повреждения и фиброза как при воспалительных нефропатиях, так и при невоспалительных заболеваниях почек, протекающих без выраженных обострений [41], например при АГ.
В связи с этим профилактика и торможение прогрессирования гипертонического поражения почек должны быть основаны на применении антигипертензивных препаратов, оптимизирующих функцию гломерулярных эндотелиоцитов [42].
В одном из исследований были оценены поражение канальцев у больных ХСН и взаимосвязь с СКФ, снижение которой является доказанным маркером плохого прогноза у данной категории пациентов. Девяноста пациентам измерялись СКФ и эффективный почечный плазмоток (ЭПП). Определялись канальциевые маркеры – нейтрофил желатиназ-ассоциированный липокалин (NGAL), N-ацентил-β-D-глюкозаминидаза (NAG) и молекула повреждения почек 1 (KIM-1), экскреция альбумина с мочой
(из 24-часовой мочи). Средняя СКФ составила 78 ± 26 мл/мин/1,73 м2. Уровни NGAL (175 (70–346) μг/г креатинина (гCr)), NAG (12 (6–17) U/гCr) и KIM-1 (277 (188–537) нг/гCr) были повышены по сравнениию с группой контроля (20 здоровых людей), (p < 0,001 для всех показателей). NAG мочи, но не NGAL или KIM-1 коррелировали с СКФ (r = -0,34; p = 0,001) и ЭПП (r = -0,29; p = 0,006). Как NAG (r = 0,21; p = 0,048), так и KIM-1 (r = 0,23; p = 0,033) коррелировали с сывороточным уровнем натрийуретического пептида NТ-pro-BNP. Рост мочевой концетрации как KIM-1 (HR = 1,15 (95 % СI 1,02–1,30) на повышение 100 нг/гCr, p = 0,025), так и NAG (HR = 1,42 (95 % CI 1,02–1,94) на повышение 5 U/гCr, p = 0,039) был ассоциирован с повышенным риском смерти и госпитализаций, связанных с сердечной недостаточностью, вне зависимости от СКФ. Таким образом, отмечена высокая распространенность поражения канальциевого аппарата у больных ХСН и важность маркеров поражения канальцев, которые играют прогностическую роль вне зависимости от СКФ [43, 44].
Натрийурез и провокационные пробы
Важнейшей функцией почек является поддержание гомео стаза натрия, калия и других электролитов. Как упоминалось выше, ряд исследователей полагают, что первым обнаруживаемым изменением почек при АГ является поражение тубулоинтерстициального аппарата, а именно нарушение натрийуреза [1, 45–47].
У здорового человека экскреция Na+ с мочой прямо пропорциональна количеству Na+ в организме, в результате чего количество Na+ колеблется незначительно, хотя поступление в организм может колебаться в значительных пределах.
Не оспаривается положительная роль низкосолевой диеты. Так, недавно доказано ее положительное влияние и на оксигенацию почечной ткани. Так, в работе M. Pruijm и соавт. измерялись гемодинамика, реабсорбция Na, оксигенация почечной ткани у 10 нормотензивных мужчин (средний возраст – 26,5 ±
7,4 года) и у 8 больных АГ (средний возраст – 28,8 ± 5,7 года) через неделю диеты с высоким и низким содержанием соли. Оксигенация кортикальной ткани не различалась на разных диетах, однако медуллярная оксигенация была гораздо выше при низкосолевой диете. У нормотензивных людей оксигенация медуллы положительно коррелировала с реабсорбцией натрия в проксимальных какнальцах и отрицательно – с абсолютной дистальной реабсорбцией натрий, но не с почечным плазмотоком. У больных с АГ оксигенация медуллы коррелировала с 24-часовой экскрецией натрия [48].
Так как Na+ фильтруется в клубочке и реабсорбируется, но не секретируется в канальцах, количество экскретируемого Na+ во вторичной моче может определяться только клубочковой фильтрацией и канальцевой реабсорбцией. Сегодня считается, что: а) реабсорбция Na+ более важна, чем CКФ; б) регуляция экскреции Nа+ зависит от величины среднего АД; в) существует прямая зависимость между уровнем Na+ в организме, объемом внеклеточной жидкости и плазмы и средним АД. Задержка Na+ в организме даже при сохраненной СКФ (!) подразумевает увеличенный объем плазмы, т. е. перегрузку объемом. Кроме того, уровень реабсорбции Na+ и Cl- в macula densa играет эволюционно ведущую роль в регуляции синтеза ренина. Увеличение реабсорбции Na+ и Cl- генерирует рост синтеза и
секреции аденозина и вызывает торможение высвобождения ренина. Рост уровня ренина и А II приобретает патологическое значение, приводя к активации симпатической нервной системы и повышенной секреции альдостерона [49]. Альдостерон в свою очередь способствует перераспределению натрия из внеклеточной жидкости внутрь клеток в результате повышения
проницаемости клеточных мембран, в т. ч. и гладкомышечных волокон стенок периферических артерий, в результате чего растет периферическое сосудистое сопротивление. Со своей стороны задержка натрия в сосудистой стенке артерий приводит к повышению жесткости и тонуса (за счет повышения чувствительности рецепторов артерий к циркулирующим в плазме крови прессорным аминам) сосудов. В итоге значительно изменяются показатели центральной гемодинамики (индекс аугментации, скорость пульсовой волны, центральное артериальное давление [АД]) и ухудшается прогноз пациента. Кроме того, в результате каскада снижается почечный кровоток и происходит задержка Na+ и Н2О в организме.
В ответ на гиперволемию и растяжение правого предсердия включается компенсаторный механизм, повышается выработка предсердного натрийуретического пептида (BNP). BNP – 32-аминокислотный пептид, который синтезируется в основном в желудочках сердца и в малом количестве в клетках клубочков почек. Физиологическое действие BNP – это нивелирование эффектов при гиперактивации РААС, симпатической нервной системы и эндотелина-1. В почке BNP стимулирует натрийурез и повышает СКФ, а также приводит к расслаблению гладкомышечной мускулатуры, тем самым снижая АД и преднагузку [50].
Однако существует мнение, что снижение натрийуреза у некоторых лиц может быть обусловлено как физиологическим дефектом почек (необходимостью в большем и более длительном повышении АД для выведения определенного количества натрия [51, 52]), так и (с анатомической особенностью)
врожденным дефицитом количества нефронов, что приводит к повышенной реабсорбции натрия [53, 54].
Выявить недостаточность экскреторной способности почек даже во время компенсации данной функции можно с помощью провокационных проб – солевой нагрузки, которая проводится с помощью либо гипертонического (10 %), либо физиологического раствора хлорида натрия раствора [45]. Ответ
на нагрузку у пациентов с АГ отличается вариабельностью – по некоторым данным, у них развивается натрийурез, значительно превышающий таковой у здоровых людей [55–57], либо (преимущественно у больных с высоким нормальным давлением и начальными стадиями АГ) более позднее нарастание натрийуреза или даже его снижение [46, 47].
Однако важно помнить, что не только снижение натрийуреза оказывает негативное воздействие на ТИТ и функцию почки в целом, но и чрезмерное его повышение (либо слишком жесткое ограничение потребления NaCl). Так, на экспериментальной модели (крысы с односторонней нефрэктомией с индуцированной циклоспорином тубулоинтерстициальной нефропатией) показано, что при диете с малым содержанием соли поражение ТИТ было ограниченным в сравнении с группой, получавшей
большое количество NaCl при одинаково сниженной СКФ. На 28-й день после отмены циклоспорина наблюдалась значительная диссоциация между морфологией почки и функцией в 1-й группе, поскольку СКФ вернулась к норме, но поражение ТИТ оставалось прежним и даже прогрессировало. Таким образом, потребление соли – важный предиктор изменения ТИТ, в то время как снижение СКФ не зависит от потребления соли.
Результаты данного исследования заставляют помнить, что слишком жесткое ограничение потребления соли и агрессивное применение диуретиков, ведущее к массивному натрийурезу, также неблагоприятно для больных. Поэтому надо следить за тем, чтобы не было как задержки NaCl, так и его избыточного выведения [58].
Инструментальные методы исследования
Внутривенная, или экскреторная, урография позволяет судить о функциональном состоянии почек, их размерах. Инфузионная урография позволяет получать контрастирование чашечно-лоханочной системы и мочеточников у больных со сниженной функциональной способностью почек. Но данный
метод редко применяется среди больных с АГ для диагностики поражения почек в связи с сложностью его проведения, низкой информативностью на ранних стадиях. А также высокой вероятностью возникновения тяжелых осложнений, таких как аллергические реакции на введение контраста, и даже
ОПН.
Радиоизотопная ренография основана на свойстве канальцев эпителия почек избирательно извлекать радиоактивный йод из кровотока с последующим выведением его с мочой. Этот метод используется для выявления нарушений функциональной способности почек на ранних стадиях, оценки динамики почечного процесса, для контроля динамики состояния почек при лечении. Одно из главных преимуществ метода – раздельная оценка и возможность сравнения функции правой и левой почек. Данное исследование нетравматично, не требует специальной подготовки больного и не оказывает значительного лучевого воздействия. При этом дифференциально-диагностическая ценность метода весьма относительна. Изменение ренограммы не имеет нозологической специфики,
а лишь позволяет установить, на каком уровне нарушена функциональная способность почек [59]. Но данный метод редко рутинно используется для диагностики поражения почек при гипертонической болезни из-за высокой стоимости и не доступности для некоторых ЛПУ.
Компьютерная томография (КТ) позволяет дифференцировать ткани, особую ценность представляет для диагностики объемных процессов в почках. Для повышения информативности используется внутривенное введение контрастного вещества. В отличие от КТ, МРТ позволяет получать послойное изображение почек. Также МРТ обеспечивает более высокую четкость изображения сосудов и околопочечных структур. Эти методы чаще используются для оценки структуры почки, диагностики
объемных образований. При гипертонической болезни с поражением почек на ранних стадиях имеют достаточно низкую информативность.
Гистологическое исследование почек в ряде случаев позволяет не только определять характер патологических изменений, но и прогнозировать эффективность проводимой терапии, риск неблагоприятного исхода, темпы потери почечной функции. В анализе нефробиоптата применяется световая, иммуногисто-химическая и электронная микроскопия [7]. Однако биопсия почек при повреждении ТИТ не позволяет выявлять причину, а показывает лишь неспецифические изменения почечной ткани как интерстициальный фиброз, атрофию канальцев, склероз сосудов. К недостаткам данного исследования относятся также его инвазивность, длительная подготовка пациента к исследо-
ванию, невозможность его применения на ранних стадиях ГБ и выполняется только в специализированных нефрологических отделениях по строгим показаниям.
Сцинтиграфия почек, или радионуклидное сканирование почек (реносцинтиграфия, нефросцинтиграфия), – это диагностический метод исследования, который включает введение
в организм небольшого количества радиоактивного медицинского препарата (радиоактивной метки, например иоталамат, меченный J125, этилендиаминтетраацетат [ЭДТА], меченный Cr51 или Tcm99) и получение изображения почек при помощи гамма-камеры. В целом сцинтиграфия проводится для
выявления, оценки и/или количественной оценки почечной функции, врожденных и приобретенных аномалий строения, обструкции, реноваскулярных заболеваний, пиелонефрита и фиброза паренхимы, функциональных и анатомических аномалий трансплантированных почек, параметров почечной
функции, включая эффективный плазмоток, СКФ и почечную функцию каждой почки. В отличие от методов, позволяющих получать информацию о структуре почек, радионуклидное исследование дает возможность изучать функцию каждой почки отдельно. С помощью сцинтиграфии оценивают также
кровоток в каждой почке. Для изучения функции канальцев используется радиоактивный медицинский препарат технеций, DMSA (Tc99m DMSA). B.H. Lee показал, что технеций (99m) Tc-DMSA фильтруется в почечных клубочках и затем подвергается опосредованному мегалином и кубилином эндоцитозу
в проксимальных канальцах, поэтому при снижении его поглощения почкой у пациентов даже с нормальным клиренсом креатинина можно говорить о поражении проксимальных канальцев [60]. Недостатком данного метода является его малодоступность в большинстве ЛПУ и невозможность его
применения как скринингового метода обследования функции почек.
Таким образом, инструментальные методы могут быть полезными для диагностики вторичной гипертензии или уже на далеко зашедших стадиях поражения почек, но, как правило, малоинформативны на ранних стадиях поражения почек при АГ.
Таким образом, ранняя диагностика поражения почек при ГБ остается крайне актуальной проблемой современной кардиологии. Выявление маркеров раннего поражения клубочкового аппарата и тубулоинтерстициальной ткани позволят предотврашать прогрессирование почечного континуума до терминальной почечной недостаточности и оценивать эффективность лекарственных средств на ранних этапах заболевания.



