Введение
Проблема кардиоренальных взаимоотношений в настоящее время рассматривается в качестве одной из наиболее актуальных в клинике внутренних болезней. Установление единых патогенетических механизмов развития и прогрессирования сердечно-сосудистой и почечной патологии позволило определить концепцию кардиоренального синдрома [1]. Анализ статистических данных свидетельствует о широкой распространенности почечной дисфункции при наличии заболеваний сердечно-сосудистой системы [2], возникновение которой является маркером прогрессирования кардиальной патологии и высокого риска сердечно-сосудистых осложнений [3, 4].
В последнее время наблюдается отчетливая тенденция к росту числа хирургических методов лечения ишемической болезни сердца (ИБС). Основными критериями эффективности выполненных операций по восстановлению коронарного кровотока являются снижение частоты развития сердечно-сосудистых событий и улучшение качества жизни пациента, проявляющееся в повышении толерантности к физическим нагрузкам. Рецидив стенокардии после коронарной реперфузии может быть показанием к повторной реваскуляризации миокарда, что является неблагоприятным для пациента, особенно в случае повторного коронарного шунтирования (КШ), а также увеличивает затраты на лечение таких больных. Поэтому тщательный мониторинг факторов риска (ФР), имеющихся у больных с показаниями к реваскуляризации миокарда, с учетом их комплексного потенцирующего влияния является необходимым диагностическим этапом в выявлении группы пациентов высокого риска развития рецидива стенокардии после коронарной реперфузии. Вместе с тем определение новых и уточнение влияния существующих почечных ФР позволяют оптимизировать стратификацию риска развития сердечнососудистых событий после реваскуляризации миокарда.
Целью настоящего исследования явилась оценка влияния почечных факторов риска и параметров коронарной бляшки у больных ИБС с показаниями к реваскуляризации миокарда на риск развития рецидива стенокардии после коронарного вмешательства.
Материал и методы
В исследование были включены 90 пациентов (80 мужчин и 10 женщин) с ИБС и показаниями к восстановлению коронарного кровотока. Средний возраст пациентов составил 56,1 ± 0,9 года, длительность ИБС — 6,1 ± 0,6 года. Клиническая характеристика пациентов, принявших участие в исследовании, представлена в табл. 1.
Таблица 1. Клиническая характеристика обследуемых пациентов.
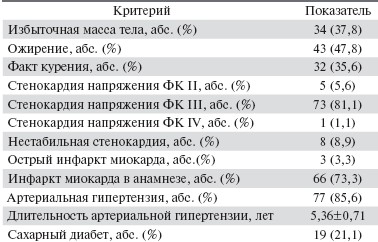
Критерием включения в исследование стали данные коронароангиографии (КАГ), по результатам которой устанавливалась необходимость в выполнении операций по восстановлению коронарного кровотока. На основании полученных коронарограмм 64 пациентам было выполнено КШ, 26 больным — стентирование коронарных артерий (КА).
Для реализации поставленной цели исследования среди всех обследованных пациентов до реваскуляризации миокарда регистрировалось наличие почечных ФР, таких как микроальбуминурия (МАУ), хроническая болезнь почек (ХБП) и β2-микроглобулинурия.
Наличие МАУ определялось в свежесобранной утренней порции мочи с помощью тест-полосок “Урибел”. На основании полученных данных полуколичественной оценки МАУ устанавливался средний ее уровень у исследуемых пациентов.
Стадии ХБП регистрировались на основании общепринятой классификации ХБП (K/DOQI, 2002): по степени снижения скорости клубочковой фильтрации и наличию признаков почечной дисфункции. Скорость клубочковой фильтрации рассчитывалась по формуле Кокрофта—Голта.
Для определения концентрация β2-микроглобулина (β2-МГ) в моче использовался непрямой твердофазный иммуноферментный анализ (ELISA).
К параметрам, отражающим особенность поражения коронарного русла, были отнесены показатели максимального стеноза КА и площади атеросклеротической бляшки (АБ) КА с максимальным стенозом. Полученные результаты КАГ позволили установить диаметр КА и степень максимального стеноза КА для каждого пациента, включенного в исследование. Расчет площади (S) КА осуществлялся для артерии сердца с максимальным стенозом из установленного по данным КАГ диаметра КА по известной формуле: S КА = п d2/4, где п - 3,14, d2 — диаметр КА в квадрате (мм2). Поскольку поперечные сечения КА и АБ имеют форму круга, S АБ рассчитывалась по формуле: S АБ = S КА х Х / 100% (мм2), где Х — максимальный уровень стеноза (%).
Для определения наличия рецидива стенокардии спустя 6,3 ± 0,1 месяца после реваскуляризации миокарда все обследованные пациенты выполнили тест 6-минутной ходьбы, по результатам которого был установлен функциональный класс (ФК) стенокардии.
Статистический анализ данных проводился с использованием определения среднего значения выбранных параметров и их ошибки, вычисления критерия достоверности Стьюдента (р), а также с помощью χ-критерия осуществлялся анализ нелинейной оценки для определения влияния исследуемых факторов.
Результаты и обсуждение
По результатам проведенного исследования выявлена высокая распространенность почечных ФР среди обследованных больных. Так, наличие МАУ было определено в 91,1 % случаев (82 пациента) со средним ее уровнем 110 ± 7 мг/л, частота встречаемости ХБП составила 97,8 % (88 пациентов). Необходимо отметить, что большинство больных, включенных в исследование, имели ХБП 1-й стадии (46 пациентов — 52,3 %). ХБП 2-й стадии обнаружена у 27 (30,7 %) пациентов, 3-й стадии — у 12 больных (13,6 %). Средний уровень β2-МГ в моче, определенный до коронарной реперфузии, установлен в пределах 0,29 ± 0,09 мг/мл, что соответствует верхней границе лабораторной нормы для данного показателя.
После завершения статистической обработки первичного материала оказалось, что рецидив стенокардии имели 42 (46,7 %) пациента, у 16 (38,1 %) из которых был определен I ФК, у 18 (42,9 %) — выявлен II ФК, а у 8 (19,0%) больных зарегистрирован III ФК стенокардии.
На основании логистического регрессионного анализа установлено, что наличие МАУ перед восстановлением коронарного кровотока достоверно не влияет на вероятность развития рецидива стенокардии после коронарной реперфузии (χ-критерий — 2,8, р = 0,09). Однако в ходе статистической обработки первичного материала осуществлялся поиск достоверных отличий в количестве установленных эпизодов рецидива стенокардии в группах пациентов, градация которых производилась методом подбора на основании уровня МАУ. Установлено, что число больных с уровнем альбумина в моче не менее 150 мг/л составило 25, из которых рецидив стенокардии после реваскуляризации миокарда установлен у 18 (72 %) больных. Уровень альбумина в моче ниже 150 мг/л определен у 65 больных, а рецидив стенокардии после реваскуляризации миокарда выявлен у 24 (37 %) пациентов. При сравнении полученных данных определены достоверные (р< 0,01) различия между группами.
Логистический регрессионный анализ показал, что при наличии МАУ ≥150 мг/л до реваскуляризации миокарда риск развития рецидива стенокардии после восстановления коронарного кровотока повышается на 33,9 % (χ-критерий — 8,43, р = 0,004).
Достоверного влияния на вероятность развития возвратной стенокардии при анализе других исследуемых почечных ФР, таких как наличие (χ-критерий — 2,64, р = 0,1) и стадия (χ-критерий — 0,62, р = 0,4) ХБП, уровень β2-МГ в моче (χ-критерий — 1,56, р = 0,2), выявлено не было.
По данным КАГ установлено, что средние значения максимального стеноза КА составили 89,1 ± 1,0 %, характеризующиеся как субтотальные стенозы, а S АБ КА достигла 7,5 ± 0,2 мм2. Установлено, что с увеличением степени максимального стеноза КА риск развития рецидива стенокардии повышается (χ-критерий — 9,51, р = 0,002). Так, при наличии максимальных стенозов КА 50—70 %, являющихся гемодинамически незначимыми, вероятность развития послеоперационной стенокардии составляет 3,2—14,2 %. При сужении просвета КА до 80 % риск рецидива стенокардии повышается до 26,9 %, стеноз 90 % сопровождается увеличением риска до 45,0 %, а окклюзия КА — до 64,6 %. То же было выявлено и для изучаемого параметра S АБ КА. Оказалось, что средняя величина S АБ у пациентов с рецидивом стенокардии (8,7 ± 0,26 мм2) достоверно превышала указанный показатель больных без стенокардии (8,3 ± 0,3 мм2) после реваскуляризации миокарда (р = 0,01). Установлено, что риск развития рецидива стенокардии повышается с увеличением величины S АБ КА (χ-критерий — 6,15, р = 0,01) (см. рисунок).
Рисунок. Вероятность развития рецидива стенокардии после реваскуляризации миокарда с учетом S АБ в месте максимального стеноза.
Необходимо отметить, что S АБ в исследовании рассчитывалась для каждой КА с выявленным максимальным стенозом. Поскольку средние значения максимального стеноза в общей группе пациентов составляли 89,1 ± 1,0 %, при интерпретации результатов расчетной S АБ как маркера риска развития рецидива стенокардии после реваскуляризации миокарда, необходимо учитывать не только степень сужения просвета КА, но и ее калибр.
Анализ статистических данных, основанный на комплексном влиянии нескольких ФР, показал, что с увеличением степени максимального стеноза КА или S АБ КА и при наличии у больного одного из изучаемых почечных ФР риск развития рецидива стенокардии существенно повышрается.
Вероятность развития послеоперационной стенокардии в зависимости от величины максимального коронарного стеноза, S АБ КА, наличия и стадии ХБП, концентрации МАУ и β2-МГ в моче представлена в виде таблицы, составленной с помощью полученных уравнений логистической регрессии (табл. 2).
Таблица 2. Вероятность развития рецидива стенокардии после реваскуляризации миокарда с учетом кардиоренальных взаимоотношений.
Ввиду лидирующей позиции ИБС в структуре смертности и инвалидности взрослого населения во всем мире, а также с учетом ожидаемого увеличения на 56 % данных показателей к 2040 г. [5] приоритетной задачей современной медицины является предотвращение развития и прогрессирования ИБС. Важно отметить, что в условиях мультифакториального окружения коронарного атеросклероза неотъемлемой частью любой тактики ведения пациентов с ИБС являются выявление и коррекция существующих ФР.
Роль почечных ФР в прогнозировании тяжести течения ИБС не вызывает сомнений. Анализ проведенных исследований свидетельствует о высокой значимости наличия МАУ как интегрального маркера сердечно-сосудистого риска. Ряд крупномасштабных исследований продемонстрировал достоверные результаты, указывающие на то, что при наличии МАУ у пациентов с или без ИБС риск развития или прогрессирования коронарного атеросклероза существенно повышается (EPIC-Norfolk, MESA) [6, 7].
В результате проведенного нами исследования получена высокая частота встречаемости МАУ (91,1 %) и ХБП (97,8 %) у обследованных пациентов. При объяснении столь высокой распространенности почечной дисфункции важно отметить, что патогенетической основой развития МАУ или ХБП при ИБС является дисфункция эндотелия [8], наиболее выраженная при ряде клинических состояний и наличии факторов риска, таких как сахарный диабет, артериальная гипертензия, ожирение, курение. Среди пациентов, включенных в исследование, сахарный диабет был выявлен в 21,1 % случаев, артериальная гипертензия — в 85,6 %, ожирение встречалось у каждого второго пациента, каждый третий был курильщиком. Кроме того, необходимо отметить, что вероятность развития МАУ или снижения скорости клубочковой фильтрации повышается с увеличением количества атеросклеротически пораженных КА [9, 10]. По результатам проведенного исследования число пациентов с мультифокальным поражением коронарного русла выявлено в большинстве (у 64 пациентов) случаев. Таким образом, представленные данные свидетельствуют о высокой вероятности развития почечной дисфункции у обследованных пациентов.
Отсутствие достоверных значений по результатам проведенного нами исследования, не подтверждающих роль наличия МАУ как маркера прогрессирования ИБС, может быть объяснено широкой распространенностью МАУ в исследуемой когорте больных. Вместе с тем при выделении группы пациентов с наличием МАУ ≥150 мг/л представлены убедительные данные, свидетельствующие о высокой вероятности развития рецидива стенокардии. Подтверждением прогностической ценности полученных результатов являются литературные источники, свидетельствующие о необходимости выделения т. н. МАУ низких величин (“low-grade albuminuria”), указывающую на прогрессирование эндотелиальной дисфункции, формирование риска сердечно-сосудистых и почечных осложнений даже при минимальной патологической концентрации альбумина в моче [8].
Поиск “новых” почечных маркеров сердечно-сосудистого риска позволил предположить роль β2-МГ в прогрессировании коронарного атеросклероза. Выбор определения β2-МГ как маркера сердечно-сосудистого риска основан главным образом на известных данных зависимости повышенной концентрации β2-МГ и сниженной скорости клубочковой фильтрации [11], которая является высокодостоверным предиктором тяжести течения ИБС.
По результатам нашего исследования статистически значимого самостоятельного влияния β2-микроглобулинурии на вероятность развития рецидива стенокардии после восстановления коронарного кровотока выявлено не было. Однако получены данные, подтверждающие высокую значимость оценки показателей кардиоренальных взаимоотношений (в т. ч. на основании повышения уровня β2-МГ в моче) в прогнозировании прогрессирования коронарного атеросклероза. Так, с увеличением тяжести течения ИБС (выраженности степени стеноза КА и ее калибра), при наличии почечной дисфункции в виде МАУ, β2-микроглобулинурии или ХБП риск развития рецидива стенокардии после реваскуляризации миокарда существенно возрастает.
Таким образом, представленные данные проведенного исследования демонстрируют высокую значимость выявления почечных ФР наряду с учетом особенностей поражения коронарного русла для возможности всестороннего анализа риска прогрессирования коронарного атеросклероза после реваскуляризации миокарда. Более того, для повышения эффективности проводимых коронарных вмешательств важно учитывать комплексное воздействие нескольких ФР, существенно повышающее вероятность развития рецидива стенокардии.



