Хроническую болезнь почек (ХБП) в настоящее время рассматривают как “васкулопатическое состояние”, которое начинается с функционального расстройства и приводит к органным повреждениям разными патогенетическими механизмами, трансформируясь из фактора риска в сердечно-сосудистые осложнения (ССО), являющиеся одной из ведущих причин смерти больных на регулярном гемо(ГД) и постоянном амбулаторном перитонеальном диализе (ПАПД) [1–3].
Согласно многочисленным исследованиям последних лет, высокий риск ССО у больных ХБП обусловлен кальцификацией мягких тканей, включая сердце и сосуды, вследствие прогрессирующего нарушения минерального обмена [3, 4]. Нарушения минерального метаболизма начинаются задолго до того, как пациенты достигают диализа.
Унификация методов ранней диагностики, лечения и профилактики нарушений минерального и костного обменов у больных ХБП на преддиализных стадиях – важный стратегический подход к снижению сердечно-сосудистой и общей смертности больных, улучшению качества их жизни, снижению расходов на госпитальное лечение вторичного гиперпаратиреоза и заместительную почечную терапию (ЗПТ) [3, 4].
В последние годы идентифицированы ранее не известные факторы, участвующие в регуляции гомеостаза фосфора, витамина D и минерализации костной ткани при ХБП, среди которых серьезное патогенетическое значение придают морфогенетическим белкам – фактору роста фибробластов-23
(FGF-23) и Клото (Klotho) [5–12]. Результаты проспективных исследований (табл. 1) дают основание рассматривать FGF-23 в качестве нового “уремического токсина” и как независимого самостоятельного маркера поражения сердечно-сосудистой системы больных на диализных стадиях ХБП. В то же время
роль FGF-23 в определении сердечно-сосудистого риска и в целом прогноза больных на додиализных стадиях ХБП изучена хуже. Еще менее определено значение Klotho в оценке прогноза у больных ХБП.
Таблица 1. Связь повышения плазменной концентрации FGF-23 с неблагоприятным прогнозом
больных ХБП (данные проспективных исследований).
Понимание ранних механизмов развития ССО у больных ХБП имеет важное значение для разработки новых терапевтических стратегий.
Цель исследования: изучить клиническое значение определения сывороточной концентрации регуляторов фосфорно-кальциевого обмена – морфогенетических белков FGF-23/Klotho у больных разными стадиями ХБП.
Материал и методы
Характеристика обследованных больных В исследование включены 70 больных ХБП 1–5D-стадий – 41
хроническим гломерулонефритом (ХГН) (в т. ч. 10 нефритом при системных заболеваниях), 22 – тубулоинтерстициальным нефритом и 7 – гипертензивным нефросклерозом (табл. 2), среди них 30 мужчин и 40 женщин в возрасте от 20 до 84 лет, средний возраст на момент включения в исследование составил 41±6,7 года.
Стадии ХБП определяли по критериям NKF K/DOKI (2002), при этом СКФ рассчитывали по уравнению CKD-EPI (2009) (табл. 3).
Среди 70 больных, включенных в исследование, на момент взятия проб крови 21 (30 %) больной имел нормальный уровень АД (110/70–140/80), у 49 (70 %) – отмечена артериальная гипертензия (АГ) разной степени выраженности. Для контроля АГ пациентам назначали антигипертензивные
препараты: ингибиторы АПФ, блокаторы кальциевых каналов, бета-блокаторы, диуретики изолированно или в сочетании в зависимости от тяжести АГ.
Среди 49 больных АГ 27(55,1 %) удавалось поддерживать уровень АД в пределах целевого – 130/80–140/80 мм рт. ст.,
Таблица 3. Распределение больных по стадиям ХБП.
остальные 22 (44,9 %) пациента антигипертензивные препараты принимали нерегулярно. На момент начала скрининга у них сохранялась АГ (АД – 150/90–165/100 мм рт. ст.). Среди 24 больных ХБП 4–5-й стадий и анемией 19 (79,2 %) проводили коррекцию анемии эритропоэтином бета (рекормон) и железа сахаратом. Тринадцати (68,4 %) проводимая терапия позволила достигнуть целевого уровня Hb 110–120 г/л и поддерживать его на этом уровне в результате продолжения лечения, у остальных 6, несмотря на введение рекормона и железа сахарата, сохранялась анемия (Hb < 110 г/л).
У 9 (12,9%) больных гиперкальциемией и повышенным уровнем иПТГ для контроля продукции иПТГ применяли парикальцитол.
Семь (10%) больных ГН, в т. ч. при системных заболеваниях соединительной ткани, в связи с сохраняющейся активностью основного заболевания на додиализном этапе ХБП применяли
кортикостероиды и/или цитостатики в умеренных дозах.
Методы исследования
У всех 70 больных ХБП 1–5D-стадий изучен сывороточный уровень FGF-23 в сыворотке крови (Human FGF-23 ELISA kit с использованием моноклональных антител к полной молекуле FGF-23) и Klotho (Human alpha-Kl ELISA с использованием анти-Klotho-антител). Исследование морфогенетических белков
проводилось по стандартному протоколу специалистами диагностической лаборатории ЛиТЕХ. Для исследования у пациентов забирали кровь в вакуумные центрифужные пробирки, затем кровь центрифугировали, полученную таким образом сыворотку замораживали и хранили при температуре (-)28 °С до накопления необходимого количества проб.
У всех больных собирали подробный анамнез и анализировали симптомы с целью уточнения этиологии ХБП, сопутствующей патологии сердечно-сосудистой системы, длительности АГ, скорости прогрессирования ХБП, наличия или отсутствия остаточной функции почек на момент начала лечения ГД.
Оценивали также выраженность синдрома белково-энергетической недостаточности (БЭН – malnutrition).
Всем пациентам выполняли общеклинические анализы крови и мочи. Исследование биохимических параметров крови проводили на биохимическом анализаторе Technicon (США) и биохимическом лабораторном аппарате Spectrum (Abbot, США).
О нарушении фосфорно-кальциевого обмена судили по величине произведения Ca x P (рекомендуемый уровень < 55 мг2/дл2 или < 4,46 ммоль/л), уровню интактного паратиреоидного гормона (иПТГ), определенного методом иммунохимического анализа (у здоровых лиц = 8–65 пг/мл, допустимый
уровень при хронической почечной недостаточности (ХПН) – 150–300 пг/мл).
Всем пациентам измеряли уровень АД (по методу Короткова) и выполняли ЭКГ. Для оценки ГЛЖ у больных АГ использовали индекс Соколова–Лайона [(Socolow–Lyon) SV1+RV5/RV6 > 35 mm (чувствительность – 22 %, специфичность – 100 %)].
Больным АГ проведено эхокардиографическое исследование на приборе ACUSON 128 ХР10 (США) в трех основных режимах (М-режим, В-режим и допплерэхокардиография) в соответствии со стандартным протоколом (Gosse et al., 1990, Devereux, 1990). При М-модальном режиме определены конечный диастолический (КДР) и конечный систолический размер ы (КСР), толщина межжелудочковой перегородки (ТМЖП) и толщина задней стенки левого желудочка (ТЗСЛЖ) в сантиметрах. Относительная толщина стенок (ОТС) ЛЖ рассчитана по формуле ОТС = (ТМЖП + ТЗСЛЖ)/КДР, конечный систолический (КСО) и конечный диастолический объемы (КДО) ЛЖ – по формуле L. Teichholz: V = 7,0 x D3 / (2,4 + D), где V – объем ЛЖ (КСО или КДО); D – переднезадний размер ЛЖ в систолу или диастолу; ударный объем (УО) определен как разница КДО и КСО, а фракция выброса (ФВ) – как отношение УО к КДО.
Наличие гипертрофии стенок ЛЖ регистрировали, если ТМЖП и/или ТЗСЛЖ в конце диастолы превышала 1,1 см. Более точным признаком ГЛЖ является увеличенная масса миокарда левого желудочка (ММЛЖ), рассчитанная по формуле R. Devereux и N. Reichek (1977):
ММЛЖ = 1,04х ([КДР + ТЗСЛЖ + ТМЖП]х3 − [КДР]х3) − 13,6,
где КДР – конечный диастолический размер, ТЗСЛЖ – толщина задней стенки левого желудочка, ТМЖП – толщина межжелудочковой перегородки, выраженные в сантиметрах.
Индекс массы миокарда левого желудочка (ИММЛЖ) определен как отношение ММЛЖ к площади поверхности тела. ГЛЖ диагностировали при ИММЛЖ ≥ 134 г/м2 у мужчин и ≥ 110 г/м2 у женщин (ЭХО-КГ критерии R. Devereux, 1984). На основании значений ИММЛЖ и ОТС выделены следующие
геометрические типы ЛЖ: нормальная геометрия – ИММЛЖ = N, ОТС < 0,45, концентрическая гипертрофия – ИММЛЖ > N, ОТС > 0,45; эксцентрическая гипертрофия – ИММЛЖ > N, ОТС < 0,45. Систолическую дисфункцию диагностировали при ФВ < 45%.
На момент взятия проб крови изучили состояние кровотока 57 больных в магистральных сосудах, включая артерии почек, с помощью ультразвуковой допплерографии с целью выявления кальцификатов, а также изучения функциональной способности сосудистой стенки.
Всем больным определили общее содержание сывороточного железа, общую железосвязывающую способность сыворотки, сывороточный уровень ферритина и насыщение трансферрина, липиды общие, липопротеины (ЛПВП, ЛПНП, ЛПОНП), триглицериды, аланинаминотрансферазу, аспартатаминотрансферазу.
Рисунок 2. Динамика сывороточных уровней фосфора и иПТГ при прогрессировании ХБП.
Таблица 4. Корреляционные связи между сывороточными показателями фосфорно-кальциевого обмена
и уровнем регуляторных морфогенетических белков у пациентов с ХБП 3–5D стадий.
Таблица 5. Связь суточной протеинурии, СРБ и БЭН с сывороточной концентрацией FGF-23/Klotho и иПТГ у больных ХБП 3–4-й стадий.
Статистическая обработка результатов исследования
Статистическая обработка результатов выполнена с помощью пакета программ “SPSS 10 for Windows”.
При статистической обработке данных использовали следующие методы и показатели:
- при анализе распределения переменной рассчитывали частоту отдельных значений: среднее арифметическое, среднее квадратичное отклонение и медиану, строили частотные
гистограммы;
- при поиске связей между переменными использовали коэффициент корреляции Пирсона “r” и ранговый коэффициент корреляции Спирмена “p”.
Результаты
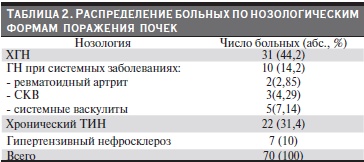
Среди изученных больных ХБП по мере прогрессирования от 1-й к 5D-стадии увеличивалась сывороточная концентрация FGF-23 и снижалась концентрация Klotho. Наиболее высокий уровень FGF-23 и низкий Klotho отмечены в группе больных, получавших лечение регулярным ГД 5D-стадии (рис. 1). Между уровнем СКФ и сывороточной концентрацией FGF-23 установлена сильная прямая корреляция (r = 0,693, p < 0,01), между СКФ и концентрацией белка Klotho – сильная обратная корреляция [r = (-)0,799, p < 0,01]. В группе больных ХБП 5D-степени изменения этих показателей – увеличение сывороточной концентрации FGF-23 и снижение Klotho – коррелировали с длительностью пребывания больных на ГД [r = (+)0,429; p < 0,01, и r = (-)0,629; p<0,01 соответственно].
При сравнении сывороточного уровня FGF-23 в группах больных с разными стадиями ХБП оказалось, что его увеличение по мере снижения СКФ опережает повышение сывороточного уровня фосфора и иПТГ (рис. 2), начиная уже с ХБП 3-й стадии, тогда как гиперфосфатемия и повышение уровня ПТГ– с ХБП 4–5-й стадий.
В то же время снижение концентрации в сыворотке крови больных Klotho при прогрессировании ХБП происходило в обратной корреляционной зависимости от содержания в сыворотке крови фосфора и ПТГ. Корреляционные связи между морфогенетическими белками FGF-23, Klotho и показателями
фосфорно-кальциевого обмена (фосфор, произведение Са х Р и ПТГ) у больных ХБП суммированы в табл. 4.
Таким образом, на основании полученных данных можно предположить, что сывороточные показатели морфогенетических белков FGF-23 и Klotho являются ранними маркерами прогрессирования ХБП, их изменение начинается уже с ХБП 3-й стадии и прогрессирует по мере нарастания почечной
недостаточности. При этом повышение сывороточного уровня FGF-23 и снижение уровня Klotho опережают повышение сывороточной концентрации фосфора, произведение Са х Р и ПТГ по мере снижения СКФ у больных ХБП.
В группе пациентов с ХБП 3–4-й стадий, которым проводили лечение парикальцитолом (n = 9), снижение Klotho в соответствии со степенью почечной недостаточности оказалось менее значимым, чем в группе больных ХБП 3–4-й стадий, получавших другую терапию фосфорно-кальциевых
нарушений (преимущественно кальцитриол) [r = (+) 0,451; p < 0,01]; разницы между группами по степени снижения в сыворотке FGF-23 и иПТГ не отмечено (r = (-)0,322; р > 0,05).
Учитывая обсуждаемые в литературе плейотропные эффекты морфогенетических белков FGF-23 и Klotho, не связанные с их влиянием на показатели фосфорно-кальциевого обмена, мы проанализировали изменение сывороточных концентраций этих белков в зависимости от факторов воспаления (СРБ, протеинурия), а также белково-энергетической недостаточности БЭН (табл. 5).
Выявлена сильная корреляция между сывороточной концентрацией морфогенетических белков, особенно Klotho, и протеинурией, СРБ, БЭН, что свидетельствует о неслучайной связи этих белков с реакциями воспаления при ХБП.
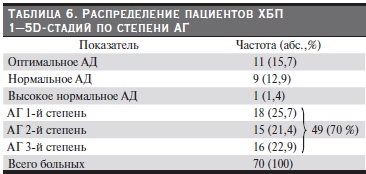
Кроме того, мы оценили изменения сывороточного уровня морфогенетических белков в зависимости от величины АД (табл. 6).
В группе больных ХБП с выявленной АГ (n = 49–70 %), (рис. 3 а, б) степень повышения АД прямо коррелировала с сывороточной концентрацией FGF-23 ( r= (+)0,452; p < 0,01) и обратно – с сывороточной концентрацией Klotho (r = (-) 0,687; p < 0,01).
Рисунок 3. Динамика величины АГ в зависимости от уровня FGF-23 (A) Klotho (Б) в сыворотке крови больных ХБП (n=49).
Наряду с этим у больных АГ (n = 49) выявлена связь повышения уровня FGF-23 и снижения уровня Klotho в сыворотке крови с увеличением ТЗСЛЖ (соответственно r (+)0,552; p < 0,01, и r = (-)0,587; p < 0,01). Нами также обнаружена сильная связь сывороточной концентрации FGF-23 – прямая [r = (+)0,492; p < 0,01], и сывороточной концентрации Klotho – обратная [r = (-)0,537; p < 0,01], с индексами периферического сосудистого сопротивления, по данным УЗДГ. У тех же больных повышенная концентрация FGF-23 и сниженная концентрация Klotho в сыворотке крови были ассоциированы с большей частотой выявления кальцификатов в сердце и магистральных артериях [соответственно r = (+) 0,625; p < 0,01, и r = (-) 0,584; p < 0,01].
Эти корреляции были наиболее сильными в группе пациентов с АГ (n = 27), которым не удалось достичь адекватной коррекции уровня АД (табл. 7).
В то же время в группе больных, которым удалось достичь и поддерживать целевой уровень АД, по сравнению с группой больных некорректированной АГ, отмечены более высокие показатели Klotho [r = (+) 0,509; p < 0,01] и менее выраженная степень ремоделирования миокарда, причем преимущественно среди тех больных, у кого для коррекции гипертонии использовались нефропротективные средства – иАПФ или блокаторы ангиотензиновых рецепторов.
Мы изучили связь изменений сывороточных показателей морфогенетических белков с наличием у больных анемией и показателями обмена железа как важных клинических детерминант ХБП. Сравнили концентрацию морфогенетических белков в сыворотке крови больных анемией и без анемии и
выявили более низкий уровень Klotho и более высокий – FGF-23 (соответственно r = (+)0,602, p < 0,01, и r = (-)0,450, p < 0,01) среди больных анемией, чем среди больных с теми же стадиями ХБП, имеющими целевые значения Hb. Так, у больных с наиболее низким уровнем гемоглобина (80–68 г/л) концентрация FGF-23 превышала ее величину у больных с нормальным уровнем гемоглобина почти в 1000 раз. Разница между этими группами больных анемией по величине сывороточной концентрации Klotho составила 80 % (рис. 4).
При анализе показателей обмена железа у пациентов с ХБП отмечена корреляция сывороточного уровня ферритина и процента насыщения железом трансферрина с сывороточной концентрацией морфогенетических белков, при этом связь с Klotho была более сильной (табл. 8).
На основании полученных данных правомочен вывод о том, что сывороточная концентрация FGF-23 и Klotho может служить предиктором выраженности анемии у больных ХБП.
Так же как у больных ХБП с АГ, леченных иАПФ, среди 24 пациентов ХБП на преддиализных стадиях с анемией, у 19 больных, получавших лечение эпоэтинами (рекормон) и железа сахаратом, концентрация в сыворотке крови Klotho в среднем была выше, чем у 5 пациентов с анемией, не получавших лечение эритропоэзстимулирующими средствами (ЭСА) и железом (r = 0,540; p < 0,05) (рис. 5).
Необходимо отметить, что среди 19 пациентов, получавших лечение анемии (рекормон + железа сахарат), у 6 с недостигнутым целевым уровнем Hb отмечены более низкие показатели Klotho и более высокие – FGF-23, чем у 13 больных, которым удалось не только достичь, но и поддержать целевые значения Нb (соответственно r = (+)0,498; р < 0,01, и r = (-)0,453; р < 0,05).
Таблица 7. Индексы корреляции между сывороточными концентрациями морфогенетических белков и
величиной ремоделирования стенки ЛЖ и периферического сопротивления у больных рефрактерной АГ.
Таблица 8. Влияние обмена железа на сывороточную концентрацию FGF-23 и Klotho у больных ХБП.
Рисунок 4. Влияние анемии на сывороточную концентрацию морфогенетических белков FGF-23 и Klotho у больных ХБП.
Обсуждение
Большинство исследований последних лет направлено на поиск ранних маркеров развития ХПН и формирования ССО у больных ХБП [5–10].
При ХБП нарушаются все звенья минерального и костного метаболизма, причем эти нарушения начинаются задолго до того, как пациенты достигают диализа. В настоящее время идентифицированы ранее не известные факторы, участвующие в регуляции гомеостаза фосфора, витамина D и минерализации костной ткани – морфогенетические белки – FGF-23 и Kлото (Klotho) [5, 6, 12].
В норме гормон FGF-23 секретируется остеобластами и остеоцитами, ингибирует почечную реабсорбцию фосфора в проксимальных канальцах (фосфатурический гормон), а также его кишечную абсорбцию путем подавления активности 1-альфа-гидроксилазы в почках и снижения сывороточного уровня 1,25(ОН)2D3 (подавляющий продукцию витамина D гормон) [5–11, 13–17]. В отличие от классических представителей семейства факторов роста фибробластов, функционирующих
паракринно и/или аутокринно, FGF-23 является эндокринным фактором [11, 12, 13]. Концентрация FGF-23 регулируется с помощью гломерулярной фильтрации и проксимальной тубулярной экскреции [5, 11, 14–19].
Белок Klotho впервые был выявлен в 1997 г. как результат генной мутации у мышей с наличием синдрома преждевременного старения [16]. Позже было установлено, что ген Кlotho кодирует трансмембранный протеин, который принадлежит семейству гликозидаз и находится в почечных канальцах [17–21]. В настоящее время известно, что ген Klotho секретирует “белок молодости”, обладающий плейотропными эффектами, включая кардиоренопротективный эффект [6, 11, 14, 15, 22]. Мыши, лишенные этого гена, развивают фенотип, идентичный таковому преждевременного старения человека [6].
Белок Klotho существует в 2 формах: тип I – трансмембранный протеин (1014 аминокислот) с большим экстрацеллюлярным доменом и короткой интрацеллюлярной частью (10 аминокислот), преимущественно экспрессируемый в дистальных почечных канальцах, и тип II – циркулирующий
растворимый фактор, определяемый в крови и в меньшей степени в других биологических жидкостях, обладающий системными эффектами [6, 17, 23–35]. Трансмембранный протеин Klotho формирует комплекс с рецептором FGF-23 (FGFR1) и функционирует как облигатный ко-рецептор для FGF-23,
обусловливая фосфатурию [6, 11, 17, 26–29]. Циркулирующая форма Клото продуцируется с помощью либо протеолитического отщепления экстрацеллюлярного домена трансмембранной формы (130 кДа изоформа) с помощью закрепленных в мембране протеаз ADAM10 и ADAM17 или альтернативного сплайсинга мРНК (изоформы 70 кДа). Системные эффекты этого протеина, по-видимому, связаны преимущественно с циркулирующей формой [6, 11, 30–35].
Высокий уровень комплекса FGFR1 : Klotho выявляют в дистальных канальцах почек, однако биологическое действие FGF-23 реализуется в проксимальных канальцах [5, 11, 14, 36–38]. Предполагают, что влияние FGF-23 на проксимальные канальцы может быть непрямое – возможно, через стимуляцию FGFR1 в дистальных канальцах и высвобождение других паракринных факторов, которые регулируют функции проксимальных канальцев (дистально-проксимальный тубулярный механизм). FGF-23/Klotho-сигнал вызывает фосфатурию путем подавления натрий-зависимых котранспортеров фосфата IIa-типа (NaPi-2a), экспрессируемых на щеточной каемке мембраны клеток проксимальных почечных канальцев. В последующем было обнаружено, что циркулирующая
форма Klotho регулирует транспорт фосфора в проксимальных канальцах почек также с помощью дегликозилирования NaPi-2а котранспортеров [11, 30–39]. В результате сокращения численности и активности NaPi-2a развивается фосфатурия независимо от FGF-23.
Накопленные данные позволяют рассматривать FGF-23 в качестве одного из ранних маркеров нарушения минерального обмена у пациентов с ХБП [8, 13–15, 18, 19, 40–43]. Уже при умеренном снижении СКФ повышается ретенция фосфатов, что активирует секрецию FGF-23 как фосфатурического гормона, а в дальнейшем – ПТГ [11, 14, 15, 19, 41].
На основании полученных нами результатов и данных литературы [5, 18, 19] уровень FGF-23 повышается в сыворотке крови у больных ХБП по мере снижения СКФ раньше, чем происходит увеличение сывороточной концентрации фосфора и ПТГ. К тому времени, когда пациенты достигают
терминальной ХПН, концентрация FGF-23 часто в 100–1000 раз превышает нормальное его содержание, в то время как сывороточная концентрация фосфора может быть только умеренно повышенной [5, 13, 18, 19, 42].
Установлено, что повышение сывороточного уровня FGF-23 является компенсаторной реакцией на ретенцию фосфора, наблюдаемую при прогрессирующем снижении СКФ [5, 14, 19, 42]. По нашим данным, у пациентов ХБП начиная с 3-й стадии отмечается обратная линейная зависимость между снижением СКФ и повышением FGF-23. В последнее время допускают, что повышение уровня FGF-23 происходит преимущественно вторично в результате снижения уровня Klotho, который служит
ко-рецептором для FGF-23 [6, 11, 40].
В снижении экспрессии Klotho в почках при ХБП могут иметь значение ишемия, оксидативный стресс, повышение ангиотензина II и воспаление [6, 7, 9, 22]. С другой стороны, адекватная продукция Klotho обеспечивает антиоксидантный, антиапоптический эффекты и препятствует преждевременному старению [6, 9, 11, 14]. В недавних экспериментальных исследованиях подтверждено, что циркулирующая форма Klotho может функционировать как гуморальный фактор, который защищает сердечно-сосудистую систему [6, 9, 11]. Сверхэкспрессия Klotho обеспечивает как почечную, так и
кардиоваскулярную протекцию.
Нефропротективные эффекты Klotho изучены на моделях ГН у животных [20]. Сверхэкспрессия Klotho у трансгенных экспериментальных животных способствовала регрессу повреждений клубочков и интерстиция почек, вызывая снижение протеинурии и азотемии [20–23]. Повышение экспрессии Klotho у гипертензивных мышей препятствовало прогрессированию АГ, поражению почек и приводило к снижению протеинурии [24, 25]. Считают, что Klotho вызывает уменьшение продукции почечного супероксида и супрессию активности НАДФН-оксидазы, которая является основным источником активных форм кислорода (ROS), вовлекаемых в прогрессирование тубулоинтерстициального повреждения. Интраперитонеальное введение растворимой формы рекомбинантного белка Клото экспериментальным животным сразу после индукции у них односторонней обструкции мочеточника предотвращает развитие острого почечного фиброза в результате ингибирования TGFβ1 [26]. Установлено, что Klotho связывается с рецептором – TGFβR2 II типа, подавляя активацию рецепторов – TGFβR1 I типа, фосфорилирующих Smad2/3 белки (транскрипционные факторы, регулирующие экспрессию генов-мишеней TGFβ1) [11, 26]. И напротив, снижение циркулирующей формы Klotho в сыворотке крови сопровождается гиперфосфатемией, усилением оксидативного стресса, эндотелиальной дисфункцией и диффузной сосудистой кальцификацией. Снижение уровня Klotho в почках, сыворотке, моче характерно для заболеваний, проявляющихся преждевременным сосудистым старением, – диабета и гипертонии [11].
В проведенном нами исследовании выявлена прямая ассоциация повышенной сывороточной концентрации FGF-23 и низкой сывороточной концентрации Klotho с наличием воспаления – уровнем С-реактивного белка [r = (+)0,370, p < 0,01, и r = (-)0,453, p < 001] и выраженностью нутритивных
нарушений – белково-энергетической недостаточности [r = (+)0,559, p < 0,01, и r = (-)0,581, p < 0,01], уровнем протеинурии [r = (+)0,305, p < 0,05, и r= (-)0,502, p < 0,01].
Эти данные согласуются с результатами других авторов [11, 14, 43, 44], которые на основании выявления у больных ХБП 3–5-й стадий повышенного уровня С-реактивного белка – неспецифического маркера воспаления и эндотелиальной дисфункции, рассматривают ХБП как состояние хронического
воспаления. Группа ученых из Uppsala University Hospital под руководством Mirza [27] показали, что при повышенной экспрессии FGF-23 может нарушаться эндотелийзависимая вазодилатация у пациентов с СКФ < 60 мл/мин/1,73 м2. И напротив, в экспериментальной работе Maekawa и соавт. [28] растворимый рекомбинатный белок Klotho при добавлении к эндотелиальным клеткам пупочной вены (HUVEC)
человека подавлял экспрессию ими молекул адгезии –ICAM-1 (внутриклеточная молекула адгезии-1) и VCAM-1 (сосудистые молекулы клеточной адгезии-1), участвующих в патогензе воспалительных сосудистых заболеваний.
У наблюдаемых нами больных активным ХГН и АГ (ХБП 2–4-й стадий) с дефицитом Klotho отмечались высокий уровень протеинурии, повышение индексов сопротивления периферических сосудов и стойкое повышение уровня АД. С другой стороны, в экспериментальных исследованиях повышение экспрессии Klotho сопровождалось уменьшением протеинурии и существенным снижением ангиотензина II у гипертензивных мышей с ХГН [11, 29, 30, 31]. При этом повышенная экспрессия Klotho сочеталась с адекватной фосфатурией и лучшей функциональной способностью почек.
У трансгенных мышей с ХБП и высокой продукцией Klotho выявлена существенно меньшая степень кальцификации сосудов по сравнению с диким типом мышей с ХБП и сниженной продукцией Klotho [32]. Благоприятный эффект Klotho на сосудистую кальцификацию был выражен в большей степени,
чем его эффект на почечную функцию и фосфатурию, что связывают с прямым влиянием Klotho на сосуды. В исследованиях in vitro показано, что наряду с увеличением фосфатурии и стабилизацией СКФ Klotho супрессирует Na-зависимый захват эндотелием и гладкомышечными клетками (ГМК) фосфора, предупреждает дифференциацию ГМК сосудов и минерализацию, индуцируемую гиперфосфатемией [11, 32].
Высвобождение гена Klotho, запускаемое аденовирусом в модели атеросклероза у крыс, повышение эндотелий-зависимого NO-синтеза предотвращают неблагоприятное ремоделирование сосудистой стенки [11, 32]. Наряду с экспериментальными исследованиями в литературе появляются ссылки
на клинические работы о роли Klotho как модифицируемого фактора, вовлеченного в патогенез кардиоренальных взаимодействий при ХБП [11, 33].
Возможно, что часть благоприятных эффектов Klotho на эндотелиально-сосудистую функцию при ХБП является результатом уменьшения трансдукции FGF-23 [11, 21].
В условиях снижения массы действующих нефронов и редукции рецепторов FGF-23 (FGFR1) в почках влияние FGF-23 при нарастании его уровня в сыворотке может распространяться на любые другие органы, экспрессирующие FGFR. В ряде достаточно крупных обсервационных исследований было показано, что повышение FGF-23 прямо связано с выраженностью атеросклероза, ГЛЖ миокарда и сосудистой кальцификацией [18, 27, 34, 35].
ГЛЖ с развитием дисфункции ЛЖ является распространенным проявлением ССО и независимым фактором риска смерти пациентов с ХБП на регулярном ГД [11, 18, 34]. Примерно 40 % пациентов на преддиализной стадии ХБП и свыше 80 % пациентов, начинающих ГД, имеют ГЛЖ [14, 36–38]. По полученным нами данным, совпадающими с данными литературы, высокие уровни FGF-23 коррелируют с увеличением ТЗСЛЖ, ИММЛЖ. Влияние FGF-23 на развитие ГЛЖ и интерстициального кардиального фиброза осуществляется через активацию FGFR-рецепторов, особенно FGFR1, экспрессирующихся на
миокардиальных клетках взрослого человека, которые могут быть блокированы in vitro с помощью ингибитора PD173074 (синтетический ингибитор FGF-23), не требуя наличия Klotho в качестве ко-рецептора [34]. В масштабном исследовании CRIC (Chronic Renal Insufficiency Cohort Study), в котором проанализированы клинические данные о 1908 больных ХБП на додиализных стадиях, была установлена четкая связь между тяжестью ХБП и диффузной артериальной кальцификацией
независимо от традиционных факторов риска [35].
В исследовании ARMORR с помощью множественного линейного регрессионного анализа установлено, что высокий сывороточный уровень FGF-23 у больных ХБП является предиктором смерти в течение 1-го года диализной терапии независимо от сывороточного уровня фосфора и ПТГ [39].
Эти данные подтверждают, что наличие сосудистой кальцификации следует рассматривать как показатель (свидетельство) в первую очередь нарушения соотношения FGF-23/Klotho и учитывать при индивидуализации подхода к лечению больных ХБП.
При этом, по результатам проведенного нами исследования, изменение соотношения FGF-23/Klotho может быть ранним биомаркером степени хронического почечного повреждения при ХБП, предшествуя изменениям других устоявшихся маркеров прогрессирования ХБП.
Нами было установлено, что с нарушением соотношения FGF-23/Klotho коррелирует частота и выраженность анемии: по мере снижения уровня Нb при прогрессировании ХБП достоверно увеличивалась концентрация в сыворотке крови FGF-23 и снижалась концентрация Klotho. Преимущественно с сывороточной концентрацией Klotho прямо коррелировали и основные показатели обмена железа (сывороточный уровень ферритина и % насыщения трансферрина железом), причем
корреляция была сильной [cоответственно r = (+)0,539; р < 0,01, и r=(+)0,491; р < 0,01]. Корреляция с FGF-23 (обратная) была также достоверной, хотя и менее значимой [r = (-)0,411; р < 0,05, и r = (-)0,454; р < 0,05]. Публикаций о связи сывороточной концентрации FGF-23 и Klotho с уровнем гемоглобина в литературе нами не обнаружено. Имеются лишь единичные сообщения о наличии корреляции этих факторов с параметрами обмена железа.
Полученные нами данные свидетельствуют о том, что анемия и нарушение фосфорно-кальциевого обмена при ХБП развиваются параллельно. У больных анемией, особенно выявляемой рано, необходимо исследовать все показатели фосфорно-кальциевого обмена (FGF-23/Klotho, фосфор, иПТГ, кальций) с целью оценки прогрессирования ХБП, своевременного выявления связанных с ней нарушений, проведения мер профилактики и лечения. На основании совокупности этих данных можно допустить возможность практического использования Klotho и FGF-23 в качестве ранних диагностических маркеров почечного повреждения, оценки прогноза, а также для совершенствования кардионефропротективной стратегии.



