Общепризнанно, что артериальная гипертензия (АГ) представляет собой важнейший фактор риска сердечно-сосудистых и почечных осложнений [1]. Почка выступает одновременно и “причиной”, и “жертвой” АГ. С одной стороны, высокое артериальное давление (АД) является ключевым патогенетическим фактором, способствующим снижению почечной функции, с другой – наличие заболевания почек является одной из наиболее распространенных причин АГ, в т. ч. резистентной [2]. Взаимосвязь повышения АД и поражения почек известна более полувека: первым этапом ее изучения
можно считать классические работы F. Volhard (1940) [3]. Даже незначительное повышение уровня АД определяет существенное нарастание риска хронической почечной недостаточности (ХПН) [4]. Ориентируясь на данные, полученные в исследованиях MRFIT [5] и Okinawa Study [6], рост систолического АД во многом определяет почечную смерть в общей популяции [3]. АГ рассматривается как один из наиболее важных факторов риска хронической болезни почек (ХБП) [4, 7].
Одно из основополагающих механизмов формирования АГ – нарушение экскреции натрия почками [8]. Еще в 1961 г. A. Guyton первым объяснил связь между АД и потреблением натрия [9–11], продемонстрировав, что сдвиг отношения АД/натрийурез вправо указывает на то, что более высокие цифры АД необходимы для достижения равновесия между экскретируемым и потребляемым натрием. Позже теория A. Guyton нашла многочисленные подтверждения в эпидемиологических исследованиях. При обследовании жителей Кашмира показано, что средняя 24-часовая экскреция натрия была значительно выше у гипертензивных (p < 0,001), составив около 27 г/сут. Распространенность АГ в Кашмире оказалась значительной, что во многом объясняется традицией потребления его жителями соленого чая [12].
В Японии, как известно, также традиционно употребляют достаточно большое количество соли. В наблюдательном исследовании OMEGA, проведенном на жителях Японии, было четко показано увеличение систолического АД по мере нарастания потребления поваренной соли [13]. В свою очередь значение повышенного потребления поваренной соли для жителей Японии в становлении и нарастании АГ подтверждается также установленным в нескольких исследованиях снижением АД
при депривации натрия в пищевом рационе [14, 15]. C 1987 по 2000 г. роль феномена соль-чувствительности в развитии АГ была изучена в серии исследований, проведенных в Великобритании; потребление натрия оценивали по его количеству, экскретируемому с мочой. Было установлено, что среднесуточное потребление соли достигает 9 г (3,6 г/150 ммоль натрия), средняя экскреция натрия у мужчин составила 173 ммоль (4,2 г натрия/10,4 г соли) и 132 ммоль (3,2 г натрия/7,9 г соли) у женщин. Потребление соли с пищей в возрасте от 65 лет и старше в среднем составляет 6,8 г/сут (2,7 г/117 ммоль натрия) для мужчин и 5,3 г/сут (2,1 г/91 ммоль натрия) для женщин. В связи с этим было рекомендовано снижение среднего потребления соли взрослыми до 6 г/сут (2,4 г/100ммоль/натрия) [16]. Недавние исследования, проведенные в Финляндии методом случайной выборки взрослого населения, показали [17], что при увеличении потребления соли уже до 6 г/ сут было отмечено значительное увеличение риска сердечно-сосудистых заболеваний [18]. А.Н. Бритов и соавт. (2004) [19] продемонстрировали, что жители Москвы потребляют поваренную соль в среднем в количестве 12 г/сут; данный показатель оказался несколько выше для жителей Твери [20]; число лиц, употребляющих поваренную соль в количестве < 6 г/сут, не превышает 10 % [21].
В проведенном мета-анализе F.J. He и G.A MacGregor изучалось влияние умеренного снижения потребления соли на АД. Исследователи показали, что сокращение потребления соли на 100 ммол/день (2,4 г натрия) приводит к снижению АД на 7,11/3,88 мм рт. ст. (р < 0,001 для САД и ДАД) [18]. Анализ,
проведенный среди норвежского населения, показал, что сокращение потребления соли снижает САД на 2 мм рт. ст., что в свою очередь увеличивает продолжительность жизни мужчин на 1,8, женщин – на 1,4 месяца [18]. В докладе COMA также декларировано, что диета с низким содержанием соли существенно снижает АД в течение 6 месяцев ее соблюдения. Тем не менее следует подчеркнуть также и трудности, возникающие у пациентов при попытке снижения потребления поваренной соли, т. к. ее добавляют в большинство пищевых продуктов [16].
Таблица 1. Сочетание факторов риска в обследованных группах.
Таблица 2. Характеристика групп.
Во многих клинических исследованиях была показана связь между употреблением натрия и АД как у гипертензивных, так и у нормотензивных [22]. Однако степень снижения АД в ответ на уменьшение потребления натрия с пищей может варьироваться в значительной степени: описано как феномен соль-чувствительности [23]. Существуют исследования, в которых соль-чувствительность ассоциируется с микрососудистым и тубулоинтерстициальным повреждениями [24, 25].
В эпидемиологическом исследовании GenSalt, проведенном с включением 1906 взрослых коренных жителей Китая, изучалась связь между употреблением натрия и АД, также была оценена распространенность соль-чувствительности, констатированной почти у 40 % обследованных. Сольчувствительность чаше встречалась среди женщин, пожилых и среди лиц с более высокими цифрами АД [26, 27]. Известно, что соль-чувствительность существенно чаще встречается у афроамериканцев по сравнению с европеоидами [28]. У пожилых, получающих с пищей недостаточное количество натрия, может, тем не менее, происходить его задержка [29]; при увеличении количества потребляемой поваренной соли данная тенденция всегда усугубляется [30].
Нами было проведено исследование, направленное на уточнение роли феномена соль-чувствительности в формировании поражения органов-мишеней у больных АГ. С февраля 2010
по сентябрь 2012 г. на базе Центра здоровья ГБУЗ “Городская поликлиника № 170” (филиал 2) и поликлинического отделения ГБУЗ ГКБ № 4 Департамента здравоохранения г. Москвы были скринированы 1872 пациента на предмет наличия следующих критериев включения:
• возраст >18 лет;
• наличие одного из факторов риска: изолированная систолическая АГ (ИСАГ) или абдоминальное ожирение, или тип суточной кривой АД “non-dippers”, или сахарный диабет (СД) неосложненного течения, неинсулинопотребный;
• постоянная антигипертензивная терапия в течение предшествующих 3 месяцев;
• наличие подписанного информированного согласия пациента на участие в клиническом исследовании.
Критериями исключения считали:
• маловероятное сотрудничество с пациентом во время исследования, недееспособность;
• перенесенные в течение предшествующих 3 месяцев инфаркт миокарда, нестабильная стенокардия, чрескожное коронарное вмешательство, сердечная недостаточность, мозговой инсульт или транзиторная ишемическая атака;
• хроническая сердечная недостаточность II–IV ФК (NYHA), клинически значимый стеноз аортального или митрального клапана, некорректированная коарктация аорты, обструктивная гипертрофическая кардиомиопатия;
• установленное заболевание почек;
• вторичная и/или неконтролируемая АГ (АД выше 180 мм рт. ст. или ДАД выше 110 мм рт. ст.);
• декомпенсированный и/или инсулинопотребный сахарный диабет;
• любые тяжелые, декомпенсированные или нестабильные соматические заболевания или состояния, которые, по мнению исследователя, угрожают жизни больного или ухудшают прогноз заболевания (декомпенсированная сердечная недостаточность, анемия, аутоиммунные, онкологические заболевания, гепатиты, сильные аллергические реакции, заболевания соединительной ткани и др.);
• острые инфекционные заболевания;
• установленное злоупотребление алкоголем или лекарственными средствами;
• табакокурение;
• беременность, период лактации;
• участие в другом клиническом исследовании в течение предшествующих 30 дней.
В исследование был включен 351 пациент. Пациенты были распределены по когортам в зависимости от доминирующего фактора риска: с ИСАГ – 30 пациентов, с абдоминальным ожирением – 185 пациент, по профилю суточного АД – “non-dippers” – 83 пациента, с СД – 38 пациентов и группа контроля – 15 пациентов. В связи с невозможностью формирования абсолютно “чистых” групп допускалось клинически незначимое сочетание факторов риска (табл. 1). Группы были сопоставимыми по основным клиническим характеристикам, полу и возрасту. Характеристики групп представлены в табл. 2.
Уровень потребляемой соли определяли с помощью опросника “Charlton: Salt Screener” [31], в котором пациенты отмечали употребление ими продуктов в течение последней недели; оценка результатов проводилась по балльной системе.
Порог солевой чувствительности определяли методом R.J. Henkin, соль-резистентных определяли при пороге соль-чувствительности менее 0,2 %, при пороге выше 0,2 % определяли как соль-чувствительных. Артериография осуществлялась методом аппланационной тонометрии с помощью артериографа TensioClinic.
С пациентами проводилась беседа о вреде употребления большого количества соли: им было разъяснено, что чрезмерное употребление соли приводит к гипертонической болезни, ожирению и другим заболеваниям. Приводились наглядные примеры употребляемого количества соли: 5 г – 1 чайная ложка, 15 г – 1 столовая ложка. К беседе привлекались близкие и родственники пациентов. Пациентам было разъяснено, что в полуфабрикатах и фастфуде содержится наибольшее количество соли, при приготовлении еды в домашних условиях можно легко контролировать количество потребляемой соли. Пациенты вели пищевые дневники, по которым контролировался уровень потребляемой соли.
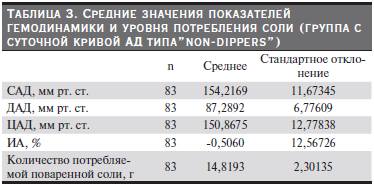
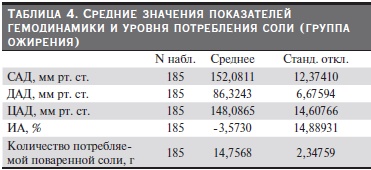
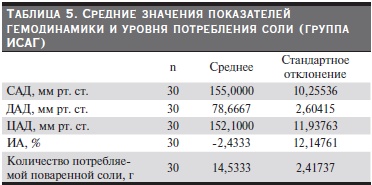
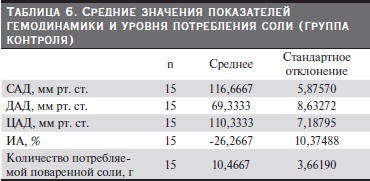
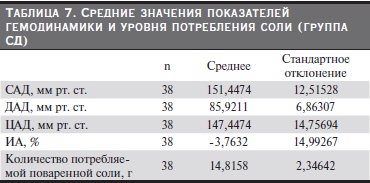
После статистической обработки данных получены средние значения показателей гемодинамики, индекса аугментации (ИА) и уровня потребления соли по группам. Из табл. 3–7 видно, что группы были сопоставимыми по уровню АД, потреблению соли, ИА. В группе контроля потребление соли было
меньше по сравнению с другими группами и, соответственно, уровень АД и ИА были в пределах нормы.
Для оценки риска сердечно-сосудистых заболеваний в течение 10 лет была использована шкала SCORE. Полученные результаты представлены на рис. 1.
Как видно из рис. 1, заметная часть пациентов относились к категории очень высокого сердечно-сосудистого риска. По мере увеличения потребления поваренной соли нарастает как систолическое, так и диастолическое АД. Изменение ИА в зависимости от потребления соли продемонстрировано на рис. 2. Следует подчеркнуть, что часть пациентов, в частности те, у кого количество поваренной соли
в рационе составляло 11 и 16 г/сут, постоянно принимали диуретики.
На рис. 3 продемонстрировано, что по мере увеличения потребления поваренной соли у обследованных нами пациентов с АГ также достоверно возрастал индекс аугментации. Оценка динамики центрального АД продемонстрировала, что оно возрастает по мере увеличения потребления поваренной соли в группах пациентов с ожирением, сахарным диабетом, ИСАГ, а также у тех, у кого был констатирован прогностически неблагоприятный тип суточной кривой АД, характеризующийся отсутствием его должного снижения ночью.
Рисунок 1. Распределение обследованных пациентов по уровню риска шкалы SCORE.
Рисунок 2. Изменения ИА в зависимости от потребления соли.
Рисунок 3. Зависимость ЦАД от потребления соли в группах.
Как видно из табл. 8–12, во всех группах выявлена доставерная корреляция пораметров гемодинамики с уровнем потребления соли. Из всех параметров гемодинамики наибольшая корреляция отмечается между центральным АД и уровнем потребления поваренной соли.
Таблица 8. Ранговые корреляции Спирмена (Группа СД). Отмеченные корреляции значимы на уровне p < 0,05.
Таблица 9. Ранговые корреляции Спирмена (Группа контроля). Отмеченные корреляции значимы на уровне p < 0,05.
Таблица 10. Ранговые корреляции Спирмена (Группа ожирения). Отмеченные корреляции значимы на уровне p < 0,05.
Таблица 11. Ранговые корреляции Спирмена (Группа “non-dippers”). Отмеченные корреляции значимы на уровне p < 0,05.
Таблица 12. Ранговые корреляции Спирмена (Группа ИСАГ). Отмеченные корреляции значимы на уровне p < 0,05.
Таблица 13. Изменение ЦАД и уровня потребления соли через 6 недель.
На основании этого для оценки эффекта диеты с уменьшенным содержанием соли был выбран параметр ЦАД, как наиболее чувствительный. Всем пациентам вне зависимости от вывяленного уровня потребления соли и соль-чувствительности, исходных величин АД, возраста и пола была рекомендована диета с низким содержанием соли (менее 6 г/сут). С пациентами была проведена беседа, в которой им было рекомендовано воздерживаться от употребления приема продуктов, содержащих высокое количество поваренной соли (полуфабрикаты, фастфуд и т. п.), также им рекомендовано было питание домашнего приготовления с уменьшением количества поваренной соли. Пациенты вели пищевые дневники, по которым в дальнейшем оценивался уровень потребления соли. На визите через 6 недель был повторно оценен уровень ЦАД и уровень потребления соли у этих пациентов.
При сравнении с ранее полученными данными по уровню потребления соли можно наблюдать снижение потребления соли в среднем на 2 г во всех группах. Как видно из табл. 13, в целом во всех подгруппах пациентов с АГ высокого риска рестрикция потребления поваренной соли позволила достичь существенного снижения ЦАД.
Таким образом, можно утверждать важную роль феномена соль-чувствительности в становлении и нарастании АГ, особенно тех ее вариантов, которые относятся к категории очень высокого риска осложнений: у пациентов с сахарным диабетом, ожирением, при прогностически неблагоприятном
типе суточной кривой АД. Особого внимания заслуживают больные ИСАГ, особенно распространенной среди пожилых и отличающейся крайне высоким риском сердечно-сосудистых осложнений. В связи с этим включение методов клинической диагностики соль-чувствительности и внедрение, в т. ч. на уровне общей популяции, мер, направленных на уменьшение количества поваренной соли в пищевом рационе, необходимы с позиций совершенствования подходов к лечению АГ.



