Введение
В настоящее время артериальная гипертензия (АГ) является заболеванием, во многом определяющим высокую вероятность развития сердечно-сосудистых событий и значительный социально-экономический ущерб [1, 2]. Результаты мониторинга АГ в нашей стране свидетельствует о недостаточной первичной профилактике (как популяционной, так и среди лиц высокого риска), а также о сохранении резерва улучшения контроля уже развившего заболевания [2, 3]. Распространение АГ в РФ остается достаточно стабильным – на уровне 40 % [2].
Нарушения функции почек часто встречаются среди пациентов с АГ, особенно в сочетании с сахарным диабетом (СД), сердечной недостаточностью (СН) и др. Вовлечение почек в патологический процесс при многих заболеваниях делает необходимой разработку унифицированных подходов к своевременной диагностике нарушений функций почек [4].
Снижение скорости клубочковой фильтрации (СКФ) рассматривают в качестве маркера неблагоприятного прогноза распространенных в популяции сердечно-сосудистых заболеваний (ССЗ), что вполне соответствует утвердившейся концепции кардиоренальных взаимоотношений [4–7]. Нарушения функции почек являются важным фактором риска (ФР) развития сердечно-сосудистых осложнений (ССО). Анализ современных регистров больных на заместительной почечной терапии (ЗПТ) (гемодиализ и перитонеальный диализ) показывает, что среди причин развития терминальной хронической почечной недостаточности (ХПН) АГ занимает второе место после сахарного диабета, опередив первичные болезни почек [Rugginenti P. et al., 2004].
По данным Российского регистра ЗПТ, гипертонический нефросклероз как причина терминальной ХПН находится на 5-м месте [8]. Сердечно-сосудистая смертность в 10–30 раз выше у пациентов, находящихся на гемодиализе, чем в общей популяции.
Результаты исследований свидетельствуют, что даже самые ранние субклинические нарушения функции почек являются независимым ФР сердечно-сосудистых событий и смерти, а также повторных событий у пациентов с ССЗ [4, 9]. Так, сердечно-сосудистый риск возрастает обратно пропорционально уровню СКФ и при СКФ < 30 мл/мин превышает таковой при сохранной функции почек в 5,5 раза (NIPPON DATA90). У больных эссенциальной АГ без каких-либо ССО умеренное снижение СКФ сопровождается удвоением риска кардиальной смерти [10].
Частота умеренного, потенциально обратимого или стабилизируемого снижения СКФ значительно превосходит таковую терминальной ХПН [4]. Частота выявления легкой дисфункции почек у больных АГ, по данным последних исследований [11, 12], колеблется от 12,3 до 36,4 % [13].
Наличие тесных взаимосвязей между ССЗ и функциональным состоянием почек лежит в основе концепции кардиоренального синдрома и введения в клиническую практику в 2002 г. «наднозологического» понятия хронической болезни почек (ХБП) (National Kidney Foundation, США). ХБП диагностируется при наличии анатомического или структурного повреждения почек (микроальбуминурия [МАУ]/протеинурия, изменение осадка мочи, признаки патологии почек при инструментальном обследовании) и/или снижении СКФ < 60 мл/мин/1,73 м2, прослеженные в течение трех и более месяцев независимо от характера и этиологии нефропатии. Маркерами ХБП являются альбуминурия и СКФ, а величина последней используется для разграничения стадий заболевания и в качестве прогностического фактора [10]. Однако расчетные формулы для определения СКФ, основанные на сывороточном уровне креатинина, наиболее часто применяемые в клинической практике, имеют свои недостатки и ограничения, в результате может иметь место гипер- и гиподиагностика поражения почек при АГ.
Тот факт, что АГ занимает одно из ведущих мест в структуре причин терминальной ХПН, свидетельствует об отсутствии эффективной нефропротекции на этапе течения АГ без почечной недостаточности и в начальный период ХПН. Таким образом, диагностика ранних стадий почечного поражения необычайно актуальна.
Целью данного исследования стало изучение частоты встречаемости дисфункции почек у больных АГ при наличии или в отсутствие сопутствующей патологии в реальной клинической практике.
Материал и методы
В исследование включены 302 пациента обоего пола, госпитализированных с диагнозом АГ в кардиологическое отделение ГУЗ «Областная клиническая больница» в течение года. Диагноз АГ был установлен клинически, подтвержден неоднократными измерениями АД. Критерий включения в исследование: возраст от 30 до 60 лет. Критерии исключения: перенесенные инфаркт миокарда, инфаркт мозга или кровоизлияние в головной мозг в предшествующий месяц; расслаивающаяся аневризма аорты; наличие злокачественных новообразований, полихимиотерапия и облучение за последние 3 месяцев; наличие ВИЧ, гепатита В, С, туберкулез; беременность и период лактации.
Проведено общеклиническое обследование и для анализа учтены следующие параметры: возраст, пол, сопутствующие заболевания, частота инфарктов и инсультов в анамнезе, наличие, стадия и функциональный класс ХСН, максимальное артериальное давление (АД) в анамнезе, время дебюта и длительность АГ, ИМТ, объем талии, курение, лекарственная терапия. Проведено лабораторное и инструментальное исследование: общий анализ крови (ОАК), общий анализ мочи (ОАМ), биохимический анализ крови (общий белок, альбумин, мочевина, креатинин, АЛТ, АСТ, холестерин, триглицериды, глюкоза крови), анализ мочи по Нечипоренко, суточная протеинурия, УЗИ почек, ЭхоКГ и ВЭМ. Наличие протеинурии определено на основании ОАМ и суточной протеинурии – при уровне белка 0,03–0,30 г/л в суточной моче диагностирован МАУ, при уровне более 0,3 г/л – значимая протеинурия.
Были сформированы две группы пациентов – первую составили 211 больных с диагнозом эссенциальной АГ без сопутствующей патологии, вторую группу – 91 пациент с АГ и сопутствующей патологией.
СКФ рассчитана по формулам: оригинальной формуле Кокрофта–Гаулта (Cockroft–Gault) (нестандартизованная СКФ), формуле Кокрофта–Гаулта с пересчетом к стандартной площади поверхности тела 1,73 м2 (стандартизованная СКФ), формуле MDRD (Modification of Renal Disease Study) (стандартизованная СКФ), формуле клиники Майо (Мayo) (нестандартизованная СКФ), по формуле CKD-EPI (Chronic Kidney Disease Epidemiology Collaboration) (стандартизованная СКФ). К гиперфильтрации (ГФ) отнесли значения СКФ выше верхней границы нормы СКФ для конкретной возрастной группы пациентов в соответствии с рекомендациями National Kidney Foundation (NKF).
Статистическая обработка полученных данных проведена с использованием пакета программ STATISTICA. 10.0, «Microsoft Excel». Для проверки соответствия распределения признака нормальному использовали методы Колмогорова–Смирнова и Шапиро–Уилка, нормальным считали при р > 0,05. Для описания нормально распределенных количественных признаков использовано среднее значение признака и среднее квадратичное отклонение; для описания признаков, распределение которых отличается от нормального, указаны медиана, нижний и верхний квартили. Для сравнения двух групп с нормальным распределением количественного признака определен критерий Стьюдента для независимых групп, при отклонении от нормального – метод сравнения Манна–Уитни. Корреляцию изучили с помощью метода Спирмена. Для анализа ассоциаций качественных признаков осуществлено построение таблиц сопряженности и подсчет критерия χ². Сравнение относительных частот в двух группах проведено при анализе различий между двумя пропорциями, а также при построении таблицы 2 х 2 (критерий χ² с поправкой Йетса). Различия и корреляционные взаимосвязи считались статистически значимыми при p < 0,05.
Результаты и обсуждение
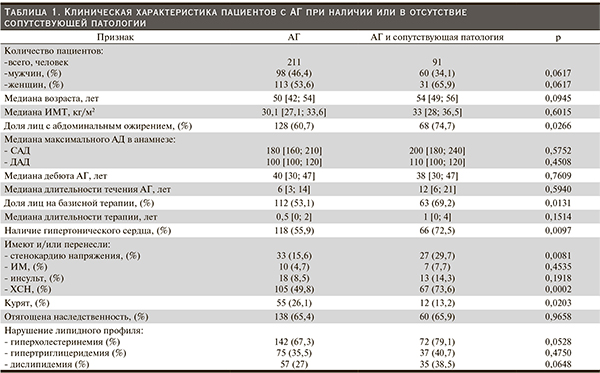
Клиническая характеристика пациентов обеих групп представлена в табл. 1. Группы сопоставимы по полу и возрасту.
Медиана возраста составила 50 лет в первой группе [42, 54] и 54 года – во второй [49, 56]. В обеих группах женщины преобладали. Медиана ИМТ в обеих группах превышала 30 кг/м2. Абдоминальное ожирение (объем талии [ОТ] – более 88 см у женщин и 102 см у мужчин) встречалось более чем у половины пациентов, причем во 2-й группе значимо чаще (74,7 против 60,7 %, р < 0,05). Медиана максимального АД в анамнезе у пациентов первой группы составила 180 и 100 мм рт. ст., второй – 200 и 110 мм рт. ст. У больных первой группы АГ возникала в более старшем возрасте и имела меньшую продолжительность течения на момент исследования. Доля пациентов, получавших на амбулаторном этапе базисную терапию, составила 53,1 % в первой группе, что меньше по сравнению со среднероссийскими показателями за 2009–2010 гг. – 66,1 % [2], и меньше, чем среди пациентов второй группы, – 69,2 % (р < 0,05). Большая приверженность к лечению среди пациентов второй группы, вероятнее всего, обусловлена более высоким АД, наличием поражения органов-мишеней и ассоциированных клинических состояний. Так, заключение о наличии «гипертонического сердца» было сделано в отношении 55,9 % пациентов первой группы и 72,5 % – второй (р < 0,05); стенокардия напряжения была выявлена у 15,6 % больных первой группы и у 29,7 % – второй (р < 0,05); наличие признаков ХСН отмечено у 49,8 % пациентов первой группы и у 73,6 % – второй (р < 0,05); в первой группе перенесли инфаркт миокарда и инсульт 4,7 и 8,5 % больных соответственно, во второй – 7,7 и 14,3 % соответственно (р > 0,05). Распространенность курения среди пациентов первой группы была в 2 раза выше (р < 0,05). Отягощенная наследственность по ССЗ встречалась с одинаковой частотой среди пациентов первой и второй групп – 65,4 и 65,9 % соответственно. Нарушения липидного профиля чаще выявлялись у пациентов второй группы.
Ожирение IIA степени чаще зарегистрировано у пациентов первой группы (62,6 и 47, 5 % соответственно, р > 0,05), III степени – второй (21,3 и 2,8 % соответственно, р < 0,05), IIБ-степень ожирения встречалась с одинаковой частотой в обеих группах (34,6 и 31,2 %, р > 0,05).
Первая стадия АГ установлена среди 36, 5% пациентов первой группы и среди 15,4 % пациентов второй, II – у 36,0 и 37,4 % соответственно, III стадия – у 27,5 и 47,3 % больных соответственно. Среди больных АГ первой группы, госпитализированных в кардиологическое отделение, три стадии заболевания встречались примерно с одинаковой частотой, у пациентов второй группы с наличием сопутствующих заболеваний чаще встречалась третья стадия заболевания – почти у половины пациентов.
У больных с АГ зарегистрированы следующие сопутствующие заболевания: заболевания суставов, прежде всего остеоартроз; выявлены у 19,8 % пациентов, СД – у 45,1 %, злокачественные новообразования и химио/лучевая терапия – у 2,2 %, урологическая патология – у 53,8 %, ХСН IIБ-стадии – у 3,3 %, другие заболевания эндокринной системы – у 3,3 % больных.
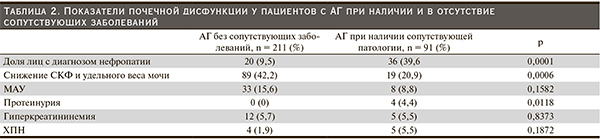
Показатели почечной дисфункции у пациентов с АГ при наличии и в отсутствие сопутствующих заболеваний представлены в табл. 2.
При анализе причины низкой частоты диагностирования нефропатии у пациентов первой группы выявлено, что расчет СКФ произведен по формуле Кокрофта–Гаулта. Уравнение Кокрофта–Гаулта предназначено для вычисления клиренса креатинина в мл/мин, но не СКФ, не стандартизовано на поверхность тела (1,73 м2). При сравнении с измеряемыми показателями СКФ (экзогенные маркеры) это уравнение систематически завышает клиренс креатинина, поскольку не учитывает его канальцевую секрецию. В состав уравнения входит вес тела, поэтому оно рекомендуется для мониторинга ренальных функций при приеме препаратов, влияющих на работу почек [14–15]. По результатам исследования MDRD, формула Кокрофта–Гаулта завышала показатель СКФ на 23 %. При наличии ожирения или отеков значение СКФ, напротив, занижается. Кроме того, формула Кокрофта–Гаулта разработана на основе данных группы мужчин, а для женщин предложен корректирующий коэффициент. Формулу можно использовать как скрининговую, но при получении значения меньше 60 рекомендовано пересчитать СКФ по формуле MDRD [4, 16].
Формула MDRD валидирована (т. е. СКФ, полученная с ее помощью, соответствует «золотому» стандарту – значению почечного клиренса 125I-иоталамата) и может быть использована, по данным Национальных клинических рекомендаций, пациентами среднего возраста с ХБП с и без диабетической нефропатии. Формула не валидирована, и ее не следует использовать детям, беременным, пожилым и другим этническим группам [4]. Недостаток формулы MDRD заключается в невозможности ее применения пациентами с легкой степенью снижения почечной функции, нормальной или повышенной СКФ, поскольку за счет гиперфильтрации поддерживается нормальный уровень СКФ. В ходе исследования выявлено, что значение MDRD занижало показатели СКФ по сравнению с реальной на 6,2 % у пациентов с ХБП и на 29 % у лиц с нормальной или высокой СКФ. Таким образом, переоценивалась распространенность хронической почечной патологии в популяции [16].
В ситуации, когда диагноз ХБП не установлен, предлагается использовать формулу расчета, разработанную в клинике Майо. В исследование, в ходе которого она создавалась, включены как пациенты с ХПН, так и здоровые лица. По той же причине формула Майо предпочтительна для определения гиперфильтрации. Данная формула включает такие показатели, как возраст, пол, креатинин сыворотки крови [16, 17].
В 2009–2011 гг. группой исследователей был разработан наиболее универсальный и точный метод расчета СКФ, работающий на любой стадии ХБП и у представителей всех трех рас – уравнения CKD-EPI. Устранены влияние различий в мышечной массе лиц разного возраста и пола и ошибка, связанная с активацией канальцевой секреции креатинина на поздних стадиях ХБП. Результаты исследований, выполненных в Санкт-Петербургском Научно-исследовательском институте нефрологии, показали, что стратификация стадий ХБП на основе CKD-EPI-метода оценки СКФ близко совпадает с данными, полученными с помощью референтного метода – плазматического клиренса 99mTcDTPA [18].
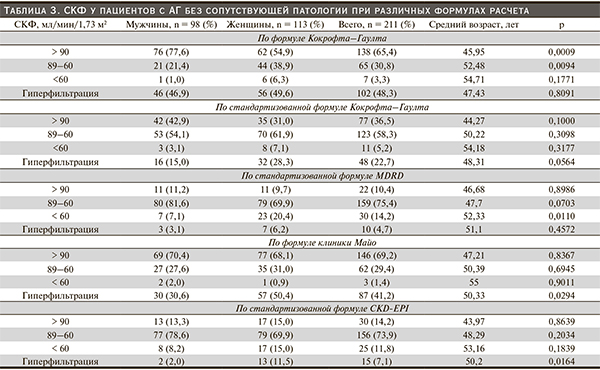
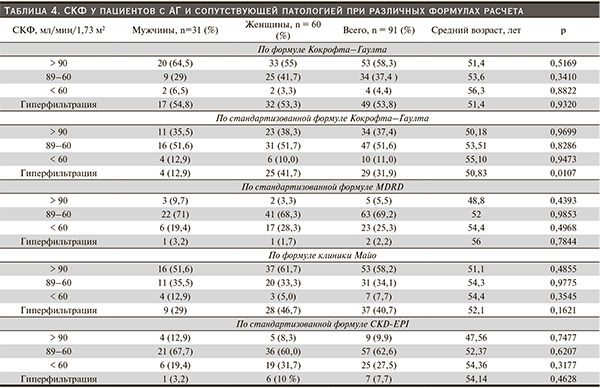
СКФ пациентов с АГ обеих групп рассчитана по 5 формулам: Кокрофта–Гаулта (нестандартизованная СКФ), Кокрофта–Гаулта с пересчетом к стандартной площади поверхности тела 1,73 м2 (стандартизованная СКФ), по формуле MDRD (стандартизованная СКФ), клиники Майо (нестандартизованная СКФ), CKD-EPI (стандартизованная СКФ). Результаты расчета СКФ у пациентов первой и второй групп представлены в табл. 3 и 4.
Была выделена подгруппа пациентов с гиперфильтрацией.
У пациентов обеих групп при снижении значений СКФ наблюдалось возрастание среднего возраста пациентов. В 1-й группе пациентов значимые гендерные различия наблюдались в подгруппе СКФ по Кокрофту–Гаулту (нестандартизованная СКФ) – у мужчин преобладали значения СКФ > 90 мл/мин, у женщин – 60–89 мл/мин, что обусловлено абсолютными значениями СКФ; в подгруппе СКФ по MDRD значения < 60 мл/мин значительно чаще регистрировались у женщин; в подгруппах СКФ по Майо и СКФ по CKD-EPI у женщин гораздо чаще выявлялась ГФ. Во 2-й группе значимые гендерные различия регистрировались только в подгруппе СКФ по Кокрофту–Гаулту (стандартизованная СКФ) – гиперфильтрация чаще выявлялась у женщин.
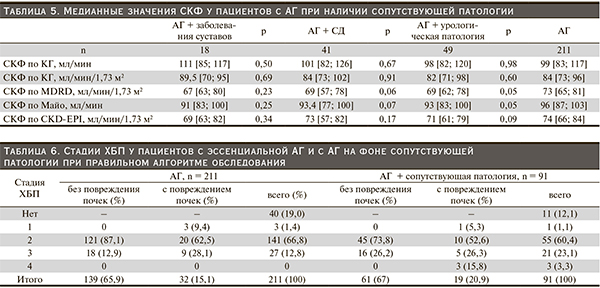
В табл. 5 представлены медианные значения СКФ у пациентов с АГ без сопутствующей патологии и у пациентов с СД, урологическими и заболеваниями суставов.
Значимых различий между медианными значениями СКФ у пациентов с эссенциальной АГ и у больных АГ при наличии сопутствующей патологии не выявлено, тем не менее отмечена тенденция к снижению СКФ у больных АГ при наличии сопутствующей патологии. Наибольшие значения СКФ наблюдались при расчетах по оригинальной формуле Кокрофта–Гаулта, затем в порядке убывания – по формуле Майо, стандартизованной формуле Кокрофта–Гаулта, CKD-EPI, MDRD. Действительно, нецелесообразно применение оригинальной формулы Кокрофта–Гаулта для общего скрининга пациентов с АГ на наличие дисфункции почек: для решения такой задачи больше подходит стандартизованная формула. Формула СКФ по Майо дает значения, превышающие СКФ по стандартизованной формуле Кокрофта–Гаулта примерно на 10 мл/мин, следовательно, также мало подходит для скрининга. Медианные значения СКФ, вычисленные по остальным трем формулам, ниже 90 мл/мин, что соответствует начальной стадии снижения функции почек (2-я стадия ХБП).
В Национальных рекомендациях по функциональному состоянию почек и прогнозированию сердечно-сосудистого риска от 2008 г. при скрининге пациентов с ССЗ рекомендуется диагностировать ХБП при наличии признаков повреждения почек (МАУ, протеинурии или патологического отношения альбумин/креатинин мочи). В отсутствие признаков повреждения почек диагностировать ХБП рекомендовано при снижении СКФ менее 60 мл/мин/1,73 м2 по формуле MDRD, в остальных случаях – выставлять в диагнозе «АГ с или без снижения СКФ».
Нами в обеих группах пациентов выставлены условные стадии ХБП в зависимости от СКФ по формуле CKD-EPI, что отражено в табл. 6. В итоге у подавляющего большинства лиц (65,9 % в 1-й группе и 67,0 % во 2-й) выявлено снижение СКФ, но отсутствуют признаки повреждения почек, и зачастую снижение СКФ у данных пациентов более выражено, чем у больных МАУ/протеинурией.
Выводы
- У подавляющего большинства больных АГ в возрасте 30–60 лет независимо от наличия сопутствующей патологии выявлена дисфункция почек в виде снижения СКФ.
- У пациентов с АГ имеется недостаточная выявляемость гипертонической нефропатии.
- Для выявления ХБП у пациентов с сердечно-сосудистой патологией целесообразно пользоваться стандартизованной формулой Кокрофта–Гаулта, формулами CKD-EPI и MDRD.
- Умеренное снижение СКФ и гиперфильтрация чаще встречаются среди женщин.