Артериальная гипертензия (АГ) и нарушение обмена мочевой кислоты (НОМК) относятся к важным популяционно значимым проблемам внутренней медицины ввиду их широкой распространенности среди населения разных возрастных групп, в т.ч. трудоспособной его части, а также развития серьезных осложнений [1, 2].
На возможную связь гиперурикемии (ГУ) с АГ и ассоциированными с ней сердечно-сосудистыми заболеваниями указал еще в первой половине ХХ в. выдающийся отечественный клиницист Е.М. Тареев. Им было замечено, что больные уратным дисметаболизмом и суставной подагрой погибают от хронической почечной недостаточности и сердечно-сосудистых катастроф, которые у них возникают в более молодом возрасте, чем у лиц без НОМК [3].
Но еще ранее, в 1897 г., N.S. Davis указал на роль ГУ в генезе АГ и почечного поражения, предполагая гемодинамический механизм воздействия МК на повышение тонуса почечных артериол [4].
Спектр почечных осложнений АГ изучен более подробно [5], так же как методы их лечения и профилактики. В то же время варианты поражения почек, ассоциированные с НОМК, исследованы в меньшей степени. Кроме уратного нефролитиаза и достаточно редкой острой мочекислой канальцевой блокады прогностическое значение при НОМК имеет хроническое тубулоинтерстициальное поражение почек, ведущее к тубулоинтерстициальному фиброзу и почечной недостаточности [6]. При этом АГ, сочетающаяся с ГУ, может быть как причиной, так и следствием тубулоинтерстициального поражения почек [7, 8]. Показано, что гиперпродукция мочевой кислоты приводит к тубулоинтерстициальному поражению сравнительной быстро, проявляясь в первую очередь АГ [9]; с другой стороны, ГУ служит одним из факторов, ускоряющим поражение почек при эссенциальной АГ [10].
Проведенные к настоящему времени эпидемиологические исследования дают убедительные основания считать ГУ наряду с АГ и сахарным диабетом независимым общепопуляционным фактором риска хронической болезни почек (ХБП) [11–13].
При этом повреждающее действие избытка мочевой кислоты и ее солей на почечную ткань не ограничивается только их кристаллизацией в просвете почечных канальцев и интерстиции. По современным представлениям, одним из возможных сопрягающих АГ и ГУ механизмов почечного повреждения являются системная и локально-почечная эндотелиальная дисфункция, развитие эндотелиально- и эпителиально-мезенхимальной трансдифференциации с продукцией экстрацеллюлярного матрикса – основы тубулоинтерстициального фиброза [14–18].
В экспериментальных условиях показано, что при ГУ возрастает инфильтрация тубулоинтерстициальных структур макрофагами и миофибробластами, повышается экспрессия ими коллагена, остеопонтина, молекул адгезии ICAM-I, возникает депрессия локально-почечных систем фибринолиза, эти изменения частично обратимы при назначении аллопуринола [19–21]. Клинических работ данного направления недостаточно.
 В связи с этим представляют интерес исследования, выполненные в последние годы в клинике им. Е.М. Тареева, по изучению экскретируемых с мочой больных хроническим гломерулонефритом биомаркеров тубулоинтерстициального повреждения/фиброза – ТИФ (как отражения эпителиально-мезенхимальной трансдифференциации), в которых показана информативность такого подхода в оценке прогноза прогрессирования почечной недостаточности [22]. Можно предполагать, что определение мочевых биомаркеров тубулоинтерстициального повреждения/ТИФ наряду с традиционными маркерами локально-почечной и системной эндотелиальной дисфункции у больных АГ с НОМК позволит оценить степень фиброзного ремоделирования тубулоинтерстиция и даст возможность персонифицировать прогноз заболевания в целом.
В связи с этим представляют интерес исследования, выполненные в последние годы в клинике им. Е.М. Тареева, по изучению экскретируемых с мочой больных хроническим гломерулонефритом биомаркеров тубулоинтерстициального повреждения/фиброза – ТИФ (как отражения эпителиально-мезенхимальной трансдифференциации), в которых показана информативность такого подхода в оценке прогноза прогрессирования почечной недостаточности [22]. Можно предполагать, что определение мочевых биомаркеров тубулоинтерстициального повреждения/ТИФ наряду с традиционными маркерами локально-почечной и системной эндотелиальной дисфункции у больных АГ с НОМК позволит оценить степень фиброзного ремоделирования тубулоинтерстиция и даст возможность персонифицировать прогноз заболевания в целом.
Целью исследования было на основании изучения экскретируемых с мочой биомаркеров тубулоинтерстициального повреждения (МСР-1 и β2-МГ), уровня системных и локально-почечных маркеров эндотелиальной дисфункции (МАУ, ЭТ-1) определить факторы прогрессирования поражения почек у больных АГ с НОМК для оценки прогноза и выбора оптимальной тактики ведения.
Материал и методы
В работе исследован 81 пациент с АГ 1-й степени, в т.ч. 66 с НОМК (группы исследования) и 15 без НОМК. Из 66 больных группы исследования 7 (2 мужчин и 5 женщин, средний возраст – 48,9 ± 3,3 года) страдали гиперурикозурией (ГУУ) без повышения уровня мочевой кислоты в крови (группа 1), 55 (43 мужчин и 10 женщин, средний возраст – 48,3 ± 1,5 года) – ГУ (группа 2), 6 (5 мужчин и 1 женщина, средний возраст – 59,7 ± 2,1 года) – ГУ и ХБП 3-й стадии (группа 3). Контрольную группу составили 15 больных (8 мужчин и 7 женщин, средний возраст – 54,1 ± 2,3 года), не имеющих НОМК.
Критерии исключения: ХБП 4–5-й стадий, ИМТ > 30, сахарный диабет, полный метаболический синдром, клинические проявления атеросклероза, пороки сердца, кардиомиопатии, хроническая сердечная недостаточность, острые инфекционные заболевания и обострение хронических инфекций, системные васкулиты и заболевания соединительной ткани, курение, работа в условиях с превышением предельно-допустимых концентраций свинца.
Всем больным проведено общеклиническое исследование, включившее биохимический анализ крови и мочи, инструментальные методы (суточное мониторирование АД, УЗИ почек и трансторакальная ЭХО-КГ), изучение функционального состояния почек (определение СКФ с применением расчетной формулы по Кокрофту–Голту/1,73 м2), проводимые по плану обследования больных в нефрологическом отделении.
Кроме того, всем больным определяли суточную экскрецию мочевой кислоты, клиренс мочевой кислоты, фракционную экскрецию мочевой кислоты (клиренс мочевой кислоты/клиренс креатинина х 100 %), относительную плотность мочи в 8 порциях в течение суток. Специальные методы исследования включили количественное определение биомаркеров методом ELISA: в cуточной моче – микроальбуминурии (МАУ) (BIOMEDICA GRUPPE, Германия, № 9113C), β2-микроглобулина (β2-МГ) – белка тубулярного происхождения (ORGENTEC, Германия, 5ВМ03514), моноцитарного хемотаксического протеина-1 (МСР-1) – основного профиброгенного цитокина (ORGENTEC, Германия, 5ВМ03514); в плазме крови – эндотелин-1 (ЭТ-1) (BIOMEDICA GRUPPE, Германия, № 9113C).
Статистическую обработку полученных результатов осуществляли с помощью пакета программ SPSS. Для сравнения величин использовали непараметрический метод (критерий Mann–Whitney U-тест). Для оценки достоверности различий частот признака в сравниваемых группах применяли критерий χ2 (хи-квадрат). Корреляционный анализ проводили с применением коэффициента ранговой корреляции Спирмена (Rs), многофакторный анализ – с помощью метода множественного линейного регресса с построением roc-кривой. Достоверными считали различия при р < 0,05.
Результаты и обсуждение
Клиническая характеристика обследованных больных представлена в табл. 1. Больные ГУ (группы 2 и 3) имели достоверно более высокий уровень мочевой кислоты, чем больные с ГУУ (группа 1) и контрольной группы без НОМК, что иллюстрирует принцип формирования групп. Самый высокий уровень ГУ был у 6 больных ГУ и ХБП (группа 3). Среди больных ГУ группы 2 относительная плотность мочи была снижена в 32 % случаев, несмотря на нормальный средний показатель. У больных ГУ и ХБП (группа 3) снижение относительной плотности отмечено в 100 %, в связи с чем ее средний показатель был достоверно ниже, чем у больных не только контрольной, но и остальных групп – с ГУУ и ГУ (групп 1 и 2). Ни у одного больного групп 1 и контроля снижения относительной плотности мочи не зарегистрировано.
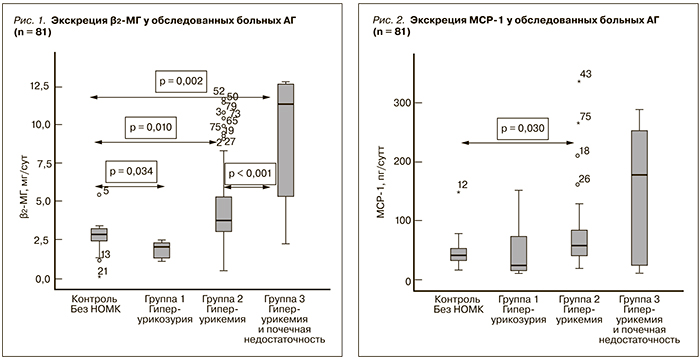
При изучении экскреции β2-МГ с мочой нами показано, что у больных АГ с ГУ (группа 2) она была достоверно выше – 3,78 (2,88; 5,33) мг/сут, чем у больных АГ с ГУУ (группа 1), – 2,03 (1,18; 2,36) мг/сут (р < 0,001), и без НОМК – 2,83 (2,38; 3,29) мг/сут (р = 0,01). Наиболее высокой она была у больных ГУ и ХБП (группа 3) – 11,33 (4,56; 12,66) мг/сут (рис. 1). Выявлена сильная прямая корреляция между уровнем экскреции с мочой β2-МГ и степенью урикемии: Rs = 0,537, р < 0,001.
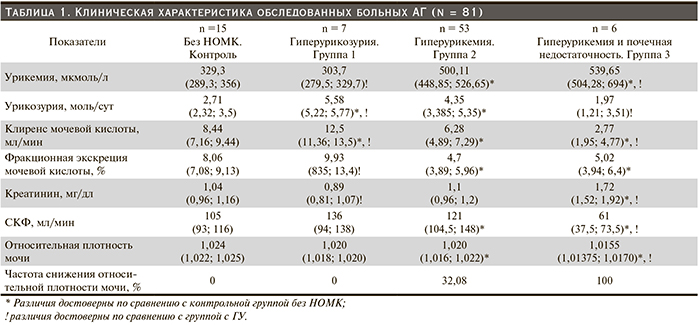
Сходный характер изменений был обнаружен и в отношении экскреции МСР-1 – основного профиброгенного цитокина (рис. 2): у больных ГУ (группа 2) в среднем она была достоверно выше – 57,58 (38,68; 88,66) пг/сут, чем в контрольной группе без НОМК, – 41,11 (32,10; 53,90) пг/сут, а у отдельных больных была сопоставимой и даже превышала ее уровень у больных ГУ и ХБП (группа 3) – 177,46 (21,26; 260,21) пг/сут, но в среднем уровень экскреции был наиболее высоким у больных ГУ и ХБП (группа 3). Между мочевым показателем МСР-1 и степенью урикемии также выявлена сильная прямая корреляция: Rs = 0,318, р = 0,004.
Нами изучена связь мочевых биомаркеров с концентрационной функцией почек, оцененной по показателю максимальной плотности мочи за сутки. Выявлена жесткая обратная корреляция этого показателя с уровнем обоих биомаркеров – и β2-МГ (Rs = -0,392, р < 0,001) и МСР-1 (Rs = -0,530, р < 0,001). Эта корреляция оказалась наиболее сильной у больных ГУ (группа 2) и больных ГУ и ХБП (группа 3) (табл. 2), что подтверждает значение мочевых биомаркеров β2-МГ и МСР-1 в оценке степени повреждения тубулоинтерстиция у больных АГ с сопутствующей гиперурикемией.
Индивидуальный анализ высоких («выскакивающих») значений МСР-1 в моче показал, что именно эти больные принадлежали к 32 % больных этой группы со снижением концентрационной функции почек.

Изучение МАУ – показателя как локально-почечной, так и системной эндотелиальной дисфункции (рис. 3), показало, что МАУ более 30 мг/сут выявляется у 13 % больных без НОМК (контроль), у 45 % больных ГУ (группа 2) и у всех больных (100 %) ГУ и ХБП (группа 3). Между величиной МАУ и степенью ГУ также обнаружена прямая корреляционная связь: Rs = 0,411, р < 0,001.
В результате исследования биомаркера системной эндотелиальной дисфункции ЭТ-1 (рис. 4) было выявлено повышение его сывороточного уровня у 25 % больных без НОМК (контроль) и с ГУУ (группа 1), у 50 % больных ГУ (группа 2) и у 100 % больных ГУ и ХБП (группа 3). Абсолютный показатель ЭТ-1 у больных ГУ (группа 2) был выше, чем у пациентов без НОМК, и значительно выше (в 3 раза) у больных ГУ и ХБП (группа 3). Между сывороточным уровнем ЭТ-1 и степенью ГУ также выявлена прямая корреляция (Rs = 0,453, р < 0,001).
Полученные данные согласуются с данными литературы [15] и свидетельствуют о дополнительном значении мочевой кислоты в развитии системной и локально-почечной эндотелиальной дисфункции у больных АГ.
Достоверная прямая корреляция обнаружена нами между показателями эндотелиальной дисфункции, включая МАУ, и изученными биомаркерами тубулоинтерстициального повреждения – β2-МГ и МСР-1, более сильная – с β2-МГ (Rs = 0,462 р < 0,001).
Из 53 больных АГ с ГУ (группа 2) 20, имеющих наиболее высокие («выскакивающие») показатели β2-МГ и МСР-1, характеризовались достоверно большим снижением относительной плотности мочи (р = 0,002), а также более высоким уровнем МАУ (р = 0,050), ЭТ-1 (р = 0,028), что указывало на тесную взаимосвязь процессов эндотелиальной дисфункции и эпителиально-мезенхимальной трансдифференциации, ведущей к фиброзному ремоделированию тубулоинтерстициальной ткани почек и прогрессированию почечной недостаточности. С другой стороны, выраженность эндотелиальной дисфункции у больных с тубулоинтерстициальным повреждением почек/ТИФ, коррелирующая со степенью НОМК, может обусловить усиление АГ по механизму обратной связи.
Нами проведен многофакторный анализ, в результате которого подтверждено значение мочевых биомаркеров – МСР-1 (р = 0,001), β2-МГ (р = 0,005), МАУ (р = 0,042), сывороточного уровня креатинина (р = 0,026) – как независимых предикторов снижения относительной плотности мочи, а МСР-1 (р = 0,026), показателя относительной плотности мочи (р = 0,011), МАУ (р < 0,001), толщины межжелудочковой перегородки (р < 0,001), уровня систолического АД (р = 0,019), липопротеидов низкой плотности (р = 0,027) – как независимых предикторов развития почечной недостаточности. Таким образом, подтверждено значение мочевых биомаркеров МСР-1 и МАУ для оценки прогноза поражения почек у больных АГ с ГУ.
Нами проанализирована динамика изменения изученных мочевых биомаркеров МСР-1 и МАУ у 12 больных АГ с ГУ (все мужчины, средний возраст – 48,17 ± 3,01 года), которым в течение года наряду с антигипертензивной терапией ингибиторами ангиотензинпревращающего фермента или блокаторами рецепторов ангиотензина-II проводили также строгий контроль за соблюдением низкопуриновой диеты в сочетании с приемом половиной из них аллопуринола (100 мг/сут).
В результате отмечено достоверное снижение МАУ (р = 0,009), а также тенденция к снижению МСР-1, более значимая для больных с достигнутым целевым уровнем урикемии.
В связи с этим можно полагать, что высокий уровень МСР-1 в моче больных АГ с НОМК служит значимым фактором риска тубулоинтерстициального поражения почек с развитием ТИФ. Из всех изученных биомаркеров именно МСР-1 наиболее информативен и может использоваться для персонифицированной оценки прогноза, связанного с прогрессированием поражения почек. В связи с чем персистенция высокого уровня экскреции этого биомаркера является неблагоприятным прогностическим признаком и служит показанием к активной (настойчивой) антигиперурикемической терапии.



