Патогенез поражения почек связан с мембранотоксическим воздействием иммунных комплексов, эндокринно-метаболическими и гемодинамическими нарушениями, такими как артериальная гипертензия (АГ), в т.ч. реноваскулярная, дислипидемия, протеинурия, ишемия почки, токсическое воздействие высокобелковой диеты. При нарушении обменных процессов почки первыми компенсируют происходящие изменения благодаря системе ауторегуляции. Почечная регуляция баланса жидкости и натрия играет решающую роль в долгосрочном контроле артериального давления (АД) в норме и при патологии. При увеличении индекса массы тела (ИМТ) и процента жировой массы тела симпатическая активность становится выше, увеличивается концентрация катехоламинов в сыворотке крови. Стимуляция эфферентных нервов почек катехоламинами меняет гемодинамику: повышается реабсорбция натрия и жидкости в проксимальных канальцах почек, возникает гиперволемия с повышенным содержанием натрия в клетках эндотелия сосудов. Блокируется активность натрий/калий-зависимой АТФазы и кальций-магниевой АТФазы. Содержание натрия и кальция внутри клеток и чувствительность сосудов к прессорному воздействию ангиотензина и катехоламинов увеличиваются, возникает спазм сосудов и повышается общее периферическое сопротивление, что приводит к развитию стойкой АГ [1].
Характер течения АГ определяется выраженностью эндокринных и метаболических нарушений, ухудшением микроциркуляции внутренних органов. Поражение сосудов микроциркуляторного русла почек влечет за собой снижение их функции, формирование нефропатии и развитие осложнений. Дислипидемия у женщин репродуктивного возраста способствует атерогенному поражению почечных артерий и в 40–60% случаев усугубляет течение АГ реноваскулярным компонентом. Системная АГ по силе повреждения во много раз превосходит влияние метаболических факторов в отношении прогрессирования поражения почек [1, 2]. Выявлено асимметричное изменение почек, выявляющееся более отчетливо тонкими методами верификации [1]. Первая фаза нарушений почечной гемодинамики характеризуется нормальным уровнем клубочковой фильтрации при снижении эффективного почечного плазмотока и повышении резистентности почечных сосудов. Дальнейшее повышение АД приводит к нарушению эффективного почечного плазмотока и клубочковой гипертензии – это ведущий гемодинамический фактор прогрессирования нефропатии, оценить который в клинических условиях пока сложно [3].

Повышение активности ренин-ангиотензиновой системы почек формирует внутриклубочковую гипертензию. Ангиотензин II взаимодействует с собственными рецепторами и вызывает селективную вазоконстрикцию эфферентных клубочковых артериол. Вследствие этого возникает «зияние» афферентных артериол клубочков, меняется механизм ауторегуляции их тонуса, высокое системное АД беспрепятственно передается на сосуды клубочков. В норме тонус афферентной артериолы защищает клубочек от повреждений вследствие колебаний системного АД, обеспечивая постоянство внутриклубочкового давления и внутриклубочковой микроциркуляции. При нарушении ауторегуляции ее тонуса происходит повышение внутриклубочкового давления. Этот каскад событий ведет к развитию гиперперфузии, гиперфильтрации, микропротеинурии при ранее отсутствующих клинических признаках почечной патологии [4].
Участие мочевыделительной системы, прежде всего почек, в патогенезе соматической патологии беременных, ведущей в конечном итоге к инвалидизации и смерти, неоспоримо. Актуальна проблема поиска ранних маркеров поражения почек. Проводимые исследования в большинстве случаев отражают функциональные изменения почек: скорость клубочковой фильтрации, микроальбуминурию, эффективный почечный плазмоток, эффективный почечный кровоток, фильтрационную фракцию, активность ренина плазмы, альдостерон плазмы и суточную экскрецию альдостерона с мочой, концентрацию электролитов, уровень мочевой кислоты, суточную протеинурию и т.д. В меньшей степени в научной литературе показаны параметры структурной перестройки почек в процессе гестации в норме и при соматической патологии [4]. Данные, как правило, основаны на результатах патоморфологического анализа. Однако в клинической практике важны безопасные, доступные и достоверные методы оценки структуры и состояния почек, мониторинга процесса гестации или развития болезни, эффективности применяемой терапии. Ультразвуковой (УЗ) метод исследования почек соответствует всем указанным требованиям: он прост, доступен, недорог, не связан с ионизирующим излучением, дает возможность проводить структурно-морфологическую оценку исследуемых органов в полном объеме. УЗ-исследование почек в большинстве случаев является одним из рутинных стандартных методов обследования женщин репродуктивного возраста, позволяет обнаруживать изменения в почках до их клинических проявлений, оптимизировать раннюю диагностику. Несмотря на многообразие публикаций по УЗ-диагностике заболеваний почек, отсутствуют конкретные биометрические критерии состояния почек у беременных женщин с соматической патологией и без нее [1, 4]. В научной литературе недостаточно данных о ремоделировании почек в период беременности, при наличии АГ и ожирения. Таким образом, УЗ-семиотика почек у беременных женщин, поиск биометрических критериев нормы и нефропатии при различных заболеваниях, особенно в ранней стадии, весьма актуальны.
Цель настоящей работы – определить структурные особенности почек у беременных женщин с соматическими заболеваниями и без них.
Задачи исследования:
- Определить структурные УЗ-особенности почек у соматически здоровых женщин в период гестации.
- Выявить УЗ-параметры ремоделирования почек при гестационной гипертензии, АГ и ожирении у беременных женщин.
Материал и методы
Исследования проводились на базе родильного отделения ОГБУЗ «Клиническая больница № 1», ОАО Медицинский центр «Гинея» (г. Смоленск) в 2007–2014 гг.

Проведено комплексное клиническое обследование 473 амбулаторных и стационарных пациенток женского пола в возрасте от 18 до 46 лет (средний возраст – 32,3±13,7 года) с соматической патологией в период беременности: группа 1 (n=166) – с гестационной гипертензией (длительность заболевания – 28,8±4,0 недели, среднесуточное систолическое АД при поступлении – 155±12, диастолическое АД – 86±12 мм рт. ст.), группа 2 (n=64) – с АГ (длительность заболевания – 12,0±4,0 года, среднесуточное систолическое АД при поступлении – 165±12, диастолическое АД – 95±10 мм рт. ст.), группа 3 (n=90) – беременные с ожирением (ИМТ на сроке до 12 недель – 32,1±2,7 кг/м2). Контрольную группу составили 153 беременные женщины в аналогичном возрастном диапазоне без клиники соматической патологии и указаний на нее в анамнезе.
Критерием включения в основную группу стало наличие указанной патологии в период гестации и живого плода.
Критерии исключения из данного исследования: анамнестические данные, подтверждающие вторичную (симптоматическую) АГ; АГ выше 2-й ст. тяжести; наличие алкогольной или лекарственной зависимости; психоневрологические заболевания, препятствующие включению пациентки в исследование; пороки сердца; ожирение неалиментарной природы; сахарный диабет 1 типа; системные заболевания соединительной ткани; экстрагенитальные заболевания высокой степени тяжести; отказ пациентки от участия в исследовании; цереброваскулярные и онкологические заболевания, диагностированные специалистами на догоспитальном этапе.
Все пациентки были обследованы стационарно в соответствии с диагностическими стандартами для исключения вторичных АГ (Приказ Министерства здравоохранения Российской Федерации «Об утверждении порядка медицинской помощи больным с сердечно-сосудистыми заболеваниями» № 918н от 15.11.2012) [5, 6].
Для диагностики степени АГ использовались Национальные рекомендации по диагностике и лечению артериальной гипертензии у беременных 2010 г., принятые ВНОК и Российским медицинским обществом по артериальной гипертонии [7].
ИМТ (индекс Кетле) рассчитывали по формуле: ИМТ = вес / рост2 (кг/м2). Площадь поверхности тела (ППТ) рассчитывали по формуле Мостеллера (Mosteller, 1987): ППТ (м2) = √ вес (кг) × рост (см) ÷ 3600 [8].
Оценка массы тела и степени ожирения проведена по классификации ВОЗ 1997 г.: нормальный диапазон ИМТ – 18,5–24,9 кг/м2, ожирение I степени (ИМТ – 30,0–34,9 кг/м2); II степени (ИМТ – 35,0–39,9 кг/м2); III степени (ИМТ >40 кг/м2).
Всем пациенткам было проведено УЗ-исследование почек в В-режиме конвексным датчиком 3,5 МГц по стандартной методике (Митьков В.В., 2006). Исследование проведено натощак, мочевой пузырь исследуемых пациенток был пуст, проводили эхо-визуализацию почек с переднебоковой поверхности живота и с поверхности спины. При биометрии в стандартизированной плоскости сечения почки, получаемой при локации из кособоковой поверхности, определяли следующие линейные размеры почек: продольный размер во фронтальной проекции (L), толщину (Т) и ширину (Н) правой (R) и левой (L) почек в плоскости поперечной продольной оси на уровне ворот органа. Кроме того, определяли толщину паренхимы, коркового слоя почек, диаметр чашечек и лоханки. Вычисляли объем почек (V) в см3 по формуле: V = 0,53 × L×H×T; индекс формы почек (J) по формуле: J = L/Н+Т. Устанавливали различные соотношения почечных параметров между собой и по отношению к антропометрическим параметрам.
Результаты и их обсуждение
УЗ-исследование, или сонография, является одним из наиболее бурно развивающихся методов визуализации. Будучи относительно недорогим, высокоинформативным, практически безопасным для персонала и беременных женщин, сонография признана весьма информативным методом диагностического поиска при большинстве патологических состояний различных органов и систем человеческого организма.
Нами проведен анализ УЗ-изменений почек с целью выявления предикторов ремоделирования почек у беременных женщин с АГ, гестационной гипертензией, ожирением и без соматической патологии, УЗ-мониторинга в период гестации и в процессе развития болезни.
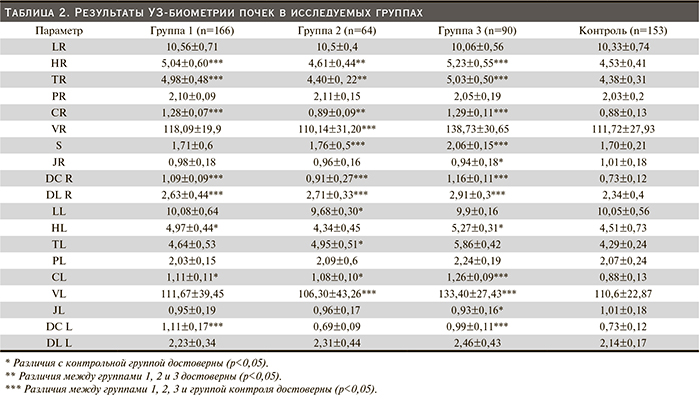
 Эхографическая картина почек у беременных в первом и третьем триместрах беременности в контрольной группе по большинству показателей соответствовала норме: почки были бобовидной формы, имели четкие и ровные контуры, эхогенность кортикального слоя была нормальной. Результаты УЗ-биометрии почек в исследуемых группах представлены в табл. 1.
Эхографическая картина почек у беременных в первом и третьем триместрах беременности в контрольной группе по большинству показателей соответствовала норме: почки были бобовидной формы, имели четкие и ровные контуры, эхогенность кортикального слоя была нормальной. Результаты УЗ-биометрии почек в исследуемых группах представлены в табл. 1.
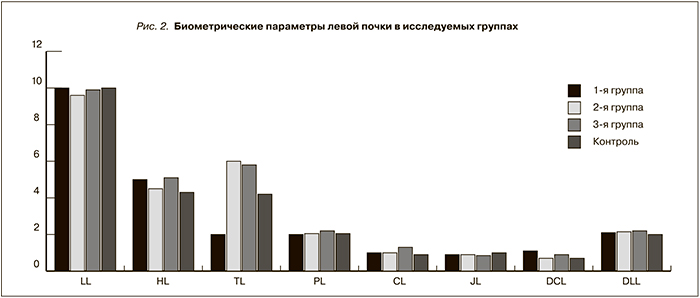
Длина почек – единственный параметр, оставшийся неизменным на протяжении гестации и после нее (р>0,05). Согласно проведенному факторному анализу, выявлена связь длины почек с ростом женщин. Объем почек за счет их ширины и толщины, толщина паренхимы и кортикального слоя, диаметр чашечек увеличивались к третьему триместру беременности, индекс формы уменьшался (р<0,05). Через 3 года после родоразрешения ширина и объем почки, толщина кортикального слоя, диаметры чашечек и лоханки были сопоставимы с исходными соответствующими УЗ-параметрами. Достоверных различий параметров правой и левой почек не выявлено. Следует отметить, что, по нашим данным, диаметр чашечек в третьем триместре выходит за пределы нормальных значений в группе здоровых беременных женщин, превышая верхнюю установленную границу нормы в 1,8 раза.
Представленные в табл. 2 данные свидетельствуют, что длина правой почки, толщина паренхимы обеих почек, диаметр лоханок левой почки в исследуемых группах достоверно не увеличивались (р=0,3). Максимальные значения биометрических параметров почек выявлены в группе 3 (беременные с ожирением): объем правой почки увеличен за счет толщины и ширины, объем левой почки – за счет толщины, увеличены диаметры чашечек и лоханки по сравнению с группой контроля и группами беременных с гипертензией, толщина кортикального слоя по сравнению с контрольной группой и группой 2 (беременные с АГ). В группе 2 большинство биометрических параметров были сопоставимы с контрольной группой и достоверно в меньшую сторону отличались от одноименных параметров в группах 1 и 3: ширина правой и левой почек, толщина кортикального слоя правой и левой почек.
В группе беременных с хронической АГ увеличен диаметр чашечек и лоханки правой почки (р=0,03, р=0,04) и по сравнению с контрольной группой уменьшен объем левой почки за счет ее длины и толщины (р=0,007, р=0,003, р=0,015 соответственно). Корковый слой правой почки в группе беременных с АГ был уменьшен по сравнению с контролем, в других исследуемых группах существенно не различался. Индекс формы правой и левой почек был меньше у пациентов 3-й группы по сравнению с контролем (р<0,05); достоверных различий между группами 1 и 3 не обнаружено (р=0,522). Индекс формы левой почки уменьшен в группе 3 по сравнению с контролем (р=0,026).
Рис. 1–3 графически отражают биометрические параметры почек в исследуемых группах.

Соотношения линейных размеров почек между собой и с антропометрическими параметрами – коэффициент асимметрии (КА=VR/VL), ширина почки к ее толщине (Н/Т) у наблюдавшихся женщин представлены в табл. 3. Отмечается достоверное увеличение КА, соотношения объема правой почки к ППТ, объема почек к росту у беременных с ожирением по сравнению с другими группами и контролем. Соотношение ширины и толщины почек увеличены справа в группах 1 и 2 по сравнению с контролем и группой 3, а слева – лишь в группе 1 по сравнению с другими группами и контролем. Наблюдается уменьшение соотношения объема и длины почек к весу и ППТ во всех группах. Наиболее выражены изменения VR/M в группе 3; LR/M, LL/M, LR/S, LL/S – в группах 2 и 3; VL/M – в группе 2.
Заключение
Анализируя полученные данные биометрии почек, можно выделить УЗ-предикторы ремоделирования почек, выявленные у беременных женщин с гестационной гипертензией и хронической АГ, с ожирением и без соматической патологии:
- УЗ-параметрами почек, которые можно рассматривать в качестве биометрических предикторов их структурных изменений, прогрессирующих в течение гестации, являются увеличение объема почек, уменьшение индекса формы и дилатация чашечно-лоханочной системы; при хронической АГ беременных: увеличение индекса асимметрии почек, уменьшение индекса формы почек, уменьшение толщины коркового слоя почек, отсутствие динамики объема и параметров чашечно-лоханочной системы к 3-му триместру; при гестационной гипертензии: увеличение толщины кортикального слоя, диаметра чашечек и лоханки; при ожирении: увеличение объема почек за счет пропорционального увеличения всех линейных размеров обеих почек, увеличение соотношения объема почек к росту.
- Структурные изменения, выявленные при УЗ-биометрии почек, взаимосвязаны с антропометрическими параметрами.
- Функциональные и структурные изменения почек статистически значимо взаимосвязаны и отражают ремоделирование почек в процессе гестации у здоровых женщин, при ожирении, гестационной и хронической АГ.



