Беременность при хронической болезни почек (ХБП) сопровождается повышением по сравнению с общей популяцией частоты акушерских и перинатальных осложнений [1, 2]. У пациенток с почечным аллотрансплантатом (ПАТ), большинство из которых являются больными ХБП 2-й или 3-й стадии, при беременности также отмечается более высокая частота материнских и фетальных осложнений [3], хотя благоприятный исход достигается в 65–92% случаев [4, 5]. У таких беременных повышен риск преэклампсии (ПЭ), гестационного сахарного диабета, преждевременных родов, низкого веса детей при рождении, а также необходимости кесарева сечения [6]. По данным недавно выполненного мета-анализа, частота ПЭ у женщин с трансплантированной почкой в 7 раз превышает соответствующий показатель в общей популяции (27 против 3,8%) [7]. В то же время частота развития отторжения ПАТ во время беременности невысока и составляет в среднем 4,2%. Было показано, что анти-HLA-донорспецифические антитела, способные вызывать гуморальное отторжение трансплантата, появляются de novo примерно при 6% беременностей [8].
Факторы, способствующие благоприятному течению беременности у женщин с ПАТ: интервал между трансплантацией почки (ТП) и наступлением беременности не менее 2 и не более 7 лет, уровень креатинина сыворотки не выше 0,15 ммоль/л, суточная протеинурия не более 0,5 г, уровень артериального давления (АД) не выше 140/90 мм рт.ст., минимальные дозы иммуносупрессантов (доза преднизолона – менее 15 мг/сут, концентрация циклоспорина А (ЦСА) в крови – 100–150 нг/мл) [9].
Клиническое наблюдение. Больная К. 1982 г.р. страдала кистозной дисплазией почечной ткани. У старшего брата пациентки 1975 г.р. диагностирован синдром Фанкони, с 7-летнего возраста у него отмечено прогрессирование хронической почечной недостаточности. В 1989 г. брату выполнена первая ТП, в 1996-м возобновлено лечение гемодиализом в связи с угасанием функции трансплантата. В 1998 г. произведена повторная успешная ТП; в настоящее время брат пациентки живет с функционирующим ПАТ.
У нашей больной с 2000 г. (с 18 лет) был отмечен рост уровня креатинина сыворотки. В мае 2005 г. (в возрасте 23 лет) в связи с развитием ХБП 5-й стадии начато лечение перитонеальным диализом. 23.06.06 была выполнена ТП от погибшего донора. Функция трансплантата первичная, к 6-м суткам послеоперационного периода отмечено снижение уровня креатинина до 0,07–0,10 ммоль/л. Иммуносупрессивная терапия включила ЦсА, микофенолата мофетил, преднизолон в стартовой дозе 30 мг/сут с последующим постепенным снижением дозы, индукционное введение базиликсимаба – препарата анти-CD25 моноклональных антител.
Кризов отторжения трансплантата не наблюдалось, однако пациентка перенесла два эпизода опоясывающего герпеса, по поводу которого проведено лечение ацикловиром внутривенно, валацикловиром внутрь. Дважды развивался пиелонефрит трансплантата. В остальном посттрансплантационный период протекал без особенностей.
У больной был отягощенный акушерско-гинекологический анамнез. В 2000 г. диагностирована дисфункция яичников. Три беременности (еще до начала лечения перитонеальным диализом) имели неблагоприятный исход: первая (2001) была прервана по медицинским показаниям при сроке 20 недель в связи с нарастанием уровня креатинина сыворотки, вторая (2002) – закончилась самопроизвольным выкидышем в 12 недель, третья (2004) – преждевременными родами на дому в 24 недели (ребенок умер). К моменту ТП детей у пациентки не было.
В октябре 2009 г. (через 3,5 года после ТП) по согласованию с нефрологом Центра трансплантации пациентка начала обследование у акушера-гинеколога МОНИИАГ с целью планирования беременности. Больной был отменен микофенолата мофетил, противопоказанный при беременности, продолжена двухкомпонентная иммуносупрессия ЦсА и преднизолоном. Уровень креатинина сыворотки оставался стабильным – 0,13–0,15 ммоль/л, количество белка в моче не превышало 0,1–0,2 г/л.
С целью подготовки к беременности пациентка начала получать дипиридамол, гепарин, дидрогестерон.
В начале июля 2010 г. наступила беременность (четвертая по счету). В течение беременности функция ПАТ была стабильной, уровень креатинина сыворотки колебался от 0,096 до 0,15 ммоль/л, суточная протеинурия составила 0,3–0,4 г, уровень АД – 120/80–140/90 мм рт.ст. на фоне приема амлодипина и атенолола. Гемоглобин колебался в пределах 129–84 г/л. Общая прибавка веса во время беременности составила 15 кг.
Наблюдались следующие акушерские осложнения: в I и II триместрах – неоднократная угроза прерывания беременности при сроках 5–6 недель, 14–15, 17–18, 23–24 недель; в III триместре в 31–32 недели имелась угроза преждевременных родов, поэтому для коррекции истмико-цервикальной недостаточности установлен акушерский пессарий.
 Во втором триместре отмечена лейкоцитурия на фоне роста в моче E. сoli и расширения чашечно-лоханочной системы трансплантата до 2,5 см, что расценено как проявление пиелонефрита ПАТ. Проведено лечение амоксициллином/клавуланатом, затем назначен фосфомицин 1 раз в 10 дней повторно. Во время беременности пациентка получала следующую медикаментозную терапию: ЦсА в дозе от 250 до 350 мг/сут (под контролем концентрации препарата в крови), преднизолон 10 мг/сут, амлодипин и атенолол с целью коррекции АД, нефракционированный гепарин ингаляционно (затем надропарин подкожно) и дипиридамол 225 мг/сут внутрь для профилактики преэклампсии, препараты железа внутрь и внутривенно, фолиевая кислота, эритропоэз-стимулирующий препарат длительного действия метоксиполиэтиленгликоль эпоэтин бета, кальций-Д3, дидрогестерон до 20 недель беременности, гексопренолин в третьем триместре беременности в связи с угрозой преждевременных родов (при назначении гексопренолина β-адреноблокатор атенолол был отменен), антибиотики при пиелонефрите трансплантата, фосфомицин.
Во втором триместре отмечена лейкоцитурия на фоне роста в моче E. сoli и расширения чашечно-лоханочной системы трансплантата до 2,5 см, что расценено как проявление пиелонефрита ПАТ. Проведено лечение амоксициллином/клавуланатом, затем назначен фосфомицин 1 раз в 10 дней повторно. Во время беременности пациентка получала следующую медикаментозную терапию: ЦсА в дозе от 250 до 350 мг/сут (под контролем концентрации препарата в крови), преднизолон 10 мг/сут, амлодипин и атенолол с целью коррекции АД, нефракционированный гепарин ингаляционно (затем надропарин подкожно) и дипиридамол 225 мг/сут внутрь для профилактики преэклампсии, препараты железа внутрь и внутривенно, фолиевая кислота, эритропоэз-стимулирующий препарат длительного действия метоксиполиэтиленгликоль эпоэтин бета, кальций-Д3, дидрогестерон до 20 недель беременности, гексопренолин в третьем триместре беременности в связи с угрозой преждевременных родов (при назначении гексопренолина β-адреноблокатор атенолол был отменен), антибиотики при пиелонефрите трансплантата, фосфомицин.
11.03.2011 при сроке беременности 37 недель произошло дородовое излитие околоплодных вод. Ведение родов осуществлено через естественные родовые пути на фоне спазмолитических, седативных препаратов, применялось медикаментозное обезболивание. Во время родов внутривенно капельно введено 500 мг метилпреднизолона. Через 9 часов родился живой доношенный мальчик, вес – 2820 г, рост – 51 см, оценка по шкале Апгар – 7–8 баллов. За первые сутки после родов пациентке введено еще 250 мг метилпреднизолона, в послеродовом периоде проведена антибактериальная терапия цефалоспоринами. С целью лечения анемии продолжено применение препаратов железа, перед выпиской из акушерского стационара введен подкожно метоксиполиэтиленгликоль эпоэтин бета в дозе 100 мкг. В послеродовом периоде – уровень креатинина сыворотки 0,13 ммоль/л, суточная протеинурия – 0,25 г.
В апреле 2012 г. наступила следующая беременность (пятая, с ПАТ – вторая). Данная беременность не планировалась, но пациентка категорически была настроена сохранить ее. С момента диагностики беременности (5 недель) пациентка начала получать дидрогестерон, низкомолекулярный гепарин подкожно, дипиридамол. Продолжена иммуносупрессия ЦсА и преднизолоном, коррекция АД амлодипином и метопрололом, назначены препараты железа, фолиевая кислота. Первые два триместра протекали благоприятно, хотя концентрация ЦсА в крови колебалась от 70 до 251 нг/мл, т.е. часто выходила за рамки «терапевтического окна». Несмотря на это, признаков отторжения трансплантата не наблюдалось, креатинин сыворотки оставался в пределах 0,1–0,14 ммоль/л, суточная протеинурия – 0,2–0,5 г/л, АД 130–135/85 мм рт.ст.
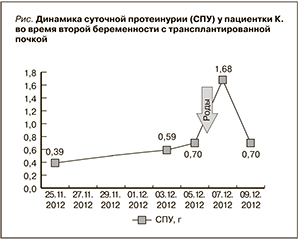
В 27–28 недель беременности на фоне продолжения антигипертензивной терапии отмечено повышение АД до 150/95 мм рт. ст., а также постепенное увеличение суточной протеинурии. Диагностировано присоединение ПЭ. В конце октября 2012 г. (при сроке 28 недель беременности) пациентка госпитализирована в МОНИИАГ, где проведена терапия гепарином, гексопреналином, ксантинолом никотинатом, магнезиальная терапия, лечение амоксициллином в связи с мочевой инфекцией. В конце ноября (при сроке беременности 32–33 недель) у пациентки, несмотря на проведенное лечение, появились необъяснимые кратковременные приступы одышки в покое. С 03.12.2012 наблюдались колебания АД, периодическая тошнота, хотя АД корригировалось медикаментозно и не достигало очень высоких значений (максимально – 155/95 мм рт. ст., чаще 130–140/85–90 мм рт.ст.). 06.12.2012 у беременной возникли головная боль, чувство тревоги, страха; пациентка неоднократно вызывала в палату лечащего врача в связи с «плохим самочувствием», хотя не могла точно описать свои ощущения. Данная симптоматика в сочетании с ростом протеинурии в динамике (см. рисунок) расценена как нарастание тяжести ПЭ, поэтому решено было провести родоразрешение.
07.12.2012 (при сроке беременности 34 недель) в 07.00 выполнена амниотомия, роды проведены через естественные родовые пути, методом обезболивания была регионарная анестезия. Во время родов пациентка получила 500 мг метилпреднизолона внутривенно капельно. 07.12.2012 в 14.55 родился живой недоношенный мальчик, масса – 2150 г, рост – 45 см, оценка по шкале Апгар – 7–8 баллов. С целью профилактики кровотечения внутривенно введен окситоцин. Через 10 минут самостоятельно отделилась плацента, выделился послед с дефектом размером 1 × 2 см. Под тотальной внутривенной анестезией проведено ручное обследование стенок послеродовой матки и удаление остатков плацентарной ткани.
В послеродовом периоде (на 2-е сутки) отмечено кратковременное повышение уровня креатинина до 0,2 ммоль/л, однако после проведения инфузионной терапии, введения метилпреднизолона к 10.12.2012 отмечено его снижение до 0,12 ммоль/л. После родов описанные выше приступы одышки, чувство страха, головная боль исчезли; протеинурия быстро снизилась до исходных значений.
В связи с выраженной анемией (Hb 72–77 г/л) проведено лечение препаратом железа для внутривенного введения – железа [III] гидроксид сахарозный комплекс, перед выпиской введен препарат эпаэтин бета в дозе 100 мкг. Даны рекомендации по дальнейшей иммуносупрессивной терапии (возобновление приема мофетила микофенолата, продолжение приема ЦсА и преднизолона), контрацепции.
Ребенок был переведен в детскую больницу на 2-й этап выхаживания, выписан через 10 дней. В возрасте 1 месяца на фоне вирусной инфекции в семье (болел старший сын) перенес тяжелую пневмонию, потребовавшую лечения в реанимационном отделении по месту жительства. В дальнейшем ребенок развивался нормально.
В ноябре 2013 г. у больной снова наступила незапланированная беременность, по желанию пациентки был произведен медицинский аборт. После аборта введен метилпреднизолон 250 мг однократно, проведена антибактериальная профилактика. Функция ПАТ не нарушилась, инфекционных осложнений не было.
В настоящее время старшему ребенку 3 года 6 месяцев, младшему – 1 год 9 месяцев. Физическое и психомоторное развитие детей соответствует возрасту. У пациентки К. сохраняется стабильная удовлетворительная функция ренального трансплантата.
Таким образом, у пациентки молодого возраста с ХБП, получавшей заместительную почечную терапию, в анамнезе были 3 неудачные беременности. Однако после успешной ТП следующие две беременности имели благоприятный исход – рождение живых детей без анатомических аномалий с последующим нормальным развитием, а также сохранение у матери удовлетворительной функции ПАТ. Первая беременность после ТП, несмотря на сопутствующие ей осложнения (неоднократная угроза досрочного прерывания, пиелонефрит ПАТ), не сопровождалась развитием ПЭ и завершилась на сроке 37 недель самостоятельными родами.
В то же время вторая беременность осложнилась достаточной ранней ПЭ, которая начала постепенно прогрессировать со срока 27–28 недель. Пролонгировать эту беременность до 34 недель удалось только в условиях высокоспециализированного акушерского стационара (МОНИИАГ) при активном участии в ведении беременной нефрологов и трансплантологов. Менее благоприятное течение второй беременности с трансплантированной почкой во многом объясняется, по нашему мнению, тем, что данная беременность, в отличие от первой, не планировалась с акушером-гинекологом и не сопровождалась медикаментозной подготовкой (гепарин, антиагреганты, гестагены) на предгравидарном этапе.
Особенностью нашего наблюдения является также стертое, растянутое во времени течение ПЭ у беременной с ПАТ, не сопровождающееся очень высокими значениями протеинурии (максимально – 1,68 г/сут) и АД. Такое течение связано, по-видимому, с проводимой с ранних сроков беременности профилактикой ПЭ гепарином и антиагрегантами, а также постоянной антигипертензивной и иммуносупрессивной терапией. Показано, что протеинурия при ПЭ связана с нарушением экспрессии белков щелевой диафрагмы подоцитов (нефрина, синаптоподина) за счет избытка антиангиогенных и относительно низкого уровня ангиогенных факторов [10].
В то же время известно, что ЦсА обладает антипротеинурическим эффектом, не зависимым от его иммуносупрессивного действия, обусловленным блокадой кальцинейрин-опосредованного дефосфорилирования синаптоподина и стабилизацией актинового цитоскелета подоцитов [11]. Кроме того, снижение протеинурии на фоне применения ЦсА обусловлено ингибированием активации нуклеарного фактора активированных T-клеток (NFAT), вызывающего подоцитарное повреждение и апоптоз подоцитов [12]. С другой стороны, следует помнить, что ингибиторы кальцинейрина (ЦсА и такролимус) у больных с мутациями генов системы комплемента могут способствовать развитию системной тромботической микроангиопатии (клинически проявляющейся гемолитико-уремическим синдромом – тромбоцитопенией, гемолитической анемией, повышением активности лактатдегидрогеназы, неврологическими симптомами, ухудшением почечной функции), а беременность в таких случаях может служить дополнительным триггером [13, 14]. Дифференциальная диагностика с тяжелой ПЭ в данной ситуации крайне сложна. К счастью, системная тромботическая микроангиопатия редко встречается среди беременных с трансплантированной почкой, а вот частота ПЭ, как было указано выше, достигает 27 %.
Можно предположить, что невысокие значения протеинурии и медленное нарастание этого показателя при развитии ПЭ у беременных с ПАТ обусловлены стабилизирующим воздействием на подоцит ЦсА, прием которого продолжается во время беременности. Именно поэтому у этих пациенток во второй половине беременности даже незначительное нарастание протеинурии в динамике, а также умеренное повышение АД при исходно хорошей медикаментозной коррекции артериальной гипертензии должно трактоваться в пользу диагноза ПЭ и начала соответствующего лечения. Сочетание таких симптомов с любой неврологической симптоматикой (конечно, при исключении чрезмерно высоких концентраций ЦсА или такролимуса в крови, обладающих нейротоксическим действием) и/или признаками страдания плода свидетельствует о тяжелой форме ПЭ и требует родоразрешения независимо от срока гестации.
По данным литературы, частота кесарева сечения у пациенток с ПАТ составляет 40–65 %, однако роды через естественные родовые пути для этой категории беременных более предпочтительны, поскольку при выполнении кесарева сечения в связи с топографическими особенностями брюшной полости и забрюшинного пространства после ТП повышен риск повреждения сосудов или мочеточника ренального трансплантата. Кесарево сечение необходимо выполнять лишь по строгим акушерским показаниям и в присутствии хирурга-трансплантолога. При ведении родов через естественные родовые пути следует избегать манипуляций, которые могут приводить к тупой травме трансплантированной почки (прием Кристеллера) [15, 16].
Поскольку акушерских показаний к выполнению кесарева сечения не было, у нашей пациентки и первые, и вторые роды были успешно проведены через естественные родовые пути, что подтверждает возможность физиологических родов у женщин с трансплантированной почкой.
В заключение можно отметить, что, несмотря на повышенную частоту осложнений, вероятность благоприятного исхода беременности, в т.ч. повторной, у женщин с хорошо функционирующим ренальным трансплантатом достаточно высока. При ведении таких пациенток особенно следует подчеркнуть необходимость эффективного междисциплинарного взаимодействия врачей-акушеров-гинекологов, нефрологов и трансплантологов. Крайне важным остаются планирование беременности и предгравидарная подготовка, а затем тщательное мониторирование клинических и лабораторных показателей состояния беременной, профилактика возможных осложнений.



