Введение
Терминальная стадия болезней почек (ТСПН) представляет собой хроническое, угрожающее жизни заболевание, при котором способность почек выполнять свои обычные функции со временем снижается. Пациенты с ТСПН получают заместительную почечную терапию (ЗПТ) в виде диализа в течение всей жизни или до момента проведения трансплантации почки (ТП). Можно выделить три метода ЗПТ: гемодиализ (ГД), перитонеальный диализ (ПД) и трансплантацию почки (ТП).
Диализ позволяет элиминировать из крови продукты обмена и избыток жидкости. Диализ проводят в том случае, когда почки больше не могут выполнять данные функции. Трансплантация почки — это хирургическая операция, при которой почка реципиента заменяется здоровой, полученной от живого или умершего донора. Ввиду ограниченной доступности операций по трансплантации и отсутствием подходящего донорского органа пациенты вынуждены ждать пересадки почки часто в течении длительного периода –многих месяцев или лет. В течение периода ожидания пересадки единственной жизнесберегающей технологией становится диализ.
При ГД выведение продуктов обмена и избытка жидкости осуществляется путем экстракорпоральной (вне организма) циркуляции крови через внешний фильтр (диализатор). В Российской Федерации (РФ) ГД обычно выполняется в условиях дневного стационара (ДС) или амбулаторно в диализном центре в отличие от зарубежной практики, где ГД может выполняться и в домашних условиях. Стандартный ГД обычно проводится три раза в неделю, причем каждая процедура длится от 3 до 5 часов.
При ПД элиминация отходов и избытка жидкости происходит внутри организма в брюшном (или перитонеальном) пространстве. Раствор для диализа вводится через постоянный катетер, установленный в брюшной полости, что позволяет элиминируемым продуктам перемещаться из крови в раствор. По истечении определенного времени выдержки раствор выводится из организма. В отличие от ГД ПД, как правило, представляет собой ежедневную терапию, которая длится в течение нескольких часов.
Трансплантация почки – это хирургическая операция, заключающаяся в пересадке здорового органа от одного человека-донора, другому человеку-реципиенту, который нуждается в трансплантации почки ввиду нарушения ее функции. Почка трансплантат, как правило, работает за обе почки, которые утратили свою функцию. Трансплантация почки для больных означает возвращение к прежней жизни, избавление от необходимости посещения диализного центра, освобождение от ограничений, связанных со временем и питанием, возможность работать и свободно перемещаться. В последние годы социальная значимость трансплантации почек во всем мире существенно возросла. Помимо низких показателей, определяющих качество жизни, пациенты на заместительной диализной терапии имеют значительно меньшую прогнозируемую продолжительность жизни. Так, пациенты, получающие гемодиализ в возрасте 40–59 лет, живут в среднем на 11 лет меньше по сравнению с теми, кому выполнена трансплантация. Для больных, находящихся в возрастной группе 20–39 лет эта разница составляет уже 17 лет. Прогрессирующий дефицит донорских органов привел к тому, что с целью увеличения количества проводимых операций в последнее время повсеместно наблюдается тенденция к развитию прижизненного донорства [1].
Цель данного исследования – оценка сравнительной клинико-экономической приемлемости ТП и диализа с позиции московской системы здравоохранения.
Материалы и методы
Популяция
В качестве изучаемой популяции были выбраны пациенты, проживавшие в Москва, старше 18 лет с ТСПН, которым была впервые назначена ЗПТ. При этом пациентам в данной популяции может быть как показана, так и не показана трансплантация почки. Численность моделируемой когорты была принята равной 1000 человек.
Изучаемые сценарии
В ходе клинико-экономического исследования изучались различия в расходах и эффекте двух стратегий обеспечения ЗПТ указанных пациентов. Первая стратегия отражает текущую практику терапии таких пациентов (стратегия А): пациенты на гемодиализе могут получить почечный трансплантат с вероятностью до 6,67% в год, и при этом трансплантация почки проводится только пациентам, которые стоят в листе ожидания (16,04% от общего числа пациентов). Во второй стратегии (стратегия Б) трансплантация почки проводится в 2 раза чаще: вероятность пересадки почки – 13,34% в год, и трансплантация может быть проведена всем пациентам – потенциальным реципиентам почки (23,79% от общего числа пациентов). В остальном стратегии терапии данных пациентов не различались.
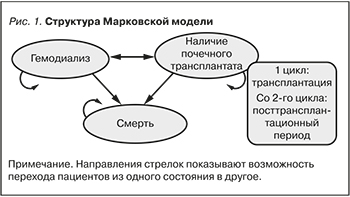 Структура модели
Структура модели
Для моделирования затрат и исходов была разработана модель Маркова. Она включала три состояния: гемодиализ, наличие почечного трансплантата и смерть. Смерть является абсорбирующим состоянием (при переходе в данное состояние пациенты остаются в нем до окончания моделирования). Состояние «наличие почечного трансплантата» разделено на два: в первый цикл своего пребывания в данном состоянии пациентам проводится ТП, а все последующие циклы пациенты находятся в посттрансплантационном периоде. Графически модель представлена на рис. 1.
Длительность одного цикла составила месяц. В базовом сценарии горизонт моделирования составил 10 лет. Также был проведен анализ сценариев для горизонтов моделирования 5, 15, 20 лет. В связи с относительно короткой длиной цикла поправка на непрерывность (середины цикла) не применялась. Моделирование проводилось с помощью программного обеспечения MS Excel.
Вероятности переходов
В модели были использованы следующие вероятности перехода: гемодиализ– наличие почечного трансплантата, наличие почечного трансплантата–гемодиализ, гемодиализ–смерть», наличие почечного трансплантата–смерть, а также вероятности остаться в текущем состоянии. Данные вероятности не были статическими и менялись в зависимости от различных условий модели.
Гемодиализ–наличие почечного трансплантата. Данная вероятность отражает возможность пациента на гемодиализе получить почечный трансплантат в текущем цикле. Для стратегии А она составила 0,57% в месяц (цикл) и 1,19%1 для стратегии Б. При этом после того цикла, в котором общее число пациентов, получавших почечный трансплантат, достигало максимального для выбранной стратегии (160 человек для стратегии А и 238 для стратегии Б), данная вероятность становилась равной нулю (всем больным с соответствующими показаниями проводилась трансплантация).
Наличие почечного трансплантата–гемодиализ. Данная вероятность отражает возможность отторжение трансплантата (пересаженной почки) у конкретного пациента в текущем цикле. Вероятность принята равной для обеих стратегий и составила 2% в год, или 0,17% в месяц (цикл). Она оставалась неизменной на протяжении всего периода моделирования.
Гемодиализ–смерть и Наличие почечного трансплантата–смерть. Данные вероятности отражают возможность пациента умереть в текущем цикле. Они постоянно меняются в зависимости от времени в модели.
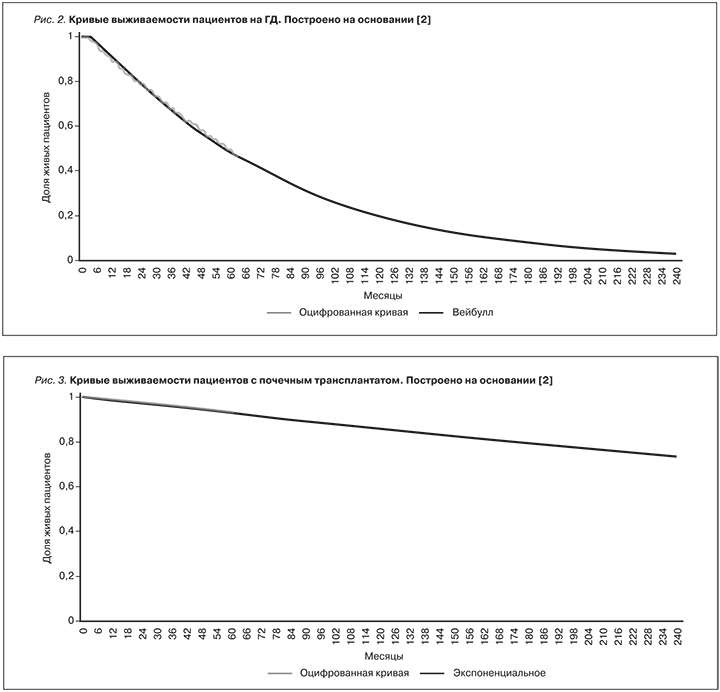
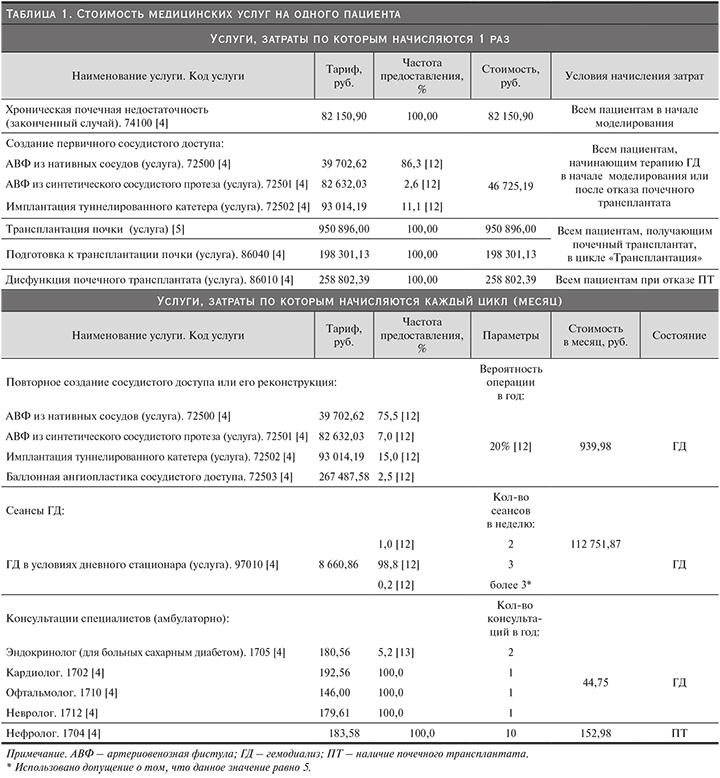
Вероятности переходов получены с помощью оцифрованных кривых выживаемости пациентов на гемодиализе и после пересадки почки, представленных в публикации на основании европейского регистра пациентов, получающих ЗПТ [2]. В данной публикации представлена кривая выживаемости на гемодиализе с 91-го дня после начала терапии, таким образом первые 3 месяца в модели выживаемость пациентов на ГД считалась равной 100% (указанная вероятность равнялась нулю).
Усредненные демографические характеристики, для которых представлены кривые [2]:
- Гемодиализ: возраст на начало терапии – 67 лет, доля мужчин – 63%.
- Почечный трансплантат: возраст на начало терапии – 50 лет, доля мужчин – 63%.
Кроме того, указанные кривые выживаемости были представлены для пятилетнего периода (60 месяцев), поэтому с целью экстраполяции данных на срок до 20 лет (240 месяцев) на основании оцифрованных кривых были построены параметрические модели выживаемости для различных видов распределений. Оценка параметров распределений, а также значения информационных критериев Акаике (англ.: Akaike information criterion, AIC) были определены с помощью программного обеспечения R. Для пациентов на ГД модель с использованием распределения Вейбулла (англ.: Weibull) наиболее точно описывала оригинальную кривую (имела наименьшее значение AIC) и была выбрана для дальнейшего использования; для пациентов с почечным трансплантатом использовано экспоненциальное распределение (моделируемые кривые и оригинальные данные представлены на рис. 2 и 3).
Вероятности остаться в текущем состоянии. Данные вероятности были вычислены на основании свойств полноты и взаимоисключаемости состояний Маркова, т.е. как отношение количества тех, кто не перешел из данного состояния в другие в текущем цикле к количеству пациентов в данном состоянии на начало цикла.
Исходы
Основным исходом исследования было принято количество лет жизни с поправкой на качество (англ.: quality-adjusted life years, QALY). Для определения полезности различных режимов ЗПТ был проведен систематический поиск литературы, в ходе которого был обнаружен мета-анализ Y.S. Liem et al., 2008 [3], где приведена оценка полезности ЗПТ на основании опросника EQ-5D: для ГД она составила 0,56, для ТП – 0,81 [3]. Было сделано допущение, согласно которому полезности в цикле трансплантации и пост-трансплантационном периоде не различаются и также равняются 0,81. Для расчета QALY при использовании той или иной стратегии использована сумма лет жизни пациентов на ГД и с ПТ, взвешенных на соответствующую полезность. Таким образом в качестве исходов приведены количество лет жизни пациента, а также QALY, накопленные пациентом с момента назначения ЗПТ при стратегиях А и Б. Исходы были дисконтированы по ставке 5% годовых.
Затраты
Среди затрат, учтенных в модели, присутствуют как прямые медицинские, так и прямые немедицинские затраты. Среди прямых медицинских затрат присутствуют таковые на оказание медицинских услуг (стоимость услуг извлечена из Тарифного соглашения на оплату медицинской помощи, оказываемой по Территориальной программе обязательного медицинского страхования Москвы на 2020 г. (ред. от 27.07.2020) с приложениями [4] и Программы государственных гарантий бесплатного оказания гражданам медицинской помощи на 2020 г. и на плановый период 2021 и 2022 гг.) [5] (табл. 1), а также затраты на лекарственную терапию (стоимость лекарственных препаратов рассчитана как медиана предельных зарегистрированных цен указанного МНН [6] в пересчете на единицу действующего вещества с учетом 10% НДС и 10% оптовой надбавки [7]). Для пациентов на ГД учтены затраты для предотвращения анемии – состояния, широко распространенное среди пациентов с ТСПН [8] и затраты на профилактику и лечение вторичного гиперпаратиреоза (ВГТП)[9]. Так, 67% пациентов на программном ГД получают лекарственную терапию против ВГТП [10]. Для пациентов с трансплантатом почки учтены затраты на иммуносупрессивную лекарственную терапию и кортикостероиды (начисляются каждый цикл модели), а также затраты на профилактику и терапию постоперационных наиболее часто встречающихся инфекционных осложнений (начисляются в цикл «Трансплантация»). Затраты на лекарственную терапию приведены в табл. 2. В качестве прямых немедицинских затрат учтена стоимость транспортировки пациентов на сеансы ГД. Стоимость транспортировки пациента на 1 сеанс ГД составила 2860,12 руб., что составляет 37 234, 58 руб. в месяц. Затраты были также дисконтированы по ставке 5% годовых. Дополнительно была проанализирована динамика и структура затрат на терапию пациентов.

Анализ сценариев
Для проверки надежности результатов исследования в дополнение к базовому сценарию было изучено еще несколько возможных сценариев:
- исходы и затраты не дисконтировались;
- использовалась индексация стоимости медицинских услуг и лекарственных препаратов на уровне 4% в год (прогнозируемый уровень инфляции в 2020 г.) [11];
- снижение частоты пересадки почки в стратегии Б до уровня стратегии А (6,67 %) при сохранении общего количества пересадок (23,79% от всех пациентов);
- проведен учет только прямых медицинских затрат (не учтены затраты на транспортировку пациентов).
Результаты
Численность моделируемой когорты составила 1000 человек, однако для удобства результаты по затратам и исходам модели для 4 периодов моделирования приведены в отношении одного усредненного пациента (табл. 3). Кроме того, в таблице приведено количество выживших пациентов на конец изучаемого периода (для когорты в 1000 пациентов).
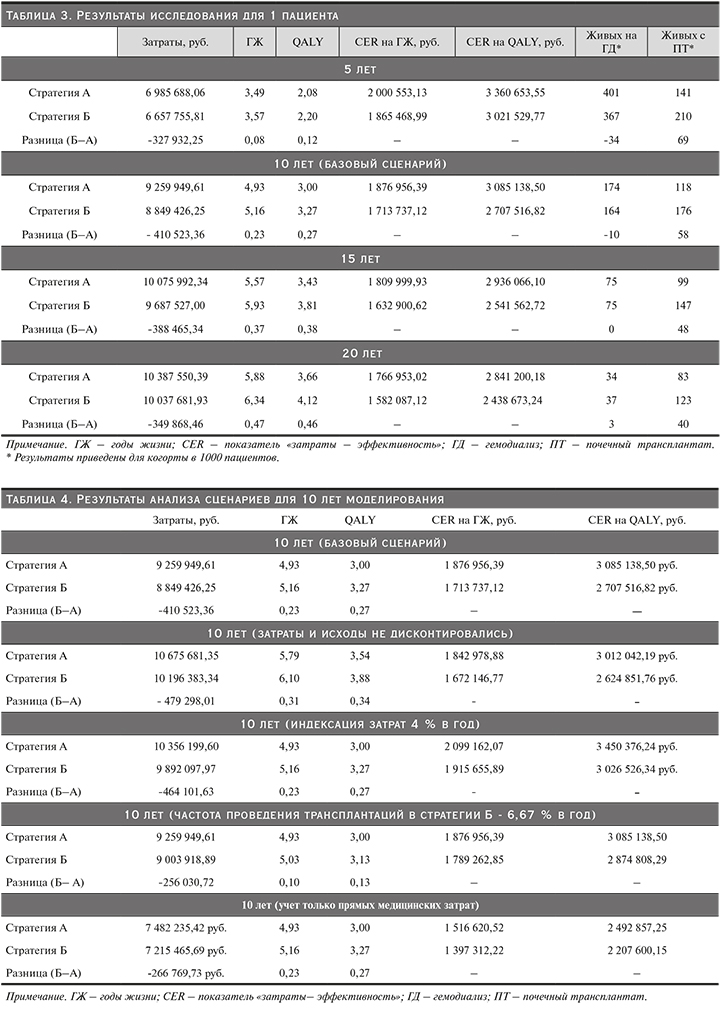
Из табл. 3 видно, что стратегия Б доминирующая для всех приведенных периодов: при ее использовании наблюдаются меньшие затраты, а также большая эффективность по исследуемым исходам. Так, в десятилетней перспективе стратегия Б показывает экономию 410 523 руб. (4,4%) на 1 пациента, а также повышает продолжительность жизни на 0,23 года (4,7%) и качество жизни пациентов на 0,27 QALY (9%). Также рассчитан показатель «затраты–эффективность» для каждой стратегии. В целом он варьируется в районе 2 млн руб. за 1 год жизни и 3 млн за один QALY с постепенным уменьшением с течением времени. При этом для всех периодов стратегия Б показывает меньшие затраты на единицу эффективности (год жизни или QALY).
В таблице видно, что различия в затратах имеют неоднозначный тренд (сначала увеличиваются, а затем уменьшаются). Динамика затрат на пациента для двух стратегий представлена на рис. 4.
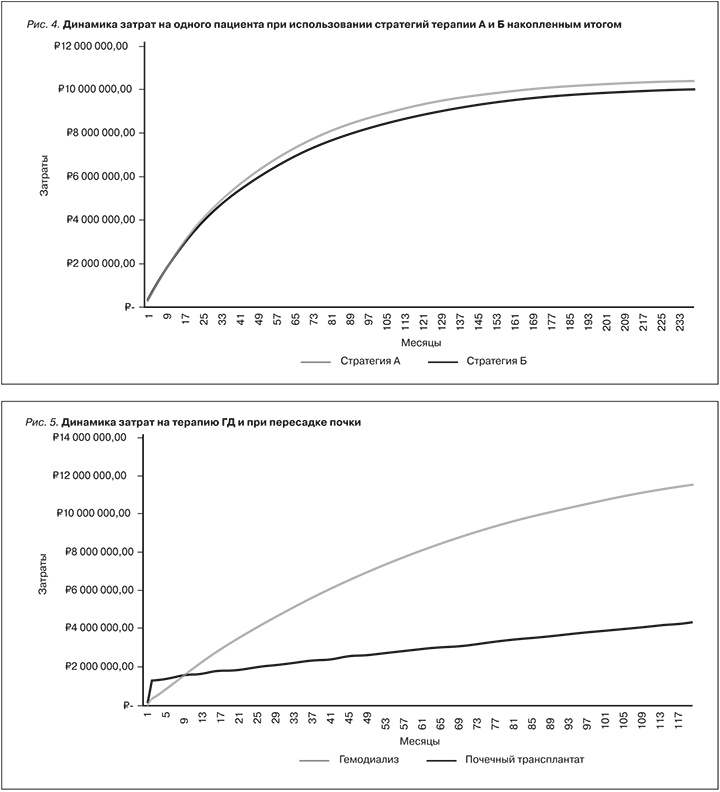
Так, до 16-го месяца модели стратегия Б более затратная, а после и до окончания моделирования – менее затратная. Если рассматривать разницу в затратах по каждому циклу, то до 8-го месяца стратегия Б более затратная, чем А, однако с 8-го по 124-й месяц ежемесячные затраты в стратегии Б меньше. Описанные тенденции связаны с несколькими факторами.
Во-первых, затраты на различные типы ЗПТ распределены неравномерно во времени, а именно в первый год после ТП расходы на одного пациента оцениваются в 1 685 531 руб., 1 363 031 руб. (81 %) из которых – расходы на госпитализацию по причине ХПН, подготовку к трансплантации и саму операцию, а также терапию постоперационных инфекционных осложнений. В последующие годы (без учета возможности отторжения почечного трансплантата и смертности) расходы оцениваются в 322 500 руб. в год и включают расходы на консультации специалистов и сопутствующую лекарственную терапию. Для пациента, начинающего терапию ГД, расходы в первый год составят 2 295 425 руб., 128 876 руб. (5,6 %) из которых связаны с началом терапии ГД (расходы на госпитализацию по поводу ХПН, создание первичного сосудистого доступа), а в последующие годы (без учета возможности пересадки почки и смертности) расходы оценены в 2 166 549 руб. в год (динамика затрат на 1 пациента при использовании изучаемых типов ЗПТ с учетом выживаемости пациентов представлена на рис. 5). При этом отличиями между двумя стратегиями являлись скорость проведения трансплантации в когорте, а также максимальное число пациентов, которым будет проведена ТП. Таким образом, при использовании стратегии А 161 пациент к концу третьего года моделирования (на 36-й месяц) получает трансплантат почки, а при использовании стратегии Б 243 пациента – на 26-й месяц модели. Так как пациенты в стратегии Б быстрее получают ПТ и их количество больше, расходы на эту стратегию преобладают в начальных циклах модели, однако в дальнейшем начинает проявляться экономия за счет трансплантации (со второго года ведение пациента с трансплантатом на 85,1% дешевле, чем ведение пациента на ГД).
Во-вторых, выживаемость пациентов на ГД значительно ниже, чем у пациентов с трансплантатом почки, как следствие – смертность при использовании стратегии А выше. Поэтому в поздних циклах модели число пациентов на ГД в разных стратегиях начинает сходиться, а число пациентов с трансплантатом в стратегии Б стабильно выше, таким образом затраты стратегии А в каждом цикле становятся меньше, чем в стратегии Б, что обусловливает сокращение разницы в затратах.
Также стоит отметить, что небольшая разница (в процентном соотношении) между стратегиями в затратах и исходах объясняется тем, что в стратегии Б трансплантат получили на 7,75 % пациентов общей популяции больше, чем в стратегии А.
Анализ сценариев
Оценки затрат и исходов по двум стратегиям в различных сценариях приведены в табл. 4. В целом результаты исследования остаются устойчивыми при изменении предложенных параметров. Стратегия Б остается доминирующей при всех сценариях. При этом стоит отметить, что результаты сценария, в котором частота ТП в стратегии Б составляет 6,67% в год, показывают, что задержка пересадки почки увеличивает стоимость терапии, а также уменьшает продолжительность жизни пациента и ухудшает ее качество.
Обсуждение и заключение
К значительным ограничениям исследования можно отнести отсутствие полных данных по долгосрочной выживаемости пациентов на ЗПТ в Москве. Вследствие этого использовались доступные данные по европейским странам. Различия в базовых характеристиках пациентов, а также принятой практике их ведения между европейскими странами и Москвой могли значительно влиять на вид кривых выживаемости и как следствие – на вероятности переходов в модели, что в свою очередь могло изменить оценки как затрат, так и эффективности стратегий. Другим ограничением стала необходимость экстраполяции данных по выживаемости во времени. Параметрические модели не способны предсказывать тех трендов, которых не было в наблюдаемых данных (чем на более длительный промежуток происходит экстраполяция данных, тем менее надежными получаются результаты). Так, маловероятно, что кривая выживаемости пациентов с ПТ не изменяла своего наклона в течение 20 лет моделирования. Кроме того, в данном исследовании анализ проведен для одной обобщенной популяции без учета наличия сопутствующих заболеваний.
Настоящее исследование направлено на повышение объективности принимаемых решений в отношении оказания медицинской помощи пациентам с ХПН и финансирования ЗПТ. Повышение частоты проведения операций по ТП в долгосрочной перспективе с высокой долей вероятности приведет к повышению продолжительности и качества жизни пациентов с ХПН, а также снизит финансовую нагрузку на бюджет здравоохранения.



