Введение
Причины высокой частоты кардиоваскулярной заболеваемости и летальности среди пациентов с хронической болезнью почек (ХБП) обусловлены многими факторами. Важную роль придают нарушениям метаболизма углеводов и липидов, дисбалансу между оксидантами, антиоксидантами и иммуновоспалительной системой. В частности, наивысший риск смерти имеют больные, получающие лечение программным диализом [1, 2]. Относительно недавно было установлено, что конечные продукты гликирования (КПГ) могут быть причастными к повреждению сосудистой стенки [3]. КПГ образуются и накапливаются в ответ на карбонильный и окислительный стресс, на снижение почечной экскреции КПГ [4, 5]. Показано, что окислительный стресс существенно возрастает не только у диализных пациентов, но даже на ранних стадиях ХБП [6]. Уремические токсины и диализные процедуры приводят к усилению окислительного стресса и повышению образования КПГ [7, 8]. КПГ накапливаются главным образом во внеклеточном матриксе, изменяя функциональные свойства структурных молекул, таких как коллаген, приводя в свою очередь к повреждению сердца и сосудов [9]. КПГ вносят вклад в развитие эндотелиальной дисфункции в результате накопления в сосудистой стенке окисленных липопротеидов низкой плотности (ЛПНП), уменьшения концентрации оксида азота, усиления окислительного стресса и стимуляции миграции макрофагов [10]. Взаимодействие между КПГ и их рецепторами (РКПГ) индуцирует синтез провоспалительных цитокинов, вызывающих сосудистые повреждения. РКПГ экспрессированы на многих клетках, но именно эндотелиальные РКПГ служат ключевым фактором развития эндотелиальной дисфункции [11, 12]. Следует подчеркнуть, что плазменные уровни КПГ не коррелируют с интенсивностью их накопления в тканях и, в отличие от тканевых КПГ, не являются предикторами поражения сердца и сосудов, развития диастолической дисфункции [13, 14]. КПГ образуются в живом организме в результате реакции Майларда (Maillard reaction) между аминокислотой и сахаром. В нормальных условиях скорость реакции мала и ее продукты в основном успевают удаляться из организма. Определенное накопление КПГ в организме происходит в течение всей жизни и коррелирует с биологическим возрастом человека. Однако при различных патологических состояниях, например, у больных, страдающих сахарным диабетом, или при нарушении экскреторной способности почек КПГ накапливаются более интенсивно, что способно вызывать дальнейшие многочисленные повреждения [15–17]. Согласно современным представлениям, КПГ могут образовываться также при взаимодействии реактивных карбонильных групп и продуктов пероксидации липидов с аминокислотами (оксидативный и карбонильный стресс). До недавнего времени биопсия кожи была единственным способом оценки уровня накопления КПГ в тканях, что сдерживало проведение широких исследований, поскольку этот способ инвазивен и требует значительных затрат времени и средств, что затрудняет их выполнение в ежедневной практике. За последние годы появился новый метод, основанный на использовании свойства аутофлуоресценции (АФ) биологической ткани [18]. Этот метод позволяет проводить измерения быстро и неинвазивным способом. На связь между АФ и КПГ впервые обратили внимание офтальмологи. При проведении исследований методом флуоресцентной ангиографии они обнаружили повышенную собственную флуоресценцию у больных диабетом, что, как выяснилось, обусловлено накоплением КПГ в хрусталике. В дальнейших исследованиях было показано, что для изучения накопления КПГ может использоваться и кожный покров, что намного удобнее для проведения измерений. Принцип оценки АФ кожи состоит в следующем. Возбуждающий свет от источника ультрафиолетового излучения попадает на поверхность кожи, часть его отражается в виде рассеянного излучения, а часть, расположенная в синей области спектра, излучается в виде АФ. Чем больше КПГ в коже, тем выше регистрируемая интенсивность АФ. Данный метод измерения КПГ кожи положен в основу функционирования коммерчески доступного прибора «AGE-Reader», который в настоящее время выпускается голландской фирмой «DiagnOptics» [http://www.diagnoptics.com/]. Измерение на этом приборе проводят на участках кожи площадью около 0,5 см2 в области предплечья. Поскольку результаты зависят от выбранного места измерения, для повышения повторяемости данных проводится несколько циклов регистрации с изменением положения руки. При этом общее время измерений составляет около трех минут. В проведенных сопоставлениях результатов измерений АФ кожи, полученных на приборе «AGE-Reader», с биохимическими показателями биоптатов кожи была установлена прямая корреляция между АФ и содержанием КПГ в очищенном коллагене [19]. Необходимо учитывать, что нефлуоресцирующие компоненты КПГ не могут быть измерены этим прибором, в то время как флуоресценция других компонентов ткани, расположенных в том же диапазоне длины волны (например, NADH), способна оказывать дестабилизирующее влияние на результат. К нефлуоресцирующим компонентам КПГ относятся гидроимидазолоны, Nε-карбоксиметил-лизин (carboxymethyl-lysine – CML) и Nε-карбоксиэтил-лизин (carboxyethyl-lysine – CEL) – важные составляющие КПГ.
В Первом Санкт-Петербургском государственном медицинском университете им. акад. И.П. Павлова (ПСПбГМУ) при поддержке Российского научного центра в Сеуле разработан прибор «Skin-AGE» [20]. Принцип его действия, так же как и прибора «AGE-Reader», основан на измерении спектров АФ кожи при ультрафиолетовом возбуждении, Основное отличие его от «AGE-Reader» в следующем: измерения выполняются с помощью волоконного зонда, который приводится в прямой контакт с участком кожи. Это позволяет выбирать для измерений любую область кожного покрова и проводить их у пациентов в положении лежа. Кроме того, усиливается регистрируемый сигнал и появляется возможность усреднения показаний на значительных по площади участках кожи за счет ручного перемещения зонда, что позволяет уменьшать зависимость от локальной неоднородности кожи и повышать стабильность показаний. В качестве источника возбуждающего излучения используется маломощный светодиод длиной волны 365 нм, что позволило создать компактную переносную конструкцию весом около 1,5 кг. Прибор функционирует под управлением персонального компьютера, подключенного к нему через порт USB. Форма спектра вторичного излучения кожи, полученного с помощью прибора «Skin-AGE» содержит две области. Область короче 400 нм формируется за счет отражения части возбуждающего излучения светодиода от кожи, а область длиннее 400 нм – за счет ее АФ, обусловленной различными эндогенными веществами (коллаген, NADH, FAD, кератин, порфирины), на которые оказывают влияние пигменты, прежде всего гемоглобин и меланин.

Цель данного исследования состояла в оценке диагностических возможностей использования прибора «Skin-AGE» пациентами с различной патологией почек.
Материал и методы
Контингент обследованных лиц состоял из трех групп: первая (контроль) – практически здоровые люди (47 человек; женщины/мужчины: 32/15, возраст: 16–78 лет), вторая – реципиенты почечного трансплантата (РПТ; 24 человека; Ж/М: 3/11, возраст: 15–62 года), третья – больные терминальной почечной недостаточностью (ТПН), находящиеся на постоянном гемодиализе (79 человек; Ж/M: 35/44, возраст: 22–82 года). Исследования проведены на приборе «Skin-AGE» [6]. Максимум флуоресцентной эмиссии КПГ находится на длине волны 440 нм [7]. Поэтому на такой длине волны производилось измерение сигнала флуоресценции F. На длине волны 380 нм измерялся сигнал R, пропорциональный коэффициенту диффузного отражения возбуждающего излучения от кожи. Этот сигнал использовался в данной системе в качестве референтного сигнала при расчете параметра АФ по формуле AF=F/Rk , где k – показатель степени, учитывающий различное влияние пигментации кожи на изменение флуоресцентного и отраженного сигналов. Для оценки влияния неоднородных свойств кожи на результаты измерений проведено исследование поведения сигналов в процессе сканирования небольшого участка в области предплечья. Из-за локальной неоднородности кожи при перемещении зонда абсолютные сигналы F и R изменяются очень сильно – стандартное отклонение (SD) каждого из них достигает ±26%. В то же время отношение AF обладает существенно лучшей устойчивостью. SD локальных значений не превышает ±6%, а при использовании средних значений, полученных во время сканирования, этот показатель становится лучше ±2%. Для того чтобы добиться долговременной стабильности показаний перед каждым новым циклом измерения, проводили контроль и корректировку спектральных коэффициентов прибора с помощью флуоресцентного стандарта «USFS-200» (Labsphere Inc., USA). Такая калибровка обеспечивает также возможность сопоставления данных, полученных на различных экземплярах прибора.
Результаты
Предварительные исследования были направлены на выбор оптимальных условий измерений. Они проводились на различных участках кожи (подушечки пальцев, ладонь, запястье, плечо, предплечье, локтевой сгиб, колено, голень, лодыжка), а также при вариациях ряда параметров (площадь и время сканирования, давление на кожу, степень загара кожи и пр.). Эти измерения показали, что различные участки кожного покрова характеризуются статистически значимыми различиями средних величин. Более того, различия до 10% могут наблюдаться даже на идентичных участках, расположенных на правой и левой частях тела. Поэтому для получения сопоставимых результатов необходимо зафиксировать не только место, но и сторону измерения или пользоваться усредненными данными симметричных участков слева и справа. Кроме того, проверялась стабильность измерений при их проведении в течение длительного времени у одного и того же человека. При регулярных измерениях (по 7–10 раз в день в определенном месте кожи в течение 58 суток) были выявлены статистически значимые отклонения в течение дня, связанные с изменением физиологического состояния организма. Максимальные значения АФ наблюдались в середине рабочего дня после обеда, а также при кратковременной физической нагрузке. Причем было замечено, что в отдельные особо напряженные рабочие дни, сопровождавшиеся изменением привычного ритма жизни, показания увеличивались до 17% относительно среднего уровня. Минимальные значения регистрировались ранним утром по окончании сна и после приема душа. Причина таких изменений состоит в изменении уровня NADH в коже в течение дня. Этот уровень зависит от окислительно-восстановительного состояния ткани, и при недостатке кислорода АФ увеличивается. Полученные данные указывают на то, что в течение дня уровень насыщения кожи кислородом может существенно меняться, что приводит к смещению равновесной реакции NAD+ ↔ NADH в сторону либо восстановления, либо окисления. Физическая нагрузка, утомление способны сдвинуть состояние ткани в сторону восстановления и, наоборот, длительный отдых и водно-гигиенические процедуры, способствующие насыщению ткани кислородом, – в сторону окисления. Наибольшую стабильность показаний при кратковременных исследованиях давали измерения, проводимые на коже медиальной поверхности плеча и внутренней стороны предплечья вблизи локтевого сгиба. Наименьшую зависимость от степени инсоляции кожи обеспечивает показатель степени k=0,85. Многочисленные измерения усредненных значений в этих областях, проведенные в идентичных условиях при сканировании участков размером 1–3 см в течение примерно 1 секунды, показали сходимость результатов измерения AF около 1,6%. Эти условия измерений применялись при выполнении данных исследований.

Исследование группы контроля
В группе контроля проведено сравнение данных, полученных на приборе «Skin-AGE», с результатами аналогичных исследований, выполненных на приборе «AGE-Reader» (см. таблицу) [5]. Сравнение показывает, что с помощью обоих приборов получены идентичные возрастные тренды (1,1–1,2% в год). Однако корреляция с возрастом, полученная на приборе «AGE-Reader», оказалась более слабой (0,32) по сравнению с прибором «Skin-AGE» (0,74), что, по-видимому, вызвано более низкой повторяемостью измерений на приборе «AGE Reader». Последнее предположение подтвердилось выполненным нами прямым тестированием этого прибора: сходимость результатов измерений в режиме «Single Measure» составила 17%.
Исследование больных с почечной патологией
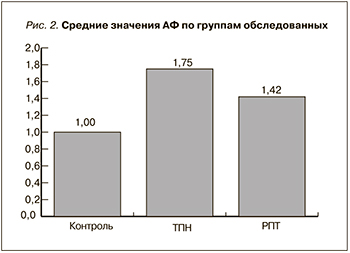
Как уже указывалось выше, пациенты с почечной патологией были распределены в две выборки: реципиенты почечного аллотрансплантата (вторая группа; n=24) и пациенты с ТПН, находящиеся на гемодиализе (n=79). В зависимости от возраста диаграммы рассеяния показателей АФ для этих больных с соответствующими линиями трендов представлены на рис. 1, средние значения – на рис. 2. Как видно из приведенных величин, корреляции с возрастом практически полностью отсутствуют при ТПН на гемодиализе (r=0,13; p>0,1) и меньше по сравнению с нормой при РПТ (r=0,45; p<0,05). Что касается средних значений АФ, то они в этих группах увеличились по сравнению с нормой соответственно в 1,75±0,16 и 1,42±0,16 раза (для справки: в группе больных сахарным диабетом возрастание АФ составило 1,24±0,11). У пациентов с ТПН отмечены значимые прямые корреляции между АФ с длительностью диализа (r=0,36; р<0,0005), уровнем гемоглобина в периферической крови (0,20; р<0,05) и кальций-фосфорным произведением (r=0,24; р<0,025). В группе РПТ имели место достоверная обратная зависимость между АФ и длительностью диализа до выполнения трансплантации донорской почки (r=-0,43; р<0,025) и прямые корреляции АФ с концентрацией общего холестерина (r=0,36; р<0,05) и холестерина ЛПНП (r=0,40; р<0,025).
Обсуждение
 КПГ, синтезируемые, как уже отмечалось выше, за счет реакции Майяра, вносят вклад в прогрессирование атеросклероза и сердечно-сосудистых заболеваний [2, 8–10]. Кроме того, гипергликемия и усиление оксидативного стресса, снижение скорости клубочковой фильтрации (СКФ) рассматриваются в качестве важнейших детерминантов, определяющих аккумуляцию КПГ [3, 11, 12]. Аккумуляция КПГ при ХБП может усугубляться за счет активации оксидативного и карбонильного стрессов, нарастающей по мере снижения функции почек. Накопление химически стабильных КПГ длительно живущих протеинов может служить мерой кумулятивного метаболического стресса, что способствует повреждениям клеток путем прямой модификации клеточных протеинов и изменения их функции или связывания со специфическим рецептором (RAGE), что индуцирует широкий спектр клеточных реакций, приводящих к повреждению [13]. Такой механизм предполагается в качестве основного звена патогенеза сосудистых повреждений при сахарном диабете, но, по-видимому, КПГ вносят вклад и в формирование повреждений почек недиабетической природы [1, 14]. Следовательно, КПГ могут рассматриваться в качестве потенциальных биомаркеров тяжести повреждения почек при ХБП.
КПГ, синтезируемые, как уже отмечалось выше, за счет реакции Майяра, вносят вклад в прогрессирование атеросклероза и сердечно-сосудистых заболеваний [2, 8–10]. Кроме того, гипергликемия и усиление оксидативного стресса, снижение скорости клубочковой фильтрации (СКФ) рассматриваются в качестве важнейших детерминантов, определяющих аккумуляцию КПГ [3, 11, 12]. Аккумуляция КПГ при ХБП может усугубляться за счет активации оксидативного и карбонильного стрессов, нарастающей по мере снижения функции почек. Накопление химически стабильных КПГ длительно живущих протеинов может служить мерой кумулятивного метаболического стресса, что способствует повреждениям клеток путем прямой модификации клеточных протеинов и изменения их функции или связывания со специфическим рецептором (RAGE), что индуцирует широкий спектр клеточных реакций, приводящих к повреждению [13]. Такой механизм предполагается в качестве основного звена патогенеза сосудистых повреждений при сахарном диабете, но, по-видимому, КПГ вносят вклад и в формирование повреждений почек недиабетической природы [1, 14]. Следовательно, КПГ могут рассматриваться в качестве потенциальных биомаркеров тяжести повреждения почек при ХБП.
Проведенные ранее исследования показали, что по мере снижения СКФ АФ нарастает [15–17]. K. Tanaka и соавт. [16] в своей когорте додиализных пациентов обнаружили, что расчетная СКФ служит одним из наиболее «сильных» предикторов АФ, причем АФ кожи нарастает по мере повышения стадии ХБП. В свою очередь N.J. McIntyre и соавт. [18] нашли, что АФ кожи при ХБП 3А оказалась значимо ниже, чем при ХБП 3Б. Наконец, K. Tanaka и соавт. [15] показали, что АФ – это независимый предиктор прогрессирования ХБП.
При ТПН отмечается существенный рост накопления КПГ в коже по сравнению со здоровыми [19] или пациентами без признаков уремии [17]. Однако измеряемый уровень АФ кожи может существенно зависеть от выраженности ее пигментации (африканцы и др. народы) [20]. При этом АФ кожи оказалась независимым предиктором летальности среди диализных пациентов [19, 21, 22].
Интересно, что уровень циркулирующих КПГ не был ассоциирован со смертностью пациентов, получающих программный гемодиализ [23, 24]. В то же время АФ кожи достоверно не снижался после сеанса диализа, тогда как уровень КПГ в плазме значимо уменьшался [25].
Толщина комплекса интима/медиа также проявляла тенденцию к прямой корреляции с интенсивностью АФ кожи у пациентов с ТПН [26]. Кроме того, накопление КПГ в коже, оцененное методом АФ, ассоциировалось с нарастанием кардиоваскулярной заболеваемости у пациентов на перитонеальном диализе [27].
Сведения, полученные уже более 10 лет назад, навели на мысль, согласно которой накопление КПГ может быть предиктором хронической дисфункции почечного аллотрансплантата [28]. Такие предположения не раз были подтверждены при оценке тканевых уровней КПГ методом кожной АФ [29–31]. Кроме того, у реципиентов почечного аллотрансплантата АФ кожи является одним из факторов кардиоваскулярного риска [29, 31].
В нашей работе сравнение данных, полученных на приборе «Skin-AGE», с результатами измерений у здоровых лиц, выполненных с помощью широко распространенного прибора «AGE-Reader» (DiagnOptics, Нидерланды), показало, что в обоих случаях имеют место идентичные возрастные тренды (1,1–1,2% в год). Однако корреляция с возрастом, полученная на приборе «AGE-Reader», оказалась более слабой (0,32; p<0,05) по сравнению с прибором «Skin-AGE» (0,74; p<0,001), что вызвано большим разбросом данных относительно линии тренда: 34,4 против 14%. Эти результаты сами по себе свидетельствуют: оценка накопления КПГ в тканях по уровню АФ кожи с помощью тестируемого прибора вполне приемлема. Мы, как и другие авторы, процитированные выше, как правило, использовавшие «AGE-Reader», обнаружили отчетливый рост величины АФ у пациентов с ТПН, получающих ГД-терапию (рис. 2). После трансплантации почки АФ кожи несколько уменьшалась, но не достигала значений «нормы» (рис. 2). Интересно также, что между возрастом и АФ кожи у здоровых лиц выявлена сильная прямая корреляция (r=0,74; p<0,001), исчезнувшая при ТПН. Это наводит на следующую мысль: в данной выборке больных в накоплении КПГ вклад возрастных изменений существенно меньше, чем почечной дисфункции. При этом диализ не обеспечивает должный клиренс КПГ. Последние, как уже отмечено выше, являются существенным фактором кардиоваскулярной заболеваемости и смертности, которая в диализной популяции чрезвычайно велика. Трансплантация почки, по-видимому, несколько снижает накопление тканевых КПГ, но не восстанавливает его полностью. При этом у РПТ вновь начинает проявляться связь АФ с возрастом (r=0,45; p<0,05; рис. 1Б).
У пациентов с ХБП обеих групп мы также обнаружили ряд значимых взаимосвязей АФ кожи с показателями, которые в одних случаях являются традиционными, в других – нетрадиционными факторами кардиоваскулярного риска (уровни общего холестерина и холестерина ЛПНП в сыворотке крови, гемоглобина в периферической крови, кальций-фосфорного произведения). Это может служить косвенным подтверждением того, что КПГ являются одним из важных патогенетических звеньев в развитии повреждений сердечно-сосудистой системы у пациентов с различными вариантами ХБП [16, 18–24, 26, 29].
Заключение
Таким образом, полученные данные свидетельствуют, что измерения тканевого накопления КПГ по уровню АФ с помощью прибора «Skin-AGE» могут найти применение в обследовании пациентов с ХБП. При этом нарастание АФ кожи, по-видимому, может рассматриваться в качестве предиктора развития кардиоваскулярных поражений у пациентов с ХБП. Возможно, с помощью данного метода можно было бы также оценить качество и адекватность диализного лечения, что требует дальнейшего изучения.



