Введение
Длительное время патофизиология, нейрофизиология, а тем более эндокринология ночного мочеиспускания в отечественной науке практически не изучались. В отечественной урологической литературе мочеиспускание ночью традиционно обозначалось двумя терминами: «никтурия» и «ноктурия», при этом в эти термины порой вкладывались совершенно разные понятия [1]. Так, о никтурии следовало говорить в тех случаях, когда пациент вставал мочиться ночью в связи с увеличением ночного диуреза, который традиционно связывался либо с сердечно-сосудистой недостаточностью, либо с ранней стадией хронической почечной недостаточности. Ноктурия же означала такое нарушение мочеиспускания, при котором пациент вынужден был вставать мочиться ночью из-за ирритативных симптомов, при этом однократный объем мочеиспускания был существенно меньше, чем при никтурии, что и служило главным дифференциально-диагностическим тестом для разграничения этих патологических состояний. Ночное мочеиспускание как ранее, так и часто сейчас ассоциируется в умах урологов прежде всего с доброкачественной гиперплазией предстательной железы (ДГПЖ). О ноктурии у женщин в учебниках по урологии практически не упоминается до сих пор. Таким образом, отсутствие на тот момент доказательных крупномасштабных исследований феномена ночного мочеиспускания отражалось и на взглядах урологов на эту проблему, о которой мало что тогда знали, а как лечить – не знали вовсе. Повышенный интерес к симптому ночных мочеиспусканий возник в конце 1990-х гг., когда появившиеся исследования (в т.ч. ставшие «классикой жанра» комплексное уродинамическое исследование [КУДИ] и суточный уродинамический мониторинг) показали клиническую неоднородность данной категории пациентов с точки зрения гендерной этиологии и патогенеза ночного мочеиспускания. Это привело к необходимости пересмотра и стандартизации терминов, ведь невозможно об одном и том же феномене разговаривать, используя разные термины и вкладывая в них совершенно разный смысл. Поэтому в 2002 г.
Комитетом Международного общества по удержанию мочи (ICS) для обозначения симптома ночного мочеиспускания был предложен единый термин – ноктурия, под которым, согласно принятому определению, следует понимать необходимость вставать ночью один и более раз с целью опорожнения мочевого пузыря [2]. Появление нового термина привнесло определенный дискомфорт в привычный терминологический стереотип мышления большинства российских врачей, многие из которых стали понимать под этими терминами совершенно разные патофизиологические состояния [3–6]. Однако все дело в том, что ноктурия и никтурия являются синонимами: noctu (латинское) – «ночь»; nyctos (греческое) – «ночь». По мнению Е.Л. Вишневского и соавт. (2007), в окончательном виде термин «ноктурия» правильнее было бы использовать для обозначения мочеиспусканий ночью, а термин «никтурия» – для обозначения повышенного мочеобразования в ночное время [6]. Но, согласно принятой большинством мировых сообществ терминологии, для обозначения аномально повышенного ночного диуреза лучше использовать термин «ночная полиурия», которая, по современным представлениям, является одним из патогенетических механизмов ночного мочеиспускания, т.е. собственно ноктурии. Таким образом, хотя в клинической практике для обозначения симптома ночного мочеиспускания до сих пор по инерции еще используются и термин «ноктурия», и термин «никтурия» как равноправные, однако с современной методологической точки зрения в оба термина следует вкладывать только один общий смысл – необходимость вставать мочиться ночью более одного раза, но предпочтительнее пользоваться термином «ноктурия» как наиболее правильным с точки зрения патофизиологии для удобства стандартизации исследований, диагностических и терапевтических процедур [6, 7]. Ноктурия – это необходимость вставать ночью один и более раз с целью опорожнения мочевого пузыря [8]. Это один из самых ранних и наиболее тягостных симптомов нижних мочевых путей (СНМП) как у мужчин, так и у женщин. Даже однократная ноктурия является патологическим состоянием, требует комплексной диагностики и максимально ранней патогенетической коррекции, т.к. достоверно ассоциирована с высоким риском возрастной коморбидности и снижением общей выживаемости пожилых людей [9–15].
Сегодня уже накоплена достаточная доказательная база научных данных для утверждения, согласно которому ноктурия является неспецифическим маркером инволюционных и метаболических нарушений в мочевой системе, связанных с биологическим старением. Поэтому она одинаково часто наблюдается, прогрессирует у обоих полов в прямой связи с возрастом и имеет гораздо большее диагностическое и прогностическое значение, чем то, которое ей придается большинством врачей даже сегодня [16–20]. Здоровый человек не должен прерывать ночной сон из-за потребности вставать мочиться. Появление ноктурии свидетельствует о нарушении гормонально-метаболической регуляции мочевой системы, прежде всего о нарушениях энергетического обеспечения и метаболизма органов мочевой системы (митохондриальная дисфункция) [6]. Согласно элевационной теории старения В.М. Дильмана (1983), именно возрастное снижение уровня гормонов (прежде всего половых стероидов) ведет к накоплению свободных радикалов и усилению клеточного апоптоза, что неизбежно сопровождается появлением атрибутов старения [21]. Одним из таких атрибутов старения служат анатомо-функциональные нарушения в мочевой системе, которые клинически проявляются ноктурией прежде и раньше всего.
Современный патогенез ноктурии. Ноктурия – междисциплинарная проблема клинической медицины с мультифакторным патогенезом. Ноктурия развивается, когда ночной объем мочи (т.е. общий объем мочи, выделяемой ночью, в т.ч. при первом утреннем мочеиспускании) превышает максимальный объем мочеиспускания, зависящий от функциональной способности (емкости) мочевого пузыря, которая может отличаться в ночное время по сравнению с дневными параметрами [9].
Современная междисциплинарная концепция патофизиологии ноктурии связана с четырьмя основными механизмами [9, 22]:
- общим увеличением объема мочи (24-часовая полиурия);
- увеличением выработки мочи только ночью (ночная полиурия);
- постоянным или только ночным уменьшением емкости мочевого пузыря;
- любым (первичным или вторичным) расстройством ночного сна (табл. 1).
В норме у здорового взрослого человека в течение суток образуется не более 40 мл/кг мочи. Термин «24-часовая полиурия» обозначает, что общий объем продуцируемой за 24 часа мочи превышает 40 мл/кг, что рассматривается уже как нарушение суточного диуреза [10]. Ночная полиурия устанавливается на основании превышения ночного диуреза над дневным на 20–33% [23]. Эта доля называется индексом ночной полиурии (ИНП) [23]. В норме доля ночного диуреза от общего суточного количества образующейся мочи варьируется от 14% у молодых людей до 34% у людей старше 65 лет [23]. Есть и другие методы оценки адекватности ночного диуреза, например объем ночного диуреза у здорового человека не превышает 0,9 мл/мин, или 90 мл/ч, что зависит не только от объема мочи, но и от продолжительности сна (который должен быть не менее 8 часов) [24]. Ночная полиурия является одной из наиболее частых причин ноктурии у взрослых, особенно в пожилом возрасте [25]. Чем старше человек, тем больше он выделяет мочи в ночное время, а после 50 лет количество мочи ночью удваивается – это неизбежный атрибут старения [6]. Ночная полиурия – первый ключевой фактор патогенеза ноктурии.
Некоторые авторы выделяют два типа ночной полиурии: возрастную и абсолютную [6, 23, 26].
При возрастной ночной полиурии увеличение ночного диуреза не является плавным – статистически достоверные различия наблюдаются только относительно 50-летнего рубежа. По достижении указанного возраста происходит как бы «скачкообразное» его увеличение. Возрастной рубеж и полиурический эффект вполне определены – после 50 лет количество мочи ночью удваивается со всеми вытекающими из этого обстоятельства последствиями. О возрастной ночной полиурии говорят: если за стандартное время ночного сна (8 часов) диурез мужчины превышает не более чем на 33% суточный диурез здорового мужчины до 50 лет без клинических СНМП (что составляет в среднем >0,9 мл/мин) [26].
О полиурической (абсолютной) форме ночной полиурии говорят: если ночной диурез мужчины в любом возрасте за 8 часов сна превышает средневозрастные показатели здорового мужчины без СНМП более чем на 35%, о чем уже говорилось выше [23].

Деление ночной полиурии на вышеописанные типы имеет большое клиническое значение: если в первом случае не требуется проведения специальных исследований, то при втором показано расширение диагностической программы для выявления ее вероятных причин, т.к. в данном случае увеличение ночного диуреза не может быть объяснено одним лишь возрастным фактором [6] (табл. 2).
«Списывание» ночной полиурии и ноктурии у пациента только на возраст представляется в корне неверным и вредным, т.к. уводит врача от выявления причин, служащих прямой или косвенной угрозой жизни пациента (например, ночная полиурия как маркер сердечной недостаточности или сахарного диабета 2 типа). Подсчет суточного и ночного диуреза простой, но вполне надежный метод оценки наличия и выраженности ночной полиурии и должен применяться во всех случаях при наличии жалоб больного на ноктурию для дифференциальной диагностики возрастного и абсолютного типов ночной полиурии.
Уменьшение резервуарной функции мочевого пузыря, которое чаще возникает с возрастом и у мужчин, и у женщин, считается третьим ключевым фактором патогенеза ноктурии. Условия, в которых мочевой пузырь накапливает мочу днем (вертикальное положение тела) и в течение ночи (горизонтальное положение тела), совершенно разные [6]. Именно первая порция утренней мочи после ночного сна является маркером его резервуарной функции во время непрерывного ночного сна в норме. Мужчины без ноктурии старше 50 лет при утреннем пробуждении выделяют гораздо больше мочи (в среднем 354 мл), чем днем (в среднем 227 мл) [6]. Таким образом, способность мочевого пузыря к накоплению и удержанию мочи в горизонтальном положении на 55,9% выше, чем в привычном для нас вертикальном положении. Если, несмотря на эти физиологические особенности, пациент вынужден вставать мочиться ночью, это означает, что резервуарная функция мочевого пузыря у него нарушена. Причем при нормальном ночном диурезе (отсутствии возрастной или абсолютной ночной полиурии) преимущественно нарушения резервуарной функции мочевого пузыря уже способны приводить к ноктурии.
Уродинамические исследования показали, что у пациентов с ДГПЖ ночью явно нарастают обструктивные нарушения уродинамики нижних мочевых путей. Е.Л. Вишневский и соавт. (2007) предложили данное патологическое состояние обозначить термином «обструктивная ноктурия» [6].
Этот механизм ноктурии, по мнению авторов, специфичен для мужчин (в отличие от женщин) и отражает физиологические колебания объема предстательной железы в течение суток – ночью объем железы на 10–30% больше, чем в дневное время, что связано с развитием или усугублением ночью простатической конгестии, или простатостаза [6].
Клиническое значение ноктурии
Симптом ноктурии вплоть до настоящего времени, к сожалению, остается связанным в отечественной литературе исключительно с заболеваниями предстательной железы. Однако сегодня уже абсолютно ясно, что ноктурия – это патологический симптом, имеющий мультифакторный патогенез, огромное медико-социальное значение и высокую прогностическую ценность. Возрастная ноктурия – это удел обоих полов, ее распространенность и среди мужчин, и среди женщин в настоящее время крайне высока и увеличивается с возрастом. Даже однократная ноктурия является абсолютно патологическим симптомом, существенно и крайне негативно влияющим на качество жизни человека за счет запуска целого спектра возраст-ассоциированной патологии, достоверно приводит к усилению коморбидности и повышению риска смертности пожилых людей. Вместе с тем характерной особенностью ноктурии в настоящее время следует считать ее появление у более молодых людей, и этот «феномен омоложения» ноктурии следует считать отражением высокой частоты в популяции заболеваний и патологических состояний, которые прямо или косвенно вовлечены в современный патогенез ноктурии.
Можно полагать, что диагностическое значение ноктурии соответствует нашему сегодняшнему пониманию значения эректильной дисфункции как барометра гормонально-cосудистого здоровья мужчины, поскольку в основе нарушений эрекции и мочеиспускания лежат одинаковые патофизиологические механизмы (ожирение, инсулинорезистентность, сахарный диабет, андрогенный дефицит, дислипидемия, эндотелиальная дисфункция, депрессии, артериальная гипертензия и т.д.). Ноктурия – один из самых ранних маркеров гормонально-метаболического нездоровья человека независимо от его возраста [7, 18, 27, 28].
Комплексная патогенетическая диагностика причин ноктурии
В связи с ускорением биологического старения популяции Земли ноктурия сегодня, как никогда ранее, требует активного раннего выявления и комплексного патогенетического лечения, которого, к сожалению, до сих пор не получает подавляющее большинство пациентов. Если врач проводит обследование методически последовательно и тщательно, то выявление ноктурии в клинической практике не представляет никаких трудностей, т.к. факт наличия ночного мочеиспускания может быть легко установлен уже в ходе беседы с пациентом, а также на основании использования опросника Международной шкалы оценки симптомов, связанных с заболеваниями предстательной железы (IPSS-QL), которым пользуется подавляющее большинство практикующих урологов. Проблема в том, что до сих пор подавляющее большинство врачей не уделяют данному симптому должного внимания, несмотря на то что именно ноктурия является тем симптомом, который больше других СНМП ухудшает качество жизни стареющих пациентов [29, 30].
После получения информации о наличии у пациента ноктурии следует дополнительно проводить анкетирование по шкале AMS (андрогенного дефицита) и шкале МИЭФ-5 (оценка эректильной=эндотелиальной дисфункции), т.к. андрогенный дефицит и эндотелиальная дисфункция – ключевые механизмы возрастного старения мочевой системы и полученная с помощью этих опросников предварительная клиническая информация позволит врачу правильнее выбрать направление диагностического поиска этиологических причин ноктурии. Рекомендуется заполнение дневника мочеиспусканий в течение 3–5 дней для более объективной оценки выявленных нарушений мочеиспускания [31]. После анкетирования проводится объективное физикальное обследование, в ходе которого нужно измерять уровень артериального давления, активно выявлять ожирение (окружность талии ≥94 см), кожные маркеры инсулинорезистентности и андрогенного дефицита, оценивать характер лобкового оволосения, наличие или отсутствие гинекомастии. Далее следует оценка урологического статуса по стандартным методикам (осмотр, пальпация мошонки, пальцевое ректальное исследование предстательной железы) [31].

Полезным диагностическим тестом может быть выявление урогенитальной нейропатии, которая может приводить к нарушениям резервуарной емкости мочевого пузыря, особенно у больных сопутствующими психо-неврологическими заболеваниями, сахарным диабетом, с дефицитом половых гормонов. Самым простым способом диагностики урогенитальной нейропатии считается определение температурной чувствительности на половом члене (метод Калинченко–Роживанова). На лабораторном этапе обследования необходимо изучить все особенности диуреза у пациента. Для измерения суточного диуреза рекомендуется стандартная проба Зимницкого. По ней можно рассчитать в процентах удельный все ночного диуреза в общем суточном диурезе, и если он превышает 33%, имеется неоспоримое доказательство наличия ноктурии. Также следует просить лабораторию на основании показателей суточного диуреза и определения уровней креатинина в моче и крови рассчитать скорость клубочковой фильтрации (СКФ), которая служит самым достоверным маркером суммарной функции почек, при нарушениях которых также возникает ноктурия. Кроме того, лабораторный этап диагностики ноктурии обязательно должен включать выполнение других биохимических, а также минимума гормональных исследований [32–36].
Следует обязательно выполнять анализы крови на холестерин и липидный спектр, а также на глюкозу. При выявлении признаков андрогенного дефицита возникает необходимость определения уровней общего тестостерона, ЛГ, ГСПС (СССГ), ТТГ, пролактина, 25(ОН)-витамина D3, а при необходимости рассчитать уровень свободного (доступного) тестостерона по номограмме Вермюллена или по специальной формуле, доступной в Интернете [31]. При наличии ожирения для уточнения особенностей строения тела следует всем пациентам проводить биоимпедансное исследование тела, которое позволяет уточнять количество жировой и активной мышечной ткани, а также содержание воды, что важно при диагностике скрытых периферических отеков как причины ноктурии. Кроме того, биоимпедансное исследование позволяет рано выявлять инсулинорезистентность [31]. Но если у пациента уже имеются кожные признаки инсулинорезистентности, необходимо уточнять характер углеводных нарушений (кроме глюкозы, изучить уровень гликированного гемоглобина, инсулина и/или С-пептида в крови). Если на приеме первичный пациент с ноктурией старше 50 лет, следует определить в крови уровень общего простатоспецифического антигена (ПСА) для раннего скрининга рака предстательной железы. Важное место в этиологической диагностике причин ноктурии сегодня занимают методы определения гормонов, нарушения синтеза которых достоверно связаны с ночным мочеиспусканием (тестостерон, вазопрессин [антидиуретический гормон], мелатонин, инсулин, кортизол) [31]. В ходе комплексного обследования далее необходимо оценить анатомо-функциональное состояние мочевого пузыря с помощью УЗИ (объем предстательной железы, количество остаточной мочи), а также измерять толщину стенки мочевого пузыря (показатель степени компенсации детрузора), при возможности – исследовать мочепузырный и простатический кровоток (УЗ-допплерография) [31–36].
При выявлении у пациента с ноктурией эректильной дисфункции (по шкале МИЭФ-5) следует уточнить состояние эндотелия сосудов с помощью Ангиоскана. Данное обследование позволяет устанавливать биологический возраст сосудов, в т.ч. мочепузырных сосудов, что является важным этапом диагностики механизмов ноктурии, поскольку ключевое значение в патогенезе ноктурии отводится уменьшению резервуарной функции мочевого пузыря на фоне возрастных нарушений кровоснабжения (ишемия и гипоксия детрузора). Ангиоскан позволяет рано выявлять эти нарушения и обосновывать назначение ингибиторов ФДЭ-5 многим пациентам с ноктурией [31]. Использование стандартной урофлоуметрии позволяет обнаруживать нарушения сократительной способности детрузора мочевого пузыря, особенно четко выявляемые у женщин и мужчин с нормальным объемом предстательной железы. Снижение максимальной скорости мочеиспускания (МОСМ) менее 10 мл/с свидетельствует о клинически значимой гипотонии детрузора, что может отражать мочепузырную саркопению в процессе старения мочевого пузыря [31]. Только такое максимально полное и комплексное обследование позволяет устанавливать истинную причину ноктурии у каждого пациента и назначать не симптоматическое, а патогенетическое лечение, которое приведет к полному его излечению.
Критический обзор современных методов терапии ноктурии
Образ жизни и поведенческая терапия. Коррекция образа жизни часто используется в качестве терапевтической опции первой линии и включает рекомендации осуществлять мочеиспускание непосредственно перед сном, снижение или резкое ограничение потребления жидкости в вечернее и ночное время (прежде всего напитков с кофеином и алкоголем), коррекцию времени приема лекарств (например, прием диуретиков в середине дня), нормализацию сна, использование защитного нижнего белья [37, 38]. При наличии симптомокомплекса гиперактивного мочевого пузыря (ГАМП) рекомендуются упражнения для мышц тазового дна, обладающие весьма умеренным эффектом в отношении ноктурии [39]. К сожалению, нет ни одного рандомизированного клинического исследования (РКИ), показавшего эффективность поведенческой терапии при ноктурии. В доступных на сегодняшний день РКИ также не показана эффективность при ноктурии приема фуросемида за 6 часов до сна или растительных препаратов, в частности Pygeum africanum и Serenoa repens [40–42].
Применение α-1-адреноблокаторов. Данная группа препаратов наиболее часто применяется в клинической практике для коррекции ноктурии, хотя «механизм» их «влияния» на симптом ночного мочеиспускания остается непонятным. Если учесть, что в патогенезе ноктурии преобладают возрастные гормонально-инволютивные нарушения гипофиза и эпифиза (прежде всего дефицит вазопрессина, или антидиуретического гормона [АДГ], синтезирующегося в гипофизе и инициирующего ночную полиурию как ключевой патогенетический механизм ноктурии, а также дефицит эпифизарного гормона сна мелатонина, вызывающего бессонницу), которые при этом взаимно отягощают негативное влияние друг друга на фоне возрастной митохондриальной дисфункции почек и детрузора, то не совсем понятно, как препараты, блокирующие α-1-адренорецепторы нижних мочевых путей, оказывают влияние на эти гормональные механизмы. Все исследования α-1-адреноблокаторов были проведены в контексте управления симптомами нижних мочевых путей (СНМП) вследствие доброкачественной гиперплазии предстательной железы (ДГПЖ), которая сегодня уже не рассматривается как главная причина симптома ночного мочеиспускания. Только пять исследований в виде РКИ или вторичных анализов РКИ были сосредоточены на ноктурии как первичном исходе [43–46]. При этом только в одном РКИ сравнивались эффекты α-1-адреноблокатора (тамсулозин по 0,4 мг/сут) и плацебо на ноктурию в отношении 117 пациентов с симптомами СНМП/ДГПЖ старше 45 лет с общим баллом по IPSS ≥13 и двумя или более эпизодами ноктурии в течение 8 недель терапии [43]. Среднее снижение количества эпизодов ноктурии в обеих группах достоверно не различалось. Несмотря на то что вторичные конечные точки (ноктурия) по шкале IPSS были статистически значимыми, исследование не смогло продемонстрировать превосходство тамсулозина в улучшении ноктурии. В другом исследовании оценивался эффект приема в течение года тамсулозина 0,4 мг/сут и плацебо 66 больными после трансуретральной резекции простаты. В течение года снижение количества ночных пробуждений в обеих группах существенно не различалось [44]. При сравнении эффектов доксазозина медленного высвобождения по 4 мг/сут с тамсулозином по 0,2 мг/сут в течение 8 недель от пациентов с СНМП/ДГПЖ получены данные о снижении на 25% частоты ночных мочеиспусканий на фоне приема доксазозина по сравнению с тамсулозином [45]. Основная проблема данного исследования состоит в следующем: сравнивались потенциально неэквивалентные терапевтические дозы препаратов (4,0 мг доксазозина и 0,2 мг тамсулозина). В двух других исследованиях, специально обращенных к эффектам α-1-адреноблокаторов при ноктурии, использовали не только α-1-адреноблокаторы и плацебо, но и финастерид и комбинированную терапию. Оба исследования представили значительно лучшие результаты терапии α-1-адреноблокаторами и их комбинациями по сравнению с плацебо, но продемонстрировали очень небольшой эффект на выраженность ноктурии. Таким образом, в дизайне большинства исследований, посвященных СНМП/ДГПЖ, целенаправленная диагностика ноктурии не проводилась, а влияние препаратов на ноктурию изучалось на основе традиционных тестов (шкала IPSS-QL, остаточная моча) без учета суточного диуреза пациентов, что в контексте методологической оценки ноктурии крайне недостаточно. Таким образом, можно сделать вывод: уровень доказательств, подтверждающих эффективность α-1-адреноблокаторов в лечении ноктурии, очень низкий [46, 47].
Применение М-холинолитиков. Подавляющее большинство исследований по М-холинолитикам проводилось только в контексте управления гиперактивным мочевым пузырем (ГАМП). Можно выделить лишь одно РКИ, посвященное сравнению толтеродина и плацебо, где ноктурия была первичной конечной точкой [48]. В этом исследовании изучалось влияние 12-недельной терапии толтеродином и плацебо на 850 мужчин и женщин с ГАМП и ноктурией. У больных был оценены параметры диуреза, а главным критерием стало изменение среднего числа ночных мочеиспусканий по окончании терапии. Хотя толтеродин против плацебо существенно улучшал симптомы ГАМП, разница между этими двумя группами по влиянию на частоту ноктурии была статистически незначимой (уменьшение на 19 и 23% в группах плацебо и толтеродина соответственно, р=0,145). Все другие исследования эффективности М-холинолитиков, направленные на исследование ноктурии, представляли собой по сути совокупный анализ предыдущих РКИ [49–52].
Два из этих исследований сообщили о статистически значимом снижении ночных мочеиспусканий на фоне приема М-холинолитиков, однако степень эффекта была низкой, а ее клиническая значимость сомнительной. Имеющийся мета-анализ по использованию М-холинолитиков при ГАМП не оценивает их влияния на ноктурию, скорее всего по причине отсутствия таковых данных [53]. Как и в случае с α-1-адреноблокаторами, строгие критерии настоящего мета-анализа привели к исключению многочисленных исследований, оценивающих эффекты М-холинолитиков, в которых ноктурия была лишь вторичной конечной точкой. Таким образом, имеются весьма ограниченные свидетельства того, что М-холинолитики эффективны для конкретного управления ноктурией как в контексте гиперактивного детрузора, так и вне связи с ним.
Применение нестероидных противовоспалительных препаратов (НПВП)
В одном исследовании оценивается эффективность целекоксиба по сравнению с плацебо для лечения ноктурии [54]. В исследование были включены 80 мужчин с СНМП/ДГПЖ с симптоматикой по шкале IPSS >8 и двумя или более ночными мочеиспусканиями. Пациенты получали либо плацебо, либо целекоксиб по 100 мг в 21.00 ежедневно в течение месяца. Первичная конечная точка исследования была сосредоточена на ноктурии, которая оценивалась посредством опроса и самооценки пациентом (отлично, улучшилась или без изменений). Результаты в группе целекоксиба были более благоприятными [54].
В другом рандомизированном плацебо-контролируемом перекрестном исследовании сравнивали эффекты диклофенака и плацебо в течение 2 недель терапии 28 мужчин и женщин с ночной полиурией (два и более ночных мочеиспусканий и индекс ночной полиурии >33%) [55]. Главным итогом стало изменение частоты ночных мочеиспусканий: диклофенак значительно сократил число и степень ночной полиурии. Однако его эффект хоть и оказался статистически достоверным, но был клинически очень слабым (снижение частоты ноктурии на 0,3 мочеиспускания за ночь в группе диклофенака по сравнению со средним снижением на 0,1 мочеиспускания за ночь в группе плацебо), что делает клиническую значимость этих данных весьма сомнительной [55]. Таким образом, в отсутствие других отчетов с использованием НПВП уровень доказательств в поддержку их использования в клинической практике для управления ноктурией остается низким.
Применение мелатонина. В самом первом рандомизированном двойном слепом перекрестном исследовании эффективности мелатонина при ноктурии, проведенном в 2004 г., сравнивались эффекты мелатонина и плацебо при лечении 20 мужчин с инфравезикальной обструкцией на фоне ДГПЖ, которые сообщали о выраженной ноктурии (три или больше раз за ночь) [56]. У пациентов, принимавших 2 мг/сут мелатонина или плацебо в течение 4 недель, оценивали частоту мочеиспусканий исходно, через 4 и 8 недель терапии. Первичной конечной точкой было среднее изменение количества эпизодов ноктурии от исходного уровня. После лечения средняя частота ноктурии за ночь уменьшилась с 3,1 в начале исследования до 2,8 с мелатонином и до 3,0 в группе плацебо (р=0,07). Никакого эффекта на продукцию мочи выявлено не было. Эти данные в то время не подтверждали эффективность использования мелатонина в лечении ноктурии [56].
Однако за последние 10 лет проведено еще несколько КРИ по данной тематике. В одном из них сравнивалось влияние мелатонина и гидрохлорида рилмазафона (гипнотика) на ноктурию у пожилых пациентов [57]. Двадцать пациентов получали мелатонин (2 мг/сут), 22 – рилмазафон (2 мг/сут) в течение 4 недель. В начале исследования достоверных различий между возрастом, качеством жизни и уровнем сывороточного мелатонина между двумя группами не было. Через 4 недели терапии в обеих группах количество ночных мочеиспусканий значительно снизилось, а оценка качества жизни стала значительно лучше. Уровень сывороточного мелатонина существенно повысился в группе, получавшей препарат мелатонина, и остался неизменным в группе, леченной гипнотиком. Исследование выявило эффективность и мелатонина, и гипнотика рилмазафона при лечении ноктурии у пожилых людей [57]. В двух последних экспериментальных исследованиях установлено, что мелатонин значительно и дозозависимо увеличивает емкость мочевого пузыря лабораторных животных за счет блокады мышечной контрактильности [58, 59].
При этом мелатонин не изменяет плазменный уровень АДГ (вазопрессина) и предсердного натрийуретического пептида, а также не оказывает существенного влияния на давление сокращения детрузора. Позитивные эффекты мелатонина на детрузор мочевого пузыря опосредуются, как предполагают, его влиянием на мозговые рецепторы к гамма-аминомасляной кислоте (ГАМК), что приводит к уменьшению ночной продукции мочи и расслаблению детрузора [59]. В последнем клиническом перекрестном исследовании проведен анализ связи между секрецией мелатонина и ноктурией у 861 пожилого мужчины и женщины (средний возраст – 72 года) [60]. Одномерный сравнительный анализ выявил близкие к достоверным ассоциации ноктурии с возрастом, полом, индексом массы тела (ИМТ), скоростью клубочковой фильтрации (СКФ), приемом блокаторов кальциевых каналов, наличием ДГПЖ, суточным диурезом, уровнем в моче 6-сульфатоксимелатонина, продолжительностью нахождения в постели и дневной и ночной физической активностью. Мультивариационный анализ дополнительно показал, что более высокий уровень 6-сульфатоксимелатонина в моче достоверно связан с более низкой частотой ноктурии [60].
Применение аналога антидиуретического гормона АДГ (вазопрессина) – десмопрессина. Десмопрессин остается на сегодня наиболее изученным препаратом из всех предложенных для эффективного управления ноктурией [61–78]. Это синтетический аналог человеческого гормона вазопрессина, способствующий концентрированию мочи в ночное время за счет воздействия на специфические V2-рецепторы в дистальных канальцах почек. Десмопрессин можно применять в виде спрея (интраназально) или перорально в виде обычных таблеток, или недавно выпущенных орально диспергированных таблеток (ODT-форма). В доступной научной литературе описаны результаты около 20 КРИ по оценке эффективности и безопасности десмопрессина в качестве специфического лечения ноктурии по сравнению с плацебо. В этих исследованиях изучается ноктурия у больных с особыми патологическими состояниями, такими как рассеянный склероз и другие множественные неврологические заболевания, а также исследуются вопросы комбинированной терапии десмопрессином, например с фуросемидом. Результаты имеющихся релевантных КРИ показали, что десмопрессин достоверно превосходит плацебо с точки зрения уменьшения частоты эпизодов ноктурии. При этом он оказывает преимущественное влияние на ночную полиурию, т.к. достоверное уменьшение ночного диуреза отмечено во всех проведенных на сегодняшний день исследованиях. Имеющиеся КРИ рекомендуют использовать десмопрессин как мужчинам, так и женщинам с ночной полиурией в индивидуально подобранных в ходе титрации минимально эффективных дозах. Оценка качества жизни также продемонстрировала положительную динамику у больных, получавших десмопрессин по сравнению с плацебо. Все эти данные находятся в соответствии с предыдущими результатами мета-анализов опубликованных КРИ, в целом поддерживают объективность и высокий уровень доказательности в отношении целесообразности применения десмопрессина для лечения ночной полиурии у взрослых [79–81]. Десмопрессин еще в 2011 г. был одобрен Европейским обществом урологов и в настоящее время внесен в соответствующие Рекомендации по ведению пациентов с СНМП, включая инфравезикальную обструкцию, для лечения ночной полиурии у мужчин и женщин [82].
Хирургические и интервенционные методы лечения. Данные методы терапии применительно к ноктурии до конца не разработаны [44]. Инъекции ботулотоксина в детрузор, сакральная нейромодуляция или электростимуляция большеберцовых нервов (тибиальная стимуляция) используются в контексте лечения преимущественно ГАМП, но их влияние на ноктурию не изучалось ни в одном из доступных исследований.
Перспективная патогенетическая фармакотерапия ноктурии
Ингибиторы ФДЭ-5. Ингибиторы фосфодиэстеразы 5-го типа (ФДЭ-5) в настоящее время рассматриваются как патогенетические препараты для коррекции любой эндотелиальной дисфункции; в частности это препараты первой линии терапии эректильной дисфункции у мужчин. С учетом новейших данных фармакологии, физиологии и клинической медицины эти препараты имеют точкой приложения своих фармакологических эффектов динамическую систему «NO-цГМФ-NO-синтазы», важная роль которой в обеспечении нормального функционирования всех органов мочеполовой системы, в т.ч. детрузора, у мужчин достоверно доказана. В 2014 г. ингибиторы ФДЭ-5 впервые были включены в Рекомендации Европейского общества урологов (EAU) по ведению больных СНМП, включая доброкачественную инфравезикальную обструкцию как средства терапии СНМП у пациентов с эректильной дисфункцией [83]. Это связано с доказанной клинической эффективностью ингибиторов ФДЭ-5 улучшать СНМП у мужчин за счет накопления в клетках цГМФ – основного участника синтеза оксида азота NO, обладающего выраженным вазомодулирующим эффектом, приводящим к улучшению кровоснабжения детрузора мочевого пузыря и предстательной железы, что сопровождается уменьшением их контрактильности и улучшением параметров мочеиспускания [84–86]. Недавние экспериментальные исследования показали, что митохондриальная дисфункция служит важным механизмом возрастного повреждения ткани почек, ведущим к ноктурии, а специфический ингибитор ФДЭ-5 силденафил способствует за счет накопления в клетках почек цГМФ биогенезу митохондрий в клетках коркового вещества почек и восстановлению структуры и функции почечной ткани, что делает ингибиторы ФДЭ-5 перспективным препаратом коррекции нарушений функций почек, в т.ч. при старении [87]. Аналогичный эффект улучшения почечной митоходриальной дисфункции на фоне экспериментального воспалительного повреждения ткани почек продемонстрировал еще один ингибитор ФДЭ-5 – тадалафил [88]. Длительное и раннее назначение ингибиторов ФДЭ-5 пациентам с почечной патологией в анамнезе способствует усилению синтеза оксида азота (NO) в ткани почек и уменьшению в ней концентрации его самого главного антагониста – мощного вазоконстриктора эндотелина-1, что существенно улучшает почечную микроциркуляцию и рассматривается некоторыми исследователями как эффективное средство профилактики прогрессирования хронических заболеваний почек [89–91].
У пожилых людей между уровнем в крови эндогенного ингибитора синтазы оксида азота (NO) – асимметричного диметиларгинина (АДМА) – и частотой ноктурии существует достоверная обратная связь [92]. Если учесть, что высокий уровень АДМА ассоциируется с дефицитом эффектов ФДЭ-5, становится очевидной перспективная роль ингибиторов ФДЭ-5 в терапии ноктурией. При длительном курсовом назначении ингибиторов ФДЭ-5 достигается улучшение микроциркуляции детрузора, проксимальной уретры и предстательной железы, что в целом позволяет улучшать тонус и эластичность стенки детрузора и оказывает благоприятное влияние на клиническое течение СНМП. Однако эффективность ингибиторов ФДЭ-5 в отношении ноктурии пока остается неизвестной ввиду отсутствия подобных КРИ [93].
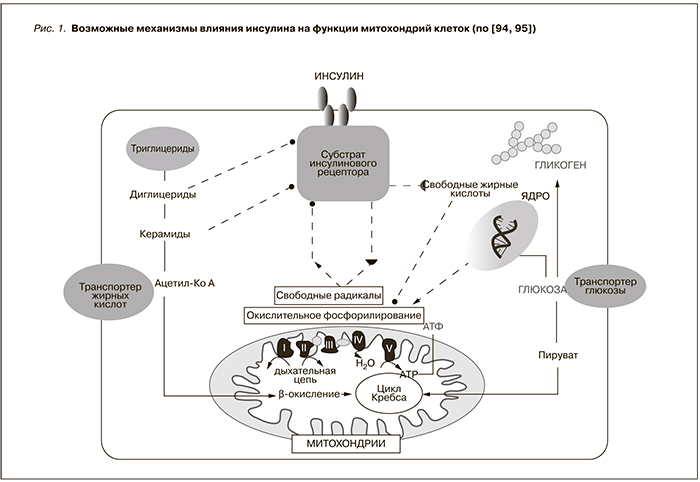
Коррекция инсулинорезистентности (инсулиновые сенситайзеры). В настоящее время получены убедительные доказательства активного участия инсулина в регуляции функции почек, поэтому неизбежно развивающаяся после 40 лет инсулинорезистентность может вызывать прогрессивное нарушение структуры и функции митохондрий почек, что способствует появлению и прогрессированию ноктурии [94, 95] (рис. 1).
Поэтому раннее выявление и правильная коррекция инсулинорезистентности могут стать одними из новых, но совершенно патогенетически обоснованных медикаментозных методов комплексной фармакотерапии ноктурии, направленными прежде всего на ночную полиурию. Одним из наиболее оптимальных препаратов коррекции инсулинорезистентности является метформин, который, согласно последним мультицентровым исследованиям и обзорам, не только наиболее безопасный препарат для коррекции инсулинорезистентности у больных хроническими болезнями почек, но и независимо и достоверно снижает частоту неблагоприятных сердечно-сосудистых событий у них, включая больных почечной недостаточностью [96, 97].
Половые гормоны. Известно, что от вида и уровня половых гормонов зависят такие гендерные характеристики почек, как их общий размер, размер и количество клубочков, различия в клубочковой гемодинамике [98]. Опосредованные механизмы влияния половых гормонов на почечную ткань включают их влияние на функцию системы ангиотензина-ренина-альдостерона, на синтез коллагена и специфических сигнальных молекул (например, оксид азота NO, эндотелин-1, свободные радикалы кислорода, цитокины и факторы роста) [99]. При возраст-ассоциированных хронических заболеваниях почек в их ткани выявлены прогрессирующие нарушения синтеза оксида азота (NO) – основного универсального модулятора сосудистого русла, обладающего выраженными вазодилатирующими эффектами [100, 101]. Исследования выявили выраженное нарушение функции эндотелиальной NO-синтазы (eNOS) как в корковом, так и мозговом слое почек, а также уменьшение эффектов нейрональной NO-синтазы (nNOS) в паренхиме почек при хронических почечных заболеваниях [102]. Женщины имеют более выраженную защиту от повреждающих почки механизмов за счет более адекватного синтеза оксида азота [103]. Mужчины с возрастом теряют способность адекватного синтеза оксида азота на фоне снижения уровня тестостерона, что приводит к повышению риска повреждения почек [104].
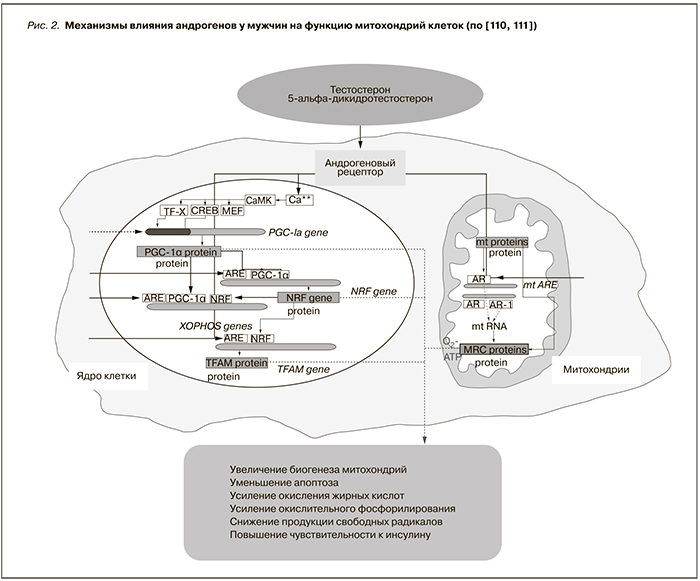
Хроническое подавление активности нейрональной NO-синтазы в почках способствует компенсаторному повышению активности эндотелиальной NO-синтазы в коре почек, однако этого оказывается недостаточно для поддержания адекватного синтеза оксида азота, что приводит к вазоконстрикции, развитию артериальной гипертонии, снижению клубочковой фильтрации и полиурии [105]. Некоторые исследования показали, что возраст (p<0,0001), уровень креатинина (p=0,015), систолическое артериальное давление (p<0,0001), уровень калия (p=0,021) и общего тестостерона сыворотки крови (p=0,002) были независимо связаны с объемом 24-часовой экскреции натрия почками [106]. Это позволяет говорить о наличии у половых гормонов (эстрогенов у женщин и тестостерона у мужчин) определенных нефропротективных клеточных и субклеточных эффектов, которые могут нарушаться при возрастном дефиците половых гормонов, что приводит к нарушению концентрационной функции почек и появлению такого важного компонента патогенеза ноктурии, как ночная или 24-часовая полиурия [107–111] (рис. 2).
Витамин (гормон) D. Дефицит витамина (гормона) D является широко распространенным метаболическим нарушением у современных жителей Земли и характеризуется неблагоприятными последствиями, включая ожирение, сахарный диабет 2 типа, депрессии, усугубление дефицита половых гормонов, а также достоверно повышает риски кардиоваскулярной и онкологической смертности [112–116]. Согласно результатам крупномасштабного исследования Health and Nutrition Examination Survey, включившего 2387 мужчин старше 20 лет, 89% обследованных имели недостаточность витамина (гормона) D (уровень в плазме <30 нг/мл), а у 55% мужчин имел место выраженный его дефицит (уровень в плазме <20 нг/мл). При этом 48% мужчин с более низким уровнем витамина (гормона) D имели как минимум один симптом нижних мочевых путей (СНМП), включая ноктурию [117]. Согласно новейшим экспериментальным данным, блокада рецепторов к витамину (гормону) D приводит к уменьшению ренин-ангиотензиновой активности в паравентрикулярных ядрах гипоталамуса, что проявляется полидипсией и полиурией [118]. C другой стороны, высокие дозы витамина (гормона) D в эксперименте ведут к гиперкальциурии и простагландин-индуцированной полиурии [119]. Таким образом, роль витамина (гормона) D в управлении ноктурией пока остается недостаточно понятной, но имеющиеся единичные публикации на этот счет позволяют высказать предположение, будто, очевидно, необходим некий оптимальный уровень данного гормона, чтобы обеспечить его протективный эффект в отношении мочевой системы, для чего требуются дальнейшие доказательные исследования.
Заключение
Ноктурия – это широко распространенный возраст-ассоциированный симптом с множеством потенциальных базовых патофизиологических механизмов, многие из которых имеют негативные последствия, прямо или косвенно угрожающие жизни стареющего человека независимо от его пола. Однако еще до недавнего времени термин «ноктурия» применялся преимущественно для описания нарушений мочеиспускания на фоне доброкачественной гиперплазии предстательной железы (ДГПЖ) у мужчин и отождествлялся практически с ней, но при этом в урологии до сих пор нет ни одного эффективного патогенетического фармакотерапевтического метода, позволившего излечить пациента от ноктурии. Чем чаще урологи сталкиваются с низкой эффективностью стандартной терапии ноктурии, тем больше вопросов возникает. Именно по причине низкой эффективности лечения у уролога пациенты с ноктурией все чаще и чаще обращаются к врачам любых специальностей, которые могли бы им помочь. Сегодня ноктурия – это комплексная мультифакторная и междисциплинарная проблема, приобретающая все более универсальное клиническое, прогностическое и методологическое значение, но при этом крайне неудовлетворительно выявляемая или вовсе не выявляемая в рутинной клинической практике и потому практически никак не корректируемая или корректируемая преимущественно симптоматическими методами. По счастью, сегодня термин «ноктурия» знаком врачам многих специальностей. Столь широкая популярность термина объясняется общностью клинических проявлений различных заболеваний нижних мочевых путей у обоих полов, при этом в основе ноктурии лежат однотипные патофизиологические механизмы, возникающие при нарушениях гормональной регуляции всех органов мочевой системы, происходящих в связи с биологическим старением. В настоящее время такой подход приоритетен в понимании физиологии и патологии ночного мочеиспускания. Вот почему оценка суточной и ночной продукции мочи является «краеугольным камнем первичной оценки» этого симптома, однако в большинстве имеющихся КРИ, оценивающих влияние различных лечебных опций на выраженность ноктурии, такая оценка либо вовсе отсутствует, либо проведена в недостаточном объеме или методологически неправильно.
Несомненно, для того чтобы сделать более определенные выводы по перспективам патогенетической фармакотерапии ноктурии, настоятельно нужно сделать следующее:
- достичь междисциплинарного консенсуса относительно роли каждого механизма и метода оценки ноктурии;
- адекватно оценить и охарактеризовать общую популяцию пациентов с ноктурией;
- достичь дальнейшей интеграции и подчеркнуть важность адекватной оценки всех характеристик ноктурии для эффективного управления ею среди руководящих общих принципов ведения больных СНМП;
- систематически оценивать качество жизни и сна с помощью проверенных инструментов в клинических испытаниях;
- уточнить роль поведенческих и интервенционных методов лечения в управлении ноктурией;
- уточнить роль нарушений гормональной регуляции мочеобразования и мочевыведения в патогенезе полиурии и ноктурии и клиническую эффективность этого аспекта коррекции ночного мочеиспускания.
Совершенно очевидно, что прогресс в области нашего понимания патофизиологической сущности ноктурии и, соответственно, прорыв в ее фармакологической патогенетической коррекции могут быть достигнуты только на позициях междисциплинарной и интегративной клинической медицины XXI в.



