Желудочно-кишечные осложнения после трансплантации почки встречаются более чем в 80% от общего количества «хирургических» неспецифических осложнений. Наиболее часто диагностируются заболевания верхнего отдела желудочно-кишечного тракта, такие как язвенная болезнь желудка и двенадцатиперстной кишки, дивертикулез (1,0–4,7%), кровотечения, опухоли колоректальной локализации, острый и гангренозный аппендицит (0,4–1,0%). Менее часто встречаются такие осложнения, как кишечная непроходимость, холецистит, инфекционный гастрит, панкреатит, псевдомембранозный колит, изъязвление слизистой желудка и двенадцатиперстной кишки, перфорация толстой кишки (3,5–11,5%) [1]. При этом установлено, что инфицированность вирусом папилломы человека реципиентов почечного трансплантата в 10 раз увеличивает риск развития рака прямой и ободочной кишки [2].
Своевременная диагностика и хирургическое лечение чрезвычайно важны для снижения смертности и уменьшения количества госпитализаций от этих гастроинтестициальных осложнений. Смертность при несвоевременно диагностированных осложнениях составляет от 63,6 до 100% [3, 4].
Большинство из них возникает в первые 3 месяца после трансплантации почки. Дивертикулез, язвенный колит, каловый завал могут приводить к перфорации дивертикула с возникновением перитонита, формированием абсцесса и кровотечением. Клинически данное осложнение проявляется абдоминальными болями и кишечным распиранием. Проявление при этом симптомов кишечной непроходимости или перитонита предполагает ревизию брюшной полости. Смертность при этом крайне высока и достигает от 70 до 90%. Поскольку высока смертность и госпитализация, связанная с перфорацией дивертикула и как следствие – кровотечением, исследование кишечника должно быть выполнено больным после 45 лет до трансплантации для диагностики выявления изменений в кишечнике. В случае выявления дивертикулеза кишечника реципиенту выполнить резекцию измененного отдела кишечника.
Описан случай дивертикулита, осложненного перфорацией толстой кишки с субклиническим течением перитонита у больной после трансплантации сердца. В анализах крови выявлен лейкоцитоз, при этом при физикальном обследовании типичных признаков перитонита не было. На рентгенограмме выявлены уровни жидкости в петлях кишечника и свободный газ в брюшной полости. Больной была выполнена операция Гартмана. Авторы отмечают атипичную клиническую картину и обращают внимание на своевременность хирургического вмешательства [5]. Дивертикулит – одно из самых частых «толстокишечных» осложнений у реципиентов почечного трансплантата [6].
К причинам возникновения язвенной болезни среди пациентов, получающих лечение программным гемодиализом, кроме Helicobacter pylory относятся нарушение метаболизма на фоне уремии, гепаринизация во время проведения сеансов гемодиализа, применение медикаментозных препаратов, действующих на слизистую оболочку желудка и 12-перстной кишки, применение нестероидных противовоспалительных препаратов, а после трансплантации почки – применение стероидных препаратов.
Риск кровотечения из желудочно-кишечного тракта связан с уремия-индуцированной дисфункцией тромбоцитов, изменениями свертывающей системы крови вследствие длительного использования гепарина.
Ишемический колит обычно осложняется инфарктом кишечника, перфорацией, кровотечением и обычно заканчивается летально. При развитии абдоминальных болей, кровотечения, диареи и симптомов интраабдоминальной катастрофы немедленная ревизия брюшной полости и резекция кишки помогают спасти жизнь больного. В отдельных случаях уремическая интоксикация, бактериальная инфекция, агрессивная иммуносупрессия ведут к развитию псевдомембранозного и ишемического энтероколита. ЦМВ-инфекция и ЦМВ-васкулит могут приводить к эзофагиту, стоматиту, дуодениту и изменениям в слизистой кишечника и как следствие – к изъязвлению слизистой кишечника с перфорацией и кровотечением.
F. Catena [7] сделал анализ 1611 реципиентам почечного трансплантата. Гастроинтестинальные осложнения выявлены у 46 больных. Ишемия и перфорация толстого кишечника выявлены у 21 больного, тонкокишечная непроходимость – у 15, перфорация 12-перстной кишки и желудка – у 6 и 4 больных соответственно. Более 50% осложнений встречены у больных, получавших высокие дозы иммунодепрессантов в раннем послеоперационном периоде и в связи с кризом отторжения. Смерть 24% больных наступила в результате вышеперечисленных осложнений.
Нам не встретилось ни одной работы, описывающей случай мезентериального тромбоза у больных после трансплантации почки. Даже в общей популяции больных это одно из самых драматичных острых хирургических заболеваний сопровождается стабильно высокой летальностью.
Клиническое наблюдение. Пациент С. 1976 г.р. № 10314 поступил 16.11.2012 в хирургическое отделение трансплантологии и диализа с диагнозом «хронический гломерулоефрит, ХБП 5Д-стадии, нефрогенная гипертензия, нефрогенная анемия, хронический вирусный гепатит В, фаза интеграции (HBV DNA отрицательный), хронический вирусный гепатит С (HCV RNA отрицательный)», состояние на лечении перитонеальным диализом.
Из анамнеза известно, что пациент болен с 18 лет, когда после переохлаждения появилась протеинурия, артериальная гипертензия. С 2010 г. гипертензия приобрела злокачественный характер. Тогда же при плановом обследовании выявлена уремия: креатинин крови – 1210 мкмоль/л, мочевина крови – 36,8 ммоль/л. Гиперкалиемии нет. Диурез снижен до 1,2 л в сутки. Скорость клубочковой фильтрации – 4,3 мл/мин. Диагностированная ХБП 5-й стадии и начата заместительная почечная терапия – перитонеальный диализ. Ближайший послеоперационный период без осложнений. В отдаленном послеоперационном периоде у больного трижды развивался диализный перитонит, лечение которого проходило в амбулаторном режиме с положительной динамикой (каждый раз трижды проводились посевы перитонеального раствора на бактериальную флору и грибы, после завершения курса лечения посевы стерильны). В связи с истощением транспортных свойств брюшины и неадекватностью перитонеального диализа (уремия) больному сформирована артериовенозная фистула и больной переведен на лечение программным гемодиализом.
16.11.2012 выполнена трансплантация почки. Донор: мужчина 47 лет, причиной смерти которого была закрытая черепно-мозговая травма. Изъятие почек выполнено после диагностики смерти головного мозга. Время холодовой консервации составило 7 часов. Почка подходила реципиенту по группе крови, резус-фактору и трем антигенам системы HLA (А2, B35, DR6). Перед операцией выполнена индукция иммуносупрессии базиликсимабом 20 мг в/в капельно, больной получил такролимус в дозе 0,1 мг/кг и 1,5 г микофенолат мофетала. Интраоперационно введен метилпреднизолон в дозе 500 мг в/в капельно. В послеоперационном периоде вводился базиликсимаб в дозе 20 мг в/в капельно и метилпреднизолон в дозе 250 мг в/в капельно на первые и седьмые сутки. В послеоперационном периоде назначена трехкомпонентная иммуносупрессия: такролимус – 0,1 мг/кг/сут, мофетила микофенолат – 1,5 г/сут, преднизолон – 20 мг/сут. У больного отмечена хорошая начальная функция трансплантата: на треть в сутки креатинин крови снизился до 90 мкмоль/л, мочевина крови – до 11 ммоль/л, диурез – до 2,5 л в сутки, скорость клубочковой фильтрации – 65,4 мл/мин. Через 5 суток после трансплантации с целью индукции толерантности к трансплантату проведены сеансы клеточной трансиммунизации (экстракорпоральная фотохимиотерапия [1, 5]). Через 20 суток после трансплантации почки выявлено лимфоцеле в области нижнего полюса трансплантированной почки. 06.12.2012 выполнено лапароскопическое дренирование лимфоцеле (для постоянного сообщения брюшной полости и забрюшинного пространства и сохранения пассажа лимфы в сформированный дефект брюшины установлен «потерянный» дренаж) – послеоперационный период без осложнений. 12.12.2012 произведено разобщение артериовенозной фистулы. Больной в удовлетворительном состоянии выписан домой. При выписке креатинин крови – 80 мкмоль/л, мочевина крови – 10,2 ммоль/л, скорость клубочковой фильтрации – 64,5 мл/мин, реабсорбция – 97,2%; биохимический анализ крови: альбумин – 35,3 г/л, общий белок – 65,1 г/л, щелочная фосфатаза – 50 ЕД/л, АЛТ – 3 ЕД/л, АСТ – 12,3 ЕД/л, общий биллирубин – 6,3 ммоль/л. Коагулограмма: АЧТВ – 22,6 с, протромбиновая активность по Квику (IL) – 100%, МНО – 0,98, тромбиновое время – 21,8 с, фибриноген – 3,13 г/л.
Иммуносупрессия: такролимус – 7,5 мг/сут, микофенолат мофетил – 1000 мг/сут, преднизолон – 15 мг/сут.
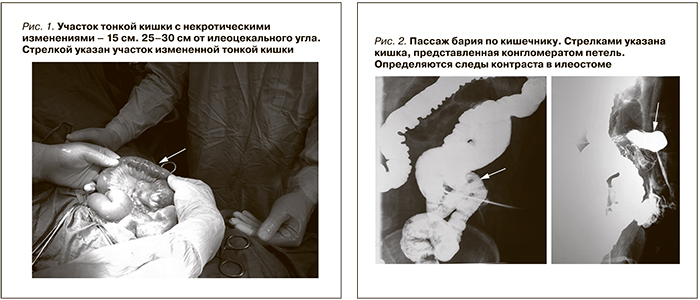
19.12.2012 у больного появились жалобы на боли в животе разлитого характера, по поводу которых принимал спазмолитики – без значительного эффекта. 21.12.2012 поступил в экстренном порядке с жалобами на постоянные боли в левых отделах живота. При осмотре отмечались болезненность левых отделов живота, слабовыраженный дефанс мышц передней брюшной стенки, симптом раздражения брюшины сомнительный. Рвоты не было. Однократный в течение двух дней стул нормального цвета со склонностью к послаблению. На обзорной рентгенограмме органов брюшной полости свободного газа в брюшной полости не определяется, единичные уровни жидкости в нерезко дилятированнных петлях кишечника. При ультразвуковом исследовании трансплантата патологии нет. Лейкоциты крови – 9х109/л, гемоглобин – 109 г/л, креатинин крови – 110 мкмоль/л, мочевина крови – 13 ммоль/л. При наблюдении в течение 12 часов у больного не отмечено значимой динамики показателей крови. Тем не менее отмечена выраженная отрицательная локальная динамика: усиление симптоматики «острого живота». С учетом наличия сообщения забрюшинного ложа трансплантата и брюшной полости (в результате внутреннего дренирования лимфоцеле) можно было предполагать наличие мочевого затека. Также от больного можно было ожидать неспецифического острого хирургического заболевания органов брюшной полости: дивертикулит, странгуляция кишечника, мезентериальный тромбоз и др. С учетом отрицательной динамики решено выполнить диагностическую лапаротомию. В отсутствие патологии со стороны органов брюшной полости в качестве второго этапа – ревизию трансплантата.
22.12.2012 выполнена диагностическая лапаротомия. В брюшной полости масса мутного выпота (до 1000,0 мл) с небольшим количеством фибрина с неприятным запахом. Спаечного процесса нет. К передней брюшной стенке прилежит участок тонкой кишки с признаками некроза грязно-серого, местами черного цвета с наложениями фибрина, не перестальтирует. Пульсация сосудов брыжейки не определяется. Некротические изменения прослеживаются на протяжении 15 см (25–30 см от илеоцекального угла), далее реактивные изменения брюшины, гиперемии, фибрина нет, перистальтика в норме (рис. 1). Ситуация расценена как мезентериальный тромбоз. Трансплантат определяется забрюшинно, в подвздошной области без патологических признаков. Выполнена резекция тонкой кишки (некротизированный участок +20 см макроскопически неизмененной кишки), илеостомия, дренирование брюшной полости. Проведена имуносупрессивная, антибактериальная, противовоспалительная, спазмолитическая, антикоагулянтная, антифунгальная, инфузионная терапия.
В связи с наличием перитонита проведена сорбция эндотоксина. Послеоперационный период протекал без осложнений. Однако 05.01.2013 вновь жалобы на боли в брюшной полости, положительные симптомы раздражения брюшины. На обзорном снимке брюшной полости – картина тонкокишечной непроходимости (появление массы тонкокишечных арок с уровнями жидкости). Консервативная терапия без эффекта, в связи с чем 06.01.2013 выполнена релапаротомия. Дигностирован разлитой фибринозно-гнойный перитонит. В брюшной полости имеется небольшое количество мутного выпота с неприятным запахом. Тонкая кишка илеостомы и на 80 см проксимальнее синюшного цвета инъецирована сосудами темного цвета, не перестальтирует. Пульсация сосудов брыжейки не определяется. Ситуация расценена как повторный мезентериальный тромбоз. Выполнена резекция тонкого кишечника с энтеростомой: некротически измененный участок +20 см макроскопически неизмененного тонкого кишечника. Проксимальный конец кишки выведен в виде стомы на переднюю брюшную стенку слева через раннее сформированное отверстие. В послеоперационном периоде в связи с опасностью гиперкоагуляции продолжена инфузионная терапия + и гепаринотерапия (5000 ЕДх4 р/д). Больной переведен на прием З или 75 мг/сут. Гистология удаленной кишки № 78/86. Во всех слоях стенки и брыжейке резецированной тонкой кишки выраженные острые расстройства кровообращения (полнокровие, стазы, тромбоз сосудов среднего и мелкого калибра, очаги некроза различной глубины, вплоть до серозы с перифокальной воспалительной реакцией). Геморрагический некроз (инфаркт) тонкой кишки.
Функция трансплантата оставалась стабильной: креатинин крови – 170 мкмоль/л, мочевина крови – 9,3 ммоль/л, скорость клубочковой фильтрации – 74 мл/мин. Калий – 4,3 ммоль/л. Гемоглобин – 109 г/л, лейкоциты – 5,6х109/л. Посев мочи – роста нет. Коагулограмма: АЧТВ – 26,70 с, протромбиновая активность по Квику (IL) – 88,0%, МНО (IL) – 1,04, тромбиновое время – 21,40 с, активность антитромбина III (IL) – 87%, фибриноген – 3,16 г/л, РФМК-тест – 4,5 мг/100 мл. При ирригоскопии патологии нет.
Течение послеоперационного периода без осложнений, больной был выписан. Постепенно у больного развилась белково-энергетическая недостаточность, кахексия вследствие синдрома «короткой тонкой кишки». Периодически больной находился на стационарном лечении, где проводилась комплексная терапия белковой недостаточности введением комплекса незаменимых аминокислот; антибактериальная терапия, противогрибковая терапия нормальным человеческим иммуноглобулином, противовирусная терапия, инфузии альбумина, гепатопротекторы; продолжено длительное введение низкомолекулярных гепаринов. Терапия с положительным эффектом.
В связи с повторным мезентериальным тромбозом для выяснения причин тромбообразования, для исключения наследственной формы тромбофилии проведено молекулярно-генетическое исследование методом ПЦР (ДНК-диагностика полиморфизмов генов системы гомеостаза) риска развития венозных тромбозов от 06.06.2014 № 217922. Полиморфизм – G 20210А гена II (протромбин) – GG (норма), Полиморфизм G 1691А гена V фактора (лейденская мутация) – GG (норма), Полиморфизм C 667Т гена MTHFR – GG (норма), Полиморфизм 4G/5G гена PAI-1–4G/5G (норма). Полиморфизм VaI34Leu гена (F13) – Val/Val (норма), D/I полиморфизм гена ангиотензинпревращающего фермента (АСЕ) – I/D (норма). Таким образом, генетических дефектов, увеличивающих риск тромбообразования, не выявлено.
После коррекции белково-энергетической недостаточности начата подготовка к оперативному восстановлению нормального пассажа по кишечнику. 05.03.2014 выполнен пассаж бария по кишечнику. Пищевод свободно проходим для контраста. Через час от начала исследования заполняются петли тощей кишки, перистальтика активная. Кишка представлена конгломератом петель. Через час следы контраста определяются в илеостоме (рис. 2).
12.03.2014. Операция: лапаротомия, закрытие илеостомы (путем наложения илеоасцендоанастомоза), аппендэктомия (в связи с признаками хронического воспаления червеобразного отростка). Грыжесечение послеоперационной вентральной грыжи с пластикой апоневроза полипропиленовой сеткой.
01.04.2014. Больной выписан домой в удовлетворительном состоянии. Креатинин крови – 0,11 мкмоль/л, мочевина крови – 8,7 ммоль/л. Гемоглобин – 116 г/л, лейкоциты –7,2х109/л. Диурез – до 2 л/сут. Пациент получает высокобелковую, высокоэнергетическую диету. Клинически выраженных функциональных расстройств кишечника нет.
У больных с почечными заболеваниями нарушение тромбообразования хорошо известно в случае нефротического синдрома [8]. Не ясно, приводит ли лечение циклоспорином или такролимусом к увеличению риска тромбоза у больных после трансплантации почки. Эти лекарства могут вызывать тромботическую микроангиопатию [9].
Одним из факторов развития тромбофилии является низкий уровень гомоцистеина. Гиперкоагуляционный статус вследствие нарушения тромбообразования развивается из многих факторов риска. В поздних исследованиях по причине мезентериальных тромбозов тромбофилический генотип индентифицирован у 75% больных острым мезентериальным тромбозом [10]. Тромбоз мезентериальных сосудов встречается у 4–10% больных с различными типами коагуляционных нарушений [11]. Другими предвесниками высокого уровня эритроцитов и тромбоцитов являются полицитемия, хроническая миеломная болезнь, пароксизмальная гемоглобинурия, цирроз печени, гепатобиллиарный рак, панкреатит [12]. Венозный и артериальный тромбоз у троих больных сочетался с наличием волчаночного антикоагулянта. Причина, почему образуется волчаночный антикоагулянт без волчаночного нефрита, неясна. Однако некоторые исследования предполагают, что эти антитела могут увеличиваться у больных, получающих лечение гемодиализом, и у больных после трансплантации почки. Исследования показывают, что антитела могут появляться у больных до трансплантации и ассоциироваться с высоким риском сосудистых тромбообразований [13]. Предполагается, что окседативный стресс во время гемодиализа может увеличивать эти антитела. Имеют значение также и время гемодиализа, наличие инфекции, вирусный гепатит C и антитела к HLA – DR7 или к HLA – DQ7 [14].
Данное наблюдение демонстрирует, что у больных после трансплантации почки, получающих комплексную иммуносупрессию, могут встречаться и неспецифические заболевания органов брюшной полости. В этом случае описанное грозное заболевание протекало с крайне скудной симптоматикой, что затруднило диагностику. Решающим показанием к оперативному вмешательству стало отсутствие точного диагноза на фоне местной отрицательной динамики. Также значительно затрудняло диагностику наличие сообщения между забрюшинным пространством и брюшной полостью после операции внутреннего дренирования лимфоцеле. В течение послеоперационного периода свою положительную роль сыграла процедура сорбции эндотоксина, что снизило интоксикацию и сопровождалось положительной динамикой. Значительное ухудшение состояния пациента наступило в результате рецидива тромбоза. Величина нежизнеспособной кишки во второй раз имела значительно большую, чем в первый, протяженность.
В результате удаления большого сегмента тонкого кишечника у больного сформировался синдром «короткой тонкой кишки», что привело к истощению пациента и осложнило течение отдаленного послеоперационного периода.
Главным залогом успешного лечения пациента в данном случае мы считаем активную хирургическую тактику.



