Введение. Известно, что метаболические нарушения, такие как сахарный диабет, ожирение и гиперурикемия, а также артериальная гипертензия увеличивают риск сердечно-сосудистой заболеваемости и ренальных поражений, оказывают неблагоприятное влияние на прогноз и определяют тактику кардио- и нефропротективной терапии [1–4]. Принято считать, что аортокоронарное шунтирование (АКШ) способствует улучшению отдаленного прогноза, снижению сердечно-сосудистой смертности среди больных с высоким кардиоваскулярным риском [5]. Необходимо учитывать степень операционного риска сердечно-сосудистых и ренальных осложнений, особенно при выполнении АКШ с применением искусственного кровообращения, которые в свою очередь влияют на ближайший и отдаленный прогнозы после операции [6, 7].
В этом плане актуально изучение частоты развития послеоперационного острого повреждения почек (ОПП) больных метаболическим синдромом (МС), подвергшихся АКШ [8, 9]. В литературе имеется достаточное количество исследований, посвященных изучению влияния различных метаболических нарушений, а также артериальной гипертензии, составляющих МС, на частоту развития ОПП и прогноз, в т.ч. у больных, подвергшихся АКШ [2, 4, 9–11]. Кроме того, результаты этих исследований противоречивы, что, возможно, объясняется исходным функциональным состоянием почек, выраженностью метаболических нарушений и т.д. [8, 12, 13]. Поэтому оценка прогностической роли МС для больных сохранной клубочковой фильтрацией, подвергшихся АКШ, представляет интерес для определения суммарного риска для кардиоренального прогноза.
С учетом широкой распространенности МС в общей популяции, а также расширения сети учреждений для оказания кардиохирургической помощи населению России важно изучение кардиоренальных взаимоотношений между больными, подвергшимися АКШ [1, 2, 13].

Целью данного исследования стало уточнение частоты развития ОПП и его влияние на ближайший прогноз для больных МС и сохранной клубочковой фильтрацией, подвергшихся АКШ.
Материал и методы
В клиническое сравнительное исследование были включены 782 больных (514 мужчин и 268 женщин) в возрасте от 54 до 67 лет (средний возраст – 62,3±4,6 года), которым в плановом порядке в Пензенском федеральном центре сердечно-сосудистой хирургии проведено АКШ с применением ИК. Из них у 513 (65,6%) больных отсутствовал комплекс диагностических критериев МС (1-я группа), хотя выявлены отдельные метаболические нарушения и/или артериальная гипертензия, и у 269 (34,4%) больных был диагностирован МС (2-я группа), согласно рекомендациям Российского кардиологического общества [1]. У больных, включенных в исследование, величина скорости клубочковой фильтрации (СКФ) была выше 60 мл/мин/1,73 м2. Величину СКФ до и после АКШ определили с помощью номограммы для расчета СКФ по формуле EPI-CKD. Исключением из исследования стали больные с первичными заболеваниями почек.
Послеоперационное ОПП диагностировали и классифицировали по уровню креатинина сыворотки крови (sCr), используя критерии AKIN [14]. Содержание sCr и величину СКФ определяли за 2–3 дня до операции, после операции ежедневно в стационаре и через 3 – после операции. Операционный риск кардиоваскулярных осложнений вычисляли по индексу EuroSCORE (European system for cardiac operative risk evaluation).
Для оценки исходов ОПП изучили динамику максимальных уровней sCr при развитии ОПП в течение 3 месяцев после АКШ. Транзиторное ОПП означало восстановление нормальных дооперационных уровней sCr в течение 4 недель [6, 14]. Для больных, перенесших ОПП, манифестация ХБП предполагала сохранение величины СКФ ниже 60 мл/мин/1,73 м2 в течение 3 месяцев и более, что в свою очередь свидетельствовало о персистирующем течении ОПП.

Исследование было выполнено в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинкской декларации Всемирной медицинской ассоциации. Протокол исследования был одобрен Этическим комитетом института. До включения в исследование больные подписывали письменное информированное согласие.
Количественная обработка результатов исследования проведена с помощью описательной статистики и с использованием пакета программ STATISTICA 6.0. Нормальность распределения переменных определена по тесту Колмогорова–Смирнова. При нормальном распределении для сравнения средних величин использовали t-критерий Стьюдента. Качественные переменные сравнивали с помощью непараметрического χ2 критерия с поправкой Йетса. Связи между ординальными переменными определяли с помощью ранговой корреляции Спирмена (R). Данные были представлены в виде M±SD. Различия считались достоверными при р<0,05.
Результаты
Сравнение исходных клинико-инструментальных данных в группах показало, что во 2-й группе по сравнению с 1-й преобладали перенесенный инсульт, хроническая сердечная недостаточность (ХСН) II–III функциональных классов (ФК), фибрилляция предсердий (пароксизмальная или постоянная) и метаболические нарушения (табл. 1). Показатели СКФ и sCr в группах различались недостоверно. Индекс EuroSCORE во 2-й группе оказался достоверно выше, чем в 1-й.
С учетом максимальных показателей sCr в ранний послеоперационный период ОПП диагностировали в 1-й группе у 123 (24,0%) больных и во 2-й – у 94 (34,9%). В результате в обеих группах было выделено две подгруппы – больных с ОПП и без него.

Сравнение частоты послеоперационного ОПП в зависимости от величины ИМТ показало (табл. 2), что в 1-й группе больных ОПП нормальная масса тела выявлялась реже, чем у больных без ОПП (20,3 против 53,1%; p<0,001). Частота избыточной массы тела в обеих группах больных ОПП была достоверно чаще, чем у больных без него.
Следует отметить, что в обеих группах больных ОПП по сравнению с таковыми без него выявляемость ожирения всех степеней была достоверно выше. Так, показано, что если в 1-й группе наиболее выраженное различие между больными ОПП и без него выявлено при ожирении III степени (p=0,006), то во 2-й группе это отмечено при ожирении I степени (p=0,003). Это означает, что в 1-й группе ОПП имела прямую и сильную корреляцию с ожирением III степени (R=0,105; p=0,017), а во 2-й – с ожирением I степени (R=0,157; p=0,01). Необходимо отметить, что между группами различия частоты ожирения независимо от развития ОПП не выявлено (p>0,05). Также показано, что у больных без ОПП 1-й группы удельный вес ожирения I степени составил 69,4%, во 2-й – 62,2%, III степени – 6,5 и 10,8% соответственно. Среди больных с ОПП удельный вес ожирения I степени в 1-й группе составил 56,8%, во 2-й – 52,9% и III степени – 15,9 и 17,6% соответственно.
Выявлено, что в обеих группах развитие послеоперационного ОПП ассоциировалось с достоверным увеличением частоты ранних сердечно-сосудистых осложнений (табл. 3). Так, показано, что во 2-й группе у больных без ОПП по сравнению с 1-й группой достоверно чаще диагностировался острый коронарный синдром и/или инфаркт миокарда (p=0,015), инсульт или транзиторная ишемическая атака (p=0,006), желудочковая эктопия высоких градаций (p=0,012) и пароксизмальные наджелудочковые тахикардии (p=0,021).
В обеих группах больных ОПП содержание sСr было достоверно выше, а величина СКФ ниже, чем у больных, не имевших ОПП. При этом во 2-й группе по сравнению с 1-й показатели sCr были достоверно выше (p=0,007), а величины СКФ достоверно ниже (p=0,013). Сеансы гемодиализа у больных острой почечной недостаточностью (3-я стадия ОПП по AKIN) в 1-й группе проводили в 4,9%, во 2-й – в 14,9% случаев (χ2=5,25; p=0,022). Внутрибольничная летальность составила от 2,1% до 14,9% и была выше у больных ОПП по сравнению с больными без ОПП, а также во 2-й группе выше, чем в 1-й.
Сравнительный анализ метаболических показателей в зависимости от развития ОПП показал, что в обеих группах больных послеоперационным ОПП величина ИМТ, систолическое АД, уровни общего холестерина и его фракций, а также содержание мочевой кислоты были достоверно выше, чем у больных без ОПП. Кроме того, большинство показателей МС во 2-й группе по сравнению с 1-й были достоверно выше как у больных с ОПП, так и без него.
Для оценки ближайшего прогноза после АКШ сравнивали тяжесть (стадии) и продолжительность (обратимость) ОПП (рис. 1). Выявлено, что в 1-й группе достоверно чаще диагностировались I стадия и транзиторное ОПП, а во 2-й – III стадия и персистирующее ОПП с манифестацией в дальнейшем хронической болезни почек (ХБП). Так, в 1-й группе развитие ХБП у больных, перенесших ОПП, отмечено в 6,7% случаев, во 2-й – в 19,2%: χ2=6,92 (p=0,009). Сроки пребывания больных в стационаре и внутрибольничная летальность были достоверно выше у больных 2-й группы и при III стадии ОПП.

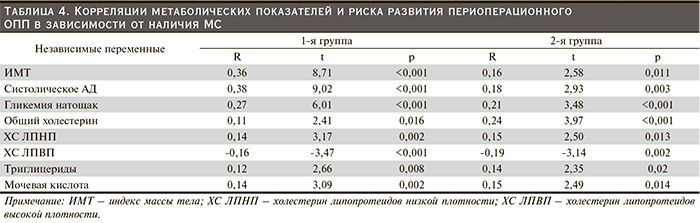
С помощью однофакторной корреляции выявлено, что в 1-й группе по сравнению со 2-й связи компонентов МС и частоты развития ОПП выражены сильнее (табл. 4). Кроме того, в 1-й группе развитие ОПП сильнее коррелирует с показателями ИМТ, гипергликемии натощак и систолического АД, что подчеркивает выраженную провоцирующую роль ожирения, сахарного диабета и артериальной гипертензии. Также показано, что гиперурикемия является важным предиктором развития послеоперационного ОПП в обеих группах. Относительно слабая корреляция отдельных метаболических нарушений с развитием ОПП в 2-й группе, вероятно, объясняется их кумулятивным эффектом в рамках МС.
Проведенное исследование свидетельствует о том, что наличие МС сопровождается высокой частотой развития ОПП и неблагоприятным ближайшим прогнозом для больных, подвергшихся АКШ. Кроме того, тяжесть (стадия) и течение ОПП прямо коррелируют с выраженностью метаболических нарушений, особенно у больных, имеющих МС.
Обсуждение
Нами МС у больных, подвергшихся АКШ, был выявлен в 34,4% случаев и при этом 3-я стадия ОПП (по AKIN), соответствующая острой почечной недостаточности, диагностирована в 16,0% случаев. Показано, что наличие МС ассоциируется с достоверным увеличением частоты развития послеоперационного ОПП и ухудшением госпитального прогноза по сравнению с больными, не имевшими МС.
Необходимо отметить, что в литературе имеется достаточное количество исследований, посвященных оценке отдельных метаболических нарушений, особенно абдоминального ожирения, артериальной гипертензии и сахарного диабета. Однако оценка прогностического значения МС в отношении ОПП для больных, подвергшихся АКШ, проводилась недостаточно. Расхождение в оценках прогностической роли МС у больных, подвергшихся АКШ, возможно, объясняется различными вариантами МС, исходным функциональным состоянием почек и эффективностью корригирующей терапии [8, 12, 13].
Нами показано, что абдоминальное ожирение (АО) как основной диагностический критерий МС имеет наиболее сильную связь с развитием послеоперационного ОПП, в т.ч. для больных, не имевших МС. Это подтверждается наличием достоверной прямой корреляции ИМТ с вероятностью развития ОПП. Кроме того, у больных ОПП величина ИМТ во 2-й группе достоверно выше, чем в 1-й.
В исследовании, проведенном K. Kajimoto et al. [2], МС выявлен у 46,6% больных, подвергшихся АКШ, из них у 3,8% возникла острая почечная недостаточность. Более низкая частота острой почечной недостаточности по сравнению с нашими результатами (3,8 против 16,0%), вероятно, объясняется проведением АКШ без применения искусственного кровообращения. Авторами также выявлено, что наличие МС связано с увеличением относительного риска развития острой почечной недостаточности в ранний период после АКШ в 2,47 раза.
Следует также отметить, что у больных МС нередко выявляется нарушение пуринового обмена – гиперурикемия, которая является фактором риска развития ОПП [4, 10]. Нами показано, что содержание мочевой кислоты в крови больных ОПП во 2-й группе было достоверно выше, чем в 1-й. Кроме того, содержание мочевой кислоты в крови больных ОПП и без него достоверно различалось в 1-й группе. A.A. Ejaz et al. [10] показано, что превентивная урикозурическая терапия больных гиперурикемией уменьшает риск развития ОПП после кардиохирургических вмешательств.
Заключение
Таким образом, наличие МС даже при сохранной клубочковой функции увеличивает частоту развития ОПП после АКШ, ассоциируется с высокой частотой ранних сердечно-сосудистых осложнений и острой почечной недостаточности, а также высокой внутрибольничной смертностью. Это объясняется тем, что больные МС имеют повышенный операционный риск кардиоваскулярных и ренальных осложнений, что подтверждается высоким индексом EuroSCORE. Кроме того, у больных с величиной СКФ выше 60 мл/мин/1,73 м2, перенесших послеоперационное ОПП, наличие МС увеличивает вероятность развития ХБП и потребность в проведении программного гемодиализа. Установлено, что частота развития ОПП после операции АКШ, выраженность дисфункции почек и ее исходы коррелируют с наличием ожирения с различным индексом массы тела. Гиперурикемия является дополнительным метаболическим фактором, провоцирующим развитие ОПП как при наличии МС, так и в его отсутствие.



