В настоящее время чрескожная пункционная биопсия аллотрансплантированных почек стала рутинным диагностическим методом и является «золотым» стандартом оценки структурных изменений трансплантированной почки. Термин «биопсия» был введен в медицинскую терминологию в 1879 г. Эрнестом Бенье. В России в 1875 г. М.М. Руднев провел первую диагностическую биопсию [1, 2]. Пункционная биопсия является инвазивным методом исследования и не лишена риска развития осложнений, возможность которых должна быть тщательно взвешена. Оценка потенциального риска и преимущества биопсии должна предшествовать принятию решения о необходимости ее проведения.
Общепринятым считается, что верификация повреждения трансплантата и выявление его доминирующего патогенетического механизма, выбор лечения в настоящее время возможны только методами прижизненной морфологической диагностики и не могут быть правомочны без подтверждения результатами гистологического исследования биоптата трансплантированной почки. При наличии разнообразных методов исследования только гистологическая картина нефротрансплантата позволяет объективно диагностировать патологию, контролировать эффективность терапии и в определенной мере прогнозировать функциональное состояние органа.
Как всякий инвазивный метод, пункционная биопсия аллотрансплантата сопряжена с риском развития осложнений. Транзиторная микрогематурия после биопсии трансплантата наблюдается достаточно часто и не имеет большого клинического значения. Как правило, ее удается остановить консервативными методами. Макрогематурия фиксируется в 1–3% случаев и может закончиться трансплантатэктомией или даже летально. Описан случай острой почечной недостаточности после выполнения биопсии нефротрансплантата [3].
С.А. Шутов сообщил о развитии геморрагического осложнения после биопсии трансплантата у больного хроническим диффузным гломерулонефритом. Потеря крови составила 3000.
У больного развились геморрагический шок, гипокоагуляция, которую удалось корригировать введением рекомбинантного активированного VII фактора свертывания. Кровотечение было остановлено. Снижение гемоглобина с 70 до 41 г/л.
 В дальнейшем трансплантат был удален [4].
В дальнейшем трансплантат был удален [4].
Нами не было найдено описания массивного кровотечения и тактики лечения после биопсии нефротрансплантата у больной гранулематозом Вегенера.
Клиническое наблюдение. Больная В. 17 лет, № 21667, пост. 15.09.2014 для проведения биопсии трансплантата по поводу трансплантационной нефропатии трансплантата.
Наблюдалась в отделении гемодиализа ГКБ им. Святого Владимира с 06.02.2009. Диагностированы системный васкулит, гранулематоз Вегенера. С марта 2009 г. программный гемодиализ. 24.11.2009 сформирована А-В фистула. С 14.09.2011. по 19.07.2011 находилась в отделении трансплантации РДКБ.
С 14.01.2011 длительный кашель. 26.01.2011 рентгенологически подтверждено поражение легких, характерное для гранулематоза Вегенера. Состояние расценено как активная фаза системного васкулита. Серологически – положительный тест ANSA-combi. Проведена терапия солю-медролом 500, Эндоксаном 600, уромитексаном 1600, преднизолоном 40 с последующим снижением, вальцитом. На фоне терапии состояние больной стабилизировалось.
19.04.2011 выполнена аллотрансплантация трупной почки. Совпадение по групповой совместимости и 3 лейкоцитарным АГ. Отсроченная функция трансплантата. Проведено три сеанса гемодиализа. Назначено АТГ 100 № 5, солумедрол 1,0. Со 2-х суток – програф 6 мг, с 6-х – майфортик 720 мг/сут, вальцит с целью профилактики ЦМВ. На 13-е сутки снижение уровня креатинина крови до 155 мкмоль/л. На 22-е сутки мочевой затек в области нижнего полюса трансплантата. Установлен мочевой катетер. На 46-е сутки рост азотемии. Диагностировано острое отторжение трансплантата. Проводилась пульс-терапия медролом 2,5 г/сут за 6 суток. Криз купирован. 19.07.2011 вписана с удовлетворительной функцией трансплантата.
13.01.2013–31.01.213 повышение уровня азотемии (креатинин крови до 180 мкмоль/л, мочевина крови до 13 ммоль/л), протеинурия 150 мг/сут. Выполнена биопсия почки: острое клеточное отторжение трансплантата (Banff 1a) и хроническая васкулопатия ХТН 3-й ст. Умеренное замедление кровотока в трансплантате. RI – 0,89, СКФ – 35 мл/мин. Проведена пульс-терапия солумедролом, суммарная доза – 2,5 г. Креатинин крови снижен до 98 мкмоль/л, мочевина крови – до 9,9 ммоль/л. RI – 0,73. Выписана на амбулаторное лечение с удовлетворительной функцией трансплантата.
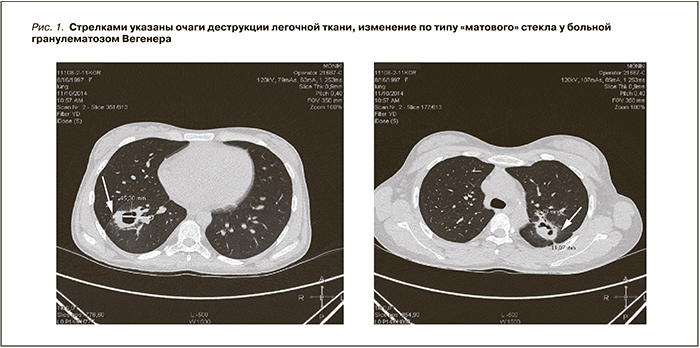
С 17.09.2014 респираторное заболевание. Назначен цефотоксим без значительного эффекта. При Ro легких диагностирована 2-сторонняя бисегментарная пневмония (S10 справа и S4, S2 слева) с признаками абсцедирования справа. При МРТ легких: справа в 8-м сегменте воздушная полость неправильной формы с изменениями прилежащих тканей по типу консолидации и «матового» стекла с формированием в этом образовании мелких воздушных полостей. Признаки деструкции легочной ткани. Слева во 2-м и 6-м сегментах сливной очаг консолидации легочной ткани с мелкими воздушными полостями. Общий размер очага – 36х30х29 мм. В процесс вовлечена прилежащая междольковая и висцеральная плевра (рис. 1).
С октября 2014 г. умеренное ухудшение функции трансплантата. Креатинин крови до 0,23 ммоль/л. Мочевина крови до 20,4 ммоль/л. Госпитализирована в отделение для выполнения биопсии трансплантата и оптимизации назначения иммуносупрессивной терапии. Больная получает 3-компонентную иммуносупрессию: програф, майфортик, преднизолон.
Общий анализ крови от 24.10.2014. HGb – 117 г/л, RBC – 4,67 ЕД/л, HCT – 0,37, трмбоциты – 129,0. WBC – 4,1. Биохимия крови от 24.10.2014. Билирубин прямой – 1,5 мкмоль/л, холестерин общий – 5,8 ммоль/л, общий белок – 76 г/л, альбумин – 43 г/л, щелочная фосфатаза 78 ЕД/л. Коагулограмма: АЧТВ – 31,1 с, протромбиновое время – 10,6 с, протромбиновая активность по Квику (IL) – 117%, МНО (IL) – 0,92, тромбиновое время – 26,6 с, фибриноген – 3,63 г/л, Д-димеры – 0,09 мкг/мл.
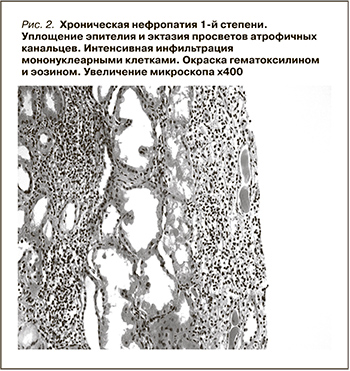
 28.10.2014 выполнена пункционная биопсия трансплантата. По данным гистологического исследования биоптата пересаженной почки, при световой микроскопии диффузно-очаговый склероз интерстиция и атрофия канальцев, занимающие около 15–20% почечной паренхимы. Очаговая интерстициальная инфильтрация лимфоцитами в зонах склероза без явлений тубулита. Артерии – незначительный артериосклероз. Артериолы – имеются несколько профилей артериол и артерий малого калибра с инсудативными изменениями по типу субэндотелиального и нодулярного артериологиалиноза. Иммунофлюоресценция: IgG – нет, IgA – нет, IgM – нет, C3 – нет, C4d – негативно. Диагностирована хроническая нефротоксичность ингибиторов кальцийневрина. ХТН 1-й ст. (рис.2).
28.10.2014 выполнена пункционная биопсия трансплантата. По данным гистологического исследования биоптата пересаженной почки, при световой микроскопии диффузно-очаговый склероз интерстиция и атрофия канальцев, занимающие около 15–20% почечной паренхимы. Очаговая интерстициальная инфильтрация лимфоцитами в зонах склероза без явлений тубулита. Артерии – незначительный артериосклероз. Артериолы – имеются несколько профилей артериол и артерий малого калибра с инсудативными изменениями по типу субэндотелиального и нодулярного артериологиалиноза. Иммунофлюоресценция: IgG – нет, IgA – нет, IgM – нет, C3 – нет, C4d – негативно. Диагностирована хроническая нефротоксичность ингибиторов кальцийневрина. ХТН 1-й ст. (рис.2).
Клиническое наблюдение. Под местной анестезией S. Novocaini 0,5% 20,0 под контролем УЗИ (Philips i-22, датчиком С8-5) выполнена транскутанная толстоигольная (игла G16) биопсия нефротрансплантата. Биоптат взят из трех точек в среднем сегменте трансплантированной почки. После биопсии выполнено тугое прижатие места пункции поверх асептической повязки.
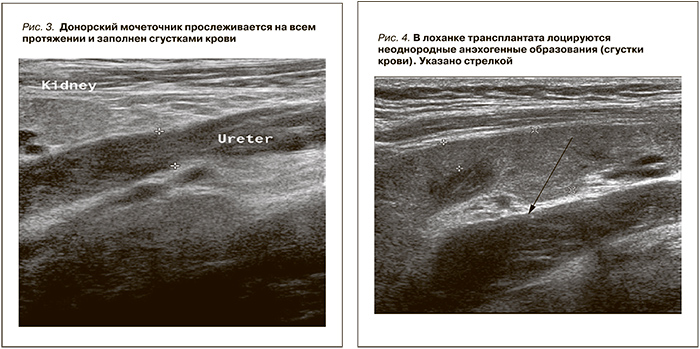
Послеоперационный период осложнился кровотечением из места пункции трансплантата в чашечно-лоханочную систему с тампонадой мочевого пузыря. По данным УЗИ, в паранефральной зоне трансплантата патологических образований не выявлено. Нефротрансплантат средней эхогенности бобовидной формы с четкими ровными краями размером 116х57х31 мм. Толщина паренхимы – 18 мм. Чашечно-лоханочная система расширена до 30х54 мм. Расширенный донорский мочеточник до 10–13 мм прослеживается на всем протяжении до мочевого пузыря, сгустками крови заполнены лоханка и донорский мочеточник (рис. 3, 4).
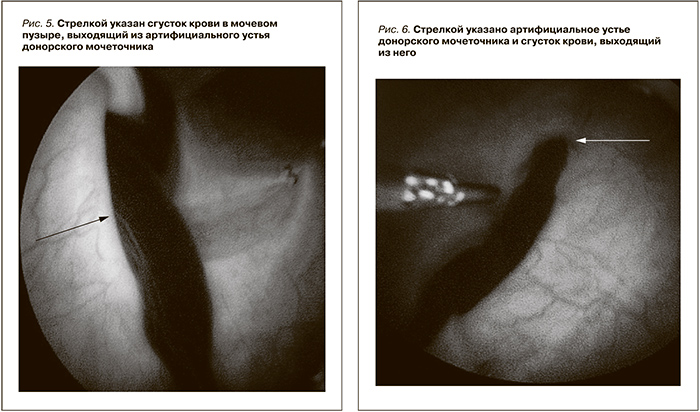
В лоханке, мочеточнике и мочевом пузыре определяются включения смешанной эхогенности без акустических теней (сгустки крови). У больной анурия. 29.10.2014 отмечено повышение креатинина крови с 0,13 до 0,4 ммоль/л. Снижение HGb c 113 до 64 г/л. 29.10.2014 выполнена катетеризация мочевого пузыря. Мочи нет. Произведено отмывание мочевого пузыря от сгустков крови. Выполнена цистоскопия. При цистоскопии визуализируется кровяной сгусток крови, который свисает в мочевой пузырь из артифициального устья донорского мочеточника (рис. 5, 6).
Фрагмент сгустка крови удален. Однако полностью удалить сгусток крови из устья мочеточника не удалось. Мочи нет. Выполнить антеградную катетеризацию из-за непреодолимого препятствия в области устья донорского мочеточника не представляется возможным. Принято решение о чрескожной нефростомии лоханки донорской почки при явлениях сохраняющейся тампонады верхних мочевых путей. Установлен нефростомический стент № 10 по Шарьеру в верхнюю чашечку лоханки. Отмечено активное выделение мочи с примесью крови по нефростомическому дренажу. После установки нефростомы за сутки выделилось до 1500 мл мочи с большой примесью крови по нефростоме и 800 мл самостоятельно.
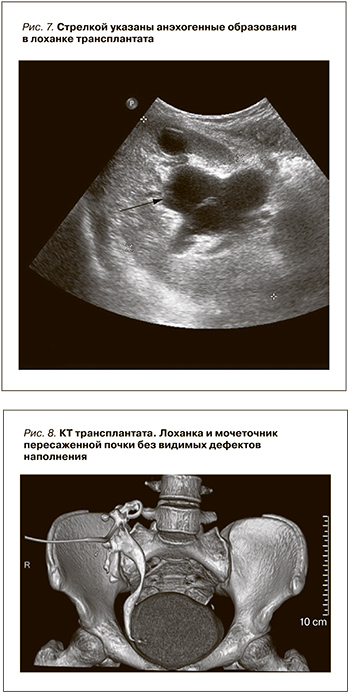
В течение 3 суток после биопсии выделение мочи по нефростоме и самостоятельно сохраняется. Однако при УЗИ трансплантата сохраняется расширение чашечно-лоханочной системы и донорского мочеточника. Визуализируются анэхогенные образования в их просвете (рис. 7).
 Несмотря на это, при пережатии нефростомы самостоятельное мочеиспускание свободное. Макрогематурия. В дальнейшем в течение 2 суток выполнено отмывание мочевого пузыря по уретральному катетеру и лоханки по нефростоме от сгустков крови. Количество мочи сохранялось на уровне 2,0–2,5 литров. Для решения вопроса о наличии сгустков крови в ч-л системе и мочеточнике 02.11.2014 выполнено КТ нефротрансплантата. Антеградно по нефростоме введено S. Verographini 10 мл.
Несмотря на это, при пережатии нефростомы самостоятельное мочеиспускание свободное. Макрогематурия. В дальнейшем в течение 2 суток выполнено отмывание мочевого пузыря по уретральному катетеру и лоханки по нефростоме от сгустков крови. Количество мочи сохранялось на уровне 2,0–2,5 литров. Для решения вопроса о наличии сгустков крови в ч-л системе и мочеточнике 02.11.2014 выполнено КТ нефротрансплантата. Антеградно по нефростоме введено S. Verographini 10 мл.
Контраст свободно проходит по мочеточнику в мочевой пузырь. Лоханка заполнена контрастом. Видимых дефектов при контрастировании лоханки и мочеточника нет (рис. 8).
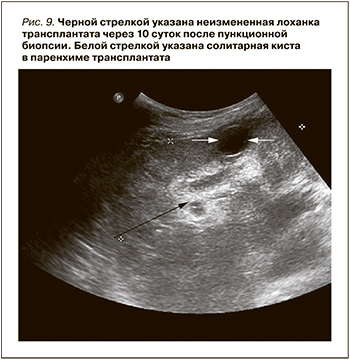
Нефростомический дренаж удален. Перелито 200 мл отмытых эритроцитов. СЗП – 450,0, назначены этамзилат Na, викасол. HGb увеличился с 63 до 95 г/л. Через 5 суток после биопсии трансплантата макрогематурия прекратилась. Сохраняется микрогематурия. При УЗИ трансплантата лоханка почки не расширена и не деформирована (рис. 9).
Коагулограмма от 05.11.2014. АЧТВ – 27,2 с, протромбиновое время – 10 с, протромбиновая активность по Квику – 129%, МНО – 0,89, тромбиновое время – 26,3 с, фибриноген – 4,2 г/л.
Д-димеры – 0,25 мкг/мл. Время свертываемости крови – 2,4 минуты, время кровотечения – 3,7 с.
12.11.2014. HGd – 109 г/л. RBC – 4,05 ЕД/л, HCT – 0,36. Тромбоциты – 137х109, WBC – 5,8х109. В моче: 2–4 эритроцита в п/з. Состояние больной значительно улучшилось. Микрогематурии нет. Получает преднизолон 20; такролимус 8; майфортик 360. Продолжает лечение.
В большинстве зарубежных трансплантационных центров пункционная биопсия аллотрансплантированных почек является рутинной процедурой, которая выполняется в соответствии с протоколом и при возникновении необходимости уточнения клинического диагноза.
Значительное количество осложнений после пункционной биопсии у 90% больных возникает за первые 24 часа после процедуры. 6–7% требуют серьезного лечения – переливания крови, ревизии почки [5]. По данным литературы, макрогематурию после пункционной биопсии нефротрансплантата наблюдают до 3% случаев [6]. Описаны случаи образования артериовенозных фистул, которые обнаруживаются при помощи допплерографии. В дальнейшем артериовенозные фистулы могут трансформироваться в псевдоаневризмы, которые протекают бессимптомно и иногда с гематурией. Лечение образовавшейся псевдоанерзмы возможно при помощи чрескожной эмболизации [7]. Микрогематурия – обычное явление после пункционной биопсии нефротрансплантата. Связана с механическим повреждением пункционной иглой канальцев ряда нефронов и не оказывает отрицательного воздействия на функцию пересаженной почки в целом. Макрогематурия развивается при повреждении пункционной иглой сосудов форникального аппарата почечных чашечек. В.В. Тырин описывает показания к ревизии нефротрансплантата в связи с макрогематурией у 4 (0,23%) больных из 1700 выполненных нефробиопсий. Троим больным трансплантат был удален, одному функцию почки удалось восстановить [8]. Мichael проанализировал осложнения после биопсии трансплантата в зависимости от толщины пункционной иглы. Сравнивали иглы толщиной 14G, 16G, 18G. Количество и характер осложнений были примерно одинаковыми. Авторы не нашли подтверждений тому, что более толстая биопсийная игла ассоциируется с более высоким процентом осложнений. Однако при использовании иглы 14G больные жаловались на более сильные болевые ощущения после пункции трансплантата, чем при использовании игл толщиной 16G и 18G [9]. P.R. Millard рекомендует, что в случае развития неконтролируемой макрогематурии с резким падением гемоглобина, тампонадой лоханки и мочевых путей необходимо выполнение трансплантатэктомии [10].
У нашей больной массивная макрогематурия привела к падению гемоглобина с 116 до 63 г/л. В случае неудачи установки нефростомы и продолжающейся гематурии больной показана ревизия трансплантированной почки, ушивание дефекта трансплантата и возможная пиелотомия для удаления сгустков крови. При невозможности остановки кровотечения даже при вышеописанных манипуляциях было бы показано удаление трансплантата для спасения жизни больной.
Как правило, для проведения биопсии нефротрансплантата используют верхний или нижний полюс в зависимости от их расположения. Однако пункция нижнего полюса почки опасна тем, что в этом случае можно травмировать артерию, кровоснабжающую мочеточник трансплантата. Это приведет к некрозу мочеточника и как следствие – к мочевому затеку. У данной больной инцидент макрогематурии произошел после пункции трансплантата в область среднего сегмента. По-видимому, произошла перфорация форникального сосуда среднего калибра в трансплантате. Особенность пункции в области среднего калибра состоит в том, что легко полностью пройти мозговой и кортикальный слои трансплантата и перфорировать чашечку почки. В этом случае кровь из травмированной артерии будет поступать через чашечку в лоханку. Наружным прижатием в этом случае остановить кровотечение не удастся, т.к. имеется сквозное биопсийное ранение трансплантата. При биопсии почки в толщу области верхнего сегмента опасность перфорации чашечки значительно снижена. И в случае травмы артерии мелкого или среднего калибра возможность остановки кровотечения значительно возрастает, т.к. перфорация чашечки верхнего сегмента маловероятна. В этом случае возможно наружное прижатие места пункции. При использовании автоматических игл необходимо слегка подтянуть иглу перед взятием образца во избежание избыточной глубины проникновения в почку и ранения сосуда. Наличие у больной гранулематоза Вегенера предполагает наличие некротических изменений сосудистой стенки, который еще более предрасполагает к продолжительному кровотечению в случае ранения сосуда, несмотря на проведение комплекса гемостатической терапии. Поэтому при проведении нефробиопсии необходимо учитывать основное заболевание и быть крайне осторожным при васкулитах, ассоциированных с антителами к цитоплазме нейтрофилов, что ведет к патологии сосудов почки.
Главная цель любой биопсии – не только изъятие адекватного биопсийного материала, но и недопущение развития постбиопсийных осложнений. Инцидент осложнений можно избежать или значительно уменьшить, выполняя биопсию трансплантата под контролем УЗИ.



