Введение
Традиционно тромбоциты (Тц) рассматриваются как элементы сосудисто-тромбоцитарного звена гемостаза [1]. Однако в последние годы акцент исследований перенесен на выяснение участия Тц в развитии воспаления, поскольку индукция воспаления обеспечивается взаимодействием эндотелия сосудов, тромбоцитов и лейкоцитов [2, 3]. Одним из механизмов такого взаимодействия считается секреция активированными Тц медиаторов (АДФ, ТхА2, серотонина и др.), которые могут изменять (усиливать или ослаблять) функцию лейкоцитов [4]. Остаются не выясненными механизмы стимуляции самих тромбоцитов при хроническом воспалении, прежде всего роль в этом процессе нейтрофилов, которые секретируют мощный медиатор воспаления – ФАТ (фактор активации тромбоцитов). По-прежнему мало изучена роль гуморальных регуляторов, в частности адреналина, в модуляции функциональной активности Тц, хотя адреналин рассматривается как ко-активатор многих агонистов [5]. Исследование роли адреналина в стимуляции Тц при ХОПН приобретает особое значение, учитывая особенности патогенеза заболевания, для которого характерно латентное течение хронического воспаления (фаза ремиссии) на фоне активации симпатоадреналовой системы. Последнее обусловлено наличием конкремента в лоханке или/и мочеточнике, что периодически провоцирует обструкцию мочевыводящих путей. Можно предположить, что повышение уровня циркулирующих катехоламинов в крови, а также продукции ФАТ и АДФ в процессе нейтрофил-тромбоцитарных отношений изменяет функциональное состояние Тц, что оказывает влияние на развитие осложнений нефролитиаза.
Проведение консервативной терапии, включившей нестероидные противовоспалительные препараты (НПВП) и антибиотики, для устранения или профилактики воспаления при хроническом обструктивном пиелонефрите (ХОПН), направлено прежде всего на подавление функциональной активности лейкоцитов (нейтрофилов, моноцитов и лимфоцитов) и ограничение контаминации мочевыводящих путей [6]. Как при этом меняется статус Тц и влияет ли этот фактор на прогрессирование ХОПН – это те вопросы, которые требуют ответа. Вероятно, в случае ингибирования циклооксигеназы (ЦОГ-1) и снижения содержания тромбоксана А2 (ТхА2) может снижаться проагрегантный статус Тц и нарушаться их модулирующее влияние на лейкоциты. Данная гипотеза приобретает особую актуальность, поскольку отсутствует понимание молекулярных механизмов рецидива ХОПН и индивидуальной выраженности гематурии у пациентов с нефролитиазом.
Цель исследования – оценить реактивность тромбоцитов и установить роль адреналина в инициации острой воспалительной реакции и выраженности гематурии у пациентов с хроническим обструктивным пиелонефритом.
Материал и методы
В исследование включены 42 пациента с хроническим обструктивным пиелонефритом, который был верифицирован на основании жалоб больных, анамнеза заболевания, объективного осмотра, результатов клинико-лабораторных и инструментальных исследований. В фазе ремиссии ХОПН обследованы 13 больных и в фазе рецидива – 29. В исследование включены пациенты, которые принимали нестероидные противовоспалительные препараты (НПВП) и антибиотики в стандартной дозе не менее 5–10 дней до момента госпитализации. При анализе гемограммы (гемоанализатор ABX Pentra XL 80-HORIBA, Франция) определяли количество форменных элементов, лейкоцитарную формулу и абсолютное количество различных видов лейкоцитов. Верификация степени гематурии основывалась на анализе мочи по Нечипоренко – подсчитывали количество тысяч эритроцитов в 1 мл мочи. Тромбоциты выделяли путем центрифугирования из цитратной периферической крови пациентов. Для анализа функционального состояния Тц использовали агонисты – АДФ (5 мкМ), адреналин (5 мкМ), фактор активации тромбоцитов (ФАТ, 150 мкМ), серотонин (10 мкМ), коллаген (2 мг/мл) в концентрации ЕС50, воспроизводящей амплитуду агрегации 50% у здоровых лиц. В исследованиях также были использованы субпороговые концентрации агонистов, которые в контрольной группе (5 здоровых доноров) вызывали агрегацию тромбоцитов (АТц) на уровне 10,0±0,8%. Для адреналина ЕС10 составила -0,1 мкМ, АДФ – 0,5 мкМ и ФАТ 30 мкМ. Модулирующую роль адреналина в активации Тц анализировали при совместной инкубации с каждым агонистом (АДФ, ФАТ). Оценку агрегации тромбоцитов проводили на агрегометре Chrono-log (USA). Все клинические исследования выполнены по согласованию с комиссией по биоэтике Донецкого национального медицинского университета им. М. Горького.
Статистическую обработку результатов проводили в пакетах MedStat и MedCalc. Достоверность полученных результатов подтверждалась путем статистической обработки с помощью вариационного, корреляционного, регрессионного, однофакторного дисперсионного анализов. Оценивали характер распределения признака, среднее арифметическое значение или медиану, стандартную ошибку, среднее отклонение, коэффициенты корреляции, критерии регресса и дисперсии. При анализе межгрупповых различий в зависимости от характера распределения признаков учитывали критерий Стьюдента, Вилкоксона, Xi-квадрат. Различие оценивали как статистически значимые при p<0,05.

Результаты
Достижение поставленной цели возможно путем решения следующих исследовательских вопросов.
Во-первых, отличаются ли традиционные индикаторы воспаления, основанные на анализе периферической крови, в фазах ремиссии и рецидива ХОПН? По сути, можно ли констатировать наличие острой воспалительной реакции в мочевыводящих путях при ХОПН?
При ремиссии ХОПН (1-я группа) количество лейкоцитов в периферической крови составило 7,1±0,5х109/л (95% ДИ – 6,2×109–8,3×109/л), сегменто-ядерных НФ – 60,0±1,4% (95% ДИ – 51–67%) и СОЭ – 7,0±1,0 мм/ч (95% ДИ – 6,0–15,0 мм/ч), т.е. находились в пределах референтных значений «нормы».
При рецидиве ХОПН (2-я группа) количество лейкоцитов крови превышало значение в группе с ремиссией на 28% (р<0,01), сегменто-ядерных НФ – на 10,9% (р<0,01), а СОЭ на 41,7% (р=0,213). На фоне скудости лабораторных показателей, позволяющих отдифференцировать фазы ремиссии и рецидива, может оказаться весьма информативным соотношение нейтрофилов/лимфоцитов в периферической крови: соответственно в 1-й группе – 2,37, 2-й группе – 3,50. Таким образом, в фазу рецидива ХОПН реакция периферической крови отражает наличие острого воспаления в мочевыводящих путях при ХОПН.
Во-вторых, имеет ли место гематурия при ХОПН и отличается ли степень такой кровопотери в условиях ремиссии и рецидива заболевания? Установлено, что в фазе ремиссии ХОПН микрогематурия достигала 2,25±1,12×103 Эр/мл (95% ДИ – 0,883×103–32,8×103 Эр/мл). При этом у большинства больных (9 пациентов, 69,2%) гематурия была минимальной и находилась в диапазоне от 0 до 10×103 Эр/мл. В фазу рецидива ХОПН отмечена гематурия на уровне 25,0±5,1×103 Эр/мл (95% ДИ – 10,5×103–60,6×103 Эр/мл), т.е. примерно в 11 раз выше, чем в фазу ремиссии (р=0,035). Частотное распределение выраженности гематурии демонстрирует, что у большинства больных (16 пациентов, 55,2%) гематурия была минимальной и находилась в диапазоне от 0 до 20×103 Эр/мл и только у 6 больных (10,6%) микрогематурия была выраженной и находилась в диапазоне от 60×103 до 180×103 Эр/мл.
Таким образом, при остром воспалении в мочевыводящих путях (фаза рецидива ХОПН) наблюдается большая, чем при хроническом воспалении, кровопотеря (фаза ремиссии ХОПН).
В-третьих, отличается ли адренореактивность у пациентов в фазах ремиссии и рецидива ХОПН?
В 1-й группе функциональный ответ Тц на исследованные агонисты может быть охарактеризован как гипореактивность (табл. 1). Такой результат вполне ожидаем, если учитывать прием больными НПВП и антибиотиков. Тем не менее обнаруженный спектр реакции Тц имеет свои особенности. Вариабельность адреналин-индуцированной АТц (ЕС50) отражает минимальный и максимальный ответ Тц, который составил соответственно 3,6–44%. Следовательно, в фазе ремиссии ХОПН встречались как пациенты с десенситизацией α2-адренорецепторов, так и пациенты, у которых агрегация находилась на уровне нижней границы нормоадренореактивности. Статистически значимой разницы между стимулирующим воздействием адреналина и ФАТ, СТ и коллагеном не обнаружено. Обращает на себя внимание доминирующий эффект АДФ. Реакция Тц на АДФ была выше, чем адреналина, на 83,8% (р<0,01), ФАТ – в 2,5 раза (р<0,05), СТ – в 2,1 (р>0,05) и коллагена – в 3,7 раза (р<0,05). Таким образом, в фазу ремиссии ХОПН спектр ответов Тц на агонисты представлен как АДФ>Адреналин=СТ=ФАТ>Коллаген. Во 2-й группе также обнаружили уменьшение реакции Тц на ЕС50 адреналина. Учитывая одинаковый уровень АДФ-индуцированной АТц в фазах ремиссии и рецидива ХОПН, можно констатировать, что эндогенная секреция АДФ из плотных гранул Тц не изменяется при переходе от хронического к острому воспалению. Реакция Тц на АДФ превышала таковую в ответ на адреналин на 83,5% (р<0,01), а ФАТ и СТ соответственно в 2 и 3,3 раза (р<0,01). Коллаген воспроизводил АТц на уровне контрольной группы (здоровых лиц), при этом межгрупповая разница достила 3,5 раза (р>0,05). Вероятно, различие реакции на коллаген объясняется необходимостью ограничения гематурии, выраженность которой выше при рецидиве ХОПН. Если сформировать ряд агонистов относительно снижения стимулирующего влияния на Тц в условиях рецидива ХОПН, такой ряд имеет вид: АДФ=Коллаген>Адреналин=ФАТ>СТ.
Таким образом, (а) если сравнивать фазы ремиссии и рецидива, то не определяется статистически значимой разницы реакции Тц на исследованные агонисты; (б) сходство гипореактивности Тц в фазах ХОПН имеет свои качественные отличия, если сопоставлять стимулирующий эффект разных агонистов. В связи с этим необходимо ответить на следующий исследовательский вопрос: возможно ли взаимодействие разных агонистов Тц для ограничения гематурии и развития острого воспаления, т.е. перехода от ремиссии к рецидиву ХОПН, и какую роль в этих механизмах играет адреналин?
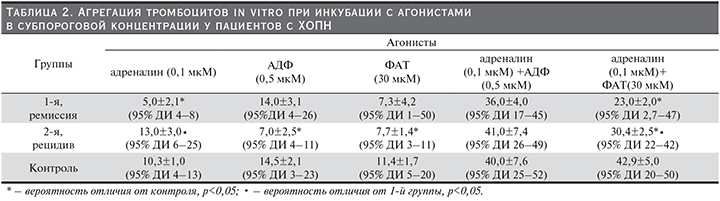
Проверке этой гипотезы посвящено исследование взаимодействия агонистов (адреналина и АДФ, адреналина и ФАТ, использованных в субпороговых дозах) с целью активации Тц.
В контрольной группе субпороговая концентрация (0,1 мкМ) адреналина индуцировала АТц на уровне 10,3±1,0%. При совместной инкубации адреналин усиливал эффект АДФ в 2,8 (р<0,01), влияние ФАТ – в 3,8 раза (р<0,001). В фазу ремиссии ХОПН аналогичная концентрация адреналина воспроизводила АТц на 51,5% меньше (р<0,05), чем в контроле (табл. 2). В случае предварительной блокады α2-адренорецепторов Тц йохимбином (IС50 10 мкм) эффект адреналина отменялся, что подтверждает участие α2-адренорецепторов в зарегистрированном эффекте. ФАТ-индуцированная АТц была ниже, чем в контроле, на 36% (р<0,05), что отражает провоспалительную активацию Тц со стороны нейтрофилов. Эффект ФАТ был на 47,9% меньше АДФ (р>0,05), при этом субпороговая концентрация ФАТ усиливала эффект адреналина в 3,1 раза (р<0,01). Инкубация Тц совместно с адреналином и АДФ воспроизводила АТц на 56,5% больше (р<0,01), чем комбинация адреналина и ФАТ.
Таким образом, сама по себе субпороговая доза адреналина воспроизводит АТц менее 10%, однако добавление субпороговой дозы АДФ потенцирует эффект адреналина. Это означает, что при ремиссии гипореактивные Тц сохраняют способность в ответ на адреналин существенно повышать функциональную активность, направленную на ограничение гематурии. Взаимодействие адреналина и ФАТ на суспензии Тц демонстрирует наличие паракринного влияния лейкоцитов на Тц. Тем самым подтверждаются возможность и механизм активации гипоадренореактивных Тц в условиях хронического воспаления.
В фазу рецидива ХОПН стимулирующее влияние адреналина на Тц было выше, чем в фазу ремиссии, в 2,6 раза (р<0,05) и на 26,2% больше (р<0,05), чем в контроле. Демонстративной была динамика АДФ-индуцированной агрегации, поскольку данный агонист воспроизводил эффект в среднем в 2 раза меньше, чем в контроле и в фазе ремиссии (р<0,05). При этом изолированный эффект АДФ на Тц был на 46,2% меньше, чем адреналина (р>0,05). Означает ли это, что в фазу острого воспаления нивелируется роль АДФ в индукции Тц и НФ? Установлено, что при совместном действии адреналина и АДФ на Тц зарегистрированный эффект превышал действие одного АДФ в 5,9 раза (р<0,001); для сравнения: в фазу ремиссии этот эффект, как уже отмечалось, составил 2,6 раза (р<0,01). Тем не менее в фазу рецидива ХОПН не проявляется значимых различий влияния адреналина на АДФ-индуцированную АТц по сравнению с фазой ремиссии (р>0,05). При наличии макрогематурии такое взаимодействие агонистов в фазу рецидива ХОПН не эффективно для ограничения кровопотери; одной из причин этого феномена может быть сниженная секреция АДФ из плотных гранул Тц, в сущности – низкая аутокринная стимуляция Тц в фазу рецидива. ФАТ воспроизводил АТц меньше, чем в контроле, на 32,5% (р<0,05) и совпадал с таковым в фазу ремиссии заболевания. Синергизм действия адреналина и ФАТ был выраженным и превышал в фазу ремиссии на 32,2% (р<0,05), хотя и был ниже в контроле на 29,1 (р<0,05). Инкубация Тц совместно с адреналином и АДФ воспроизводила АТц на 34,9% больше (р<0,05), чем комбинация адреналина и ФАТ. Следовательно, взаимодействие адреналина и ФАТ в фазу рецидива ХОПН демонстрирует возможность значительного усиления влияния лейкоцитов на Тц в условиях активации симпатоадреналовой системы, в т.ч. с целью развития острого воспаления.
Обсуждение
До настоящего времени вопросы ранней диагностики, мониторинга и прогнозирования течения ХОПН остаются открытыми. Дифференциальная диагностика фаз ХОПН традиционно выстраивается на анализе клинико-лабораторных показателей и не всегда выглядит убедительно [7, 8].
В литературе представлена ограниченная и противоречивая информация об участии Тц в прогрессировании ХОПН [9, 10]. Факт взаимодействия Тц с нейтрофилами – достаточно известный, однако роль такой кооперации клеток крови продолжает обсуждаться. Gremmel T. еt al. [11], считают, что взаимодействие Тц с нейтрофилами способствует, во-первых, рекрутированию лейкоцитов в очаг воспаления. Взаимодействие нейтрофилов с Тц в основном опосредовано P-селектином, β2- и β3-интегринами (CD11b/CD18, CD41/CD61). Во-вторых, прикрепленные Тц способствуют вторичном захвату (активации) нейтрофилов и других лейкоцитов. В-третьих, Тц секретируют различные биологически активные вещества (АДФ, серотонин, адреналин, тромбоцитарный фактор роста, активные радикалы кислорода), которые могут инициировать воспаление и модулировать функциональную активность эндотелиальных клеток и лейкоцитов. Таким образом, Тц рассматриваются как важные индукторы воспаления.
Проведенное исследование показало, что у пациентов с ХОПН на фоне применения НПВП и антибиотикотерапии снижается реактивность Тц (феномен гипореактивности Тц) относительно основных агонистов вследствие ингибирования ЦОГ-1. При этом риск/выгода профилактики прогрессирования ХОПН остаются неясными. В последнем обзоре [12] обращают внимание на неоднозначность результатов назначения НПВП. С одной стороны, супрессия ЦОГ-2 в лейкоцитах приводит к специфическому ингибированию синтеза простагландинов, участвующих в воспалительной реакции. С другой – тормозятся синтез тромбоксана А2 в тромбоцитах и продукция простациклина эндотелиальными клетками. Как следствие – можно ожидать снижения проагрегантного статуса Тц, что может сопровождаться гематурией у пациентов с МКБ.
В этом контексте актуальным представлялось использование Тц в качестве модели для исследования in vitro молекулярных механизмов развития осложнений ХОПН. Известно, что Тц и лейкоциты имеют различные виды рецепторов на плазмолемме, которые инициируют и модулируют развитие воспаления и тромбогенез [13]. Если исходить из возможности нейрогуморальной дизрегуляции в процессе ХОПН, то можно прийти к пониманию значимости функционального состояния рецепторного аппарата Тц в ограничении гематурии и изменении течения воспаления. В связи с этим адренорецепторы Тц представляют собой существенный динамический фактор, обусловливающий высокую остаточную реактивность Тц, способную вызывать рецидив тромбогенеза при низкой эффективности антиагрегантной терапии [14]. Тот факт, что адреналин существенно усиливает эффект АДФ и ФАТ на Тц, демонстрирует роль этого агониста в поддержании воспаления и ограничении гематурии при ХОПН. Достигнутый эффект может быть вызван стимуляцией различных G-белок связанных рецепторов, сопровождается комплексом событий, включая: 1) активацию изоформы ФЛCβ через Gq, что приводит к повышению уровня цитоплазматического Ca2+ и активации протеинкиназы C; 2) реорганизацию актинового цитоскелета через G12 и G13, вызывая изменения архитектоники кольца микротрубочек, формирование филоподий и ламеллоподий; 3) снижение активности аденилатциклазы и образования цAMФ через семейство Gi белков [15]. Повышение уровня цАМФ возможно и за счет воздействия на Тц факторов эндотелиального происхождения – простациклина (ПГI2) и оксида азота (NO).
Таким образом, взаимодействие разных агонистов в фазах ремиссии и рецидива ХОПН может восстанавливать функцию гипореактивных Тц, при этом адреналин может играть роль модулятора в патогенетических механизмах осложнений ХОПН.



