Перитонеальный диализ (ПД) – один из методов заместительной почечной терапии (ЗПТ), которым в мире лечатся в среднем 11% больных хронической болезнью почек (ХБП) 5-й стадии. Согласно последнему опубликованному отчету по данным Российского регистра ЗПТ, в России наблюдается ежегодный прирост в целом как числа больных, получающих ПД, так и числа больных, впервые принятых на данный метод ЗПТ. В конце 2011 г. насчитывалось 1922 ПД-больных, или 13,4 на млн населения, против 1771 пациента, или 12,4 на млн населения годом раньше, причем в перспективе, как ожидается, подобная закономерность – увеличение числа ПД-больных – будет сохраняться [1].
Задокументировано, что продолжительность лечения ПД и выживаемость ПД-пациентов зависят не только и не столько от адекватности диализной программы и развития, характерных для данного метода ЗПТ осложнений, но в большей степени от присоединения и прогрессирования сопутствующей патологии, в частности нарушения пищевого статуса, наиболее часто протекающего в виде белково-энергетической недостаточности (БЭН). Развитие БЭН оказывает существенное влияние на прогноз ПД-больных, снижая функции иммунной, кроветворной и др. систем организма, ухудшая качество жизни, уровень медико-социальной реабилитации и готовность к пересадке почки, повышая частоту и длительность госпитализаций [2, 3].
Определение и классификация БЭН
БЭН – это нарушение пищевого статуса, возникающее в результате неадекватного поступления в организм и/или неадекватного восполнения организмом потерь белка и энергии.
ПД-больным целесообразно придерживаться Международной классификации болезней и причин смерти 10-го пересмотра, в которой выделены:
- БЭН легкой степени;
- БЭН среднетяжелой степени;
- БЭН тяжелой степени (формы):
- маразм,
- квашиоркор,
- маразм и квашиоркор (сочетанная форма).
Маразм выражается в истощении периферических белковых и энергетических запасов. У больных с маразмом наблюдается снижение массы тела за счет истощения подкожно-жировой клетчатки, гипо/атрофии скелетных мышц (соматический пул), но функция печени и других внутренних органов (висцеральный пул белка) остается сохранной; возможно развитие иммунного дефицита.
Квашиоркор характеризуется нормальной или повышенной массой тела, сохранным запасом жира и соматического пула белка, но снижением висцеральных белков (гипопротеинемия) и функциональными нарушениями висцеральных органов.
Сочетанной форме (маразм–квашиоркор) присущи снижение массы тела, развитие энергетического дефицита, истощение соматического и висцерального пула белков, а также наличие иммунодефицита [4].
Эпидемиология и причины развития БЭН
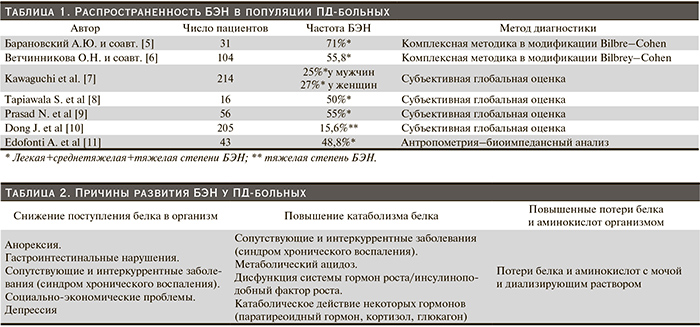
Распространенность БЭН в популяции ПД-больных варьируется в достаточно широких пределах: по данным доступной информации, – от 15,6 до 71,0%. Эти колебания обусловлены как неоднородностью обследованных пациентов, так и несовершенством способов и критериев диагностики, оценки тяжести течения и формы БЭН (табл. 1). Чаще встречается легкой и среднетяжелой, реже – около 10% – тяжелой степеней БЭН. Результаты проведенного нами анализа встречаемости БЭН среди ПД-больных практически не отличаются от данных, полученных другими авторами. В целом БЭН регистрировалась у 55,8% пациентов: легкого течения – у 33,7%, среднетяжелого течения – у 22,1% и ее частота не зависела от длительности лечения ПД.
Причины развития БЭН у ПД-больных многообразны – это и причины, характерные в целом для больных ХБП, и причины, характерные только для больных, получающих заместительную терапию ПД. Нарушение пищевого статуса может выявляться уже перед началом ПД чаще у больных сахарным диабетом, подагрой, нефротическим синдромом, иногда вследствие длительного соблюдения малобелковой диеты. Выделяют три группы причин, вызывающих развитие БЭН у ПД-больных (табл. 2): снижение поступления белка в организм; повышение катаболизма белка; повышенные потери белка и аминокислот организмом [12].
Главной причиной БЭН следует признать повышенную потребность организма в белке и энергии при недостаточном поступлении их с пищей. По данным различных клинических рекомендаций, диетарное потребление белка у ПД-больных должно составлять в среднем 1,3 г/кг/сут (табл. 3). В действительности же мало кто из больных придерживается такой рекомендации. Проведенный нами анализ диетарных интервью и 3-дневных пищевых дневников с подсчетом суточного потребления белка и энергетической ценности суточного рациона свидетельствует, что ни один пациент не потребляет указанного количества белка; 71% ПД-больных – от 1,0 до 1,2 г/кг/сут и 23% – менее 1 г/кг/сут, причем среди имеющих БЭН таковых соответственно 58 и 41% [13]. Очень похожие данные приводят A.Y. Wang и соавт. [14] – число ПД-больных, потреблявших белка менее 1,2 г/кг/сут, составило 85,3%, а факторами риска низкого его потребления оказались старший возраст, наличие сахарного диабета и сопутствующей сердечно-сосудистой патологии, гипергидратация и высокое содержание в крови С-реактивного белка. Энергетическая ценность пищевого рациона страдает в меньшей степени, почти все пациенты укладываются в целевой диапазон 30–35 ккал/сут.

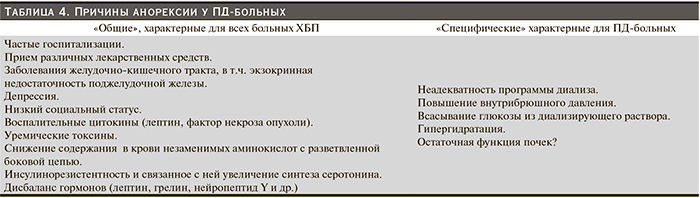
В свою очередь недостаточное поступление белка у подавляющего большинства ПД-больных связано с устойчиво низким уровнем аппетита и, как показало специально проведенное исследование, определенным, несмотря на занятия с диетологом, пределом потребления пищевых продуктов [19]. Анорексия, определяемая как потеря желания принимать пищу, имеет сложное происхождение. Выделяют ряд факторов, приводящих к ее развитию, как «общих», так и сугубо «специфических», для ПД-больных (табл. 4).
За последние годы появились исследования, пересмотревшие значение некоторых факторов в развитии БЭН у ПД-больных.
В частности, по мнению H. Cilan и соавт. [20], депрессия встречается лишь у четверти ПД-больных и представляет собой общее психопатологическое состояние, не имеющее значительного влияния на пищевой статус и синдром хронического воспаления, а назначение антидепрессантов таким больным не вызывает каких-либо изменений нутритивных параметров. В другом недавнем исследовании K. Kaynar и соавт. [21] установлены повышенные по отношению к группе здоровых лиц уровни в крови адипонектина и резистина, но не грелина, нейропептида Y и лептина. Наличие тесной положительной корреляции сывороточных концентраций адипонектина и резистина с наличием БЭН указывает на определенное участие именно этих субстанций в развитии данной патологии у ПД-больных. Испанское оригинальное исследование продемонстрировало достоверно повышенный базальный плазменный уровень пептида YY, который секретируется в дистальном отделе тонкого кишечника и по своей функциональной активности относится к классу анорексогенных гормонов [22]. Оказалось, что ни пероральная пищевая стимуляция, ни внутриперитонеальное введение раствора глюкозы не оказывали влияния на исходно повышенный уровень пептида YY у ПД-больных в отличие от закономерного его увеличения в ответ на пищевую стимуляцию, наблюдаемую у здоровых лиц. На основании полученных данных авторы заключают, во-первых, о наличии у ПД-больных глубокой дезорганизации физиологических механизмов, регулирующих аппетит, и во-вторых, о вероятном участии повышенного плазменного уровня пептида YY в развитии анорексии и БЭН.
Развитие анорексии у ПД-больных может быть связано с нарушением аминокислотного баланса крови: снижением незаменимых аминокислот с разветвленной боковой цепью, соотношения незаменимых/заменимых аминокислот и уровня триптофана. Так, согласно нашим данным, содержание в крови незаменимых аминокислот с боковой углеродной цепью (валин, лейцин, изолейцин) составило 29,6 мг/л, в то время как у доноров этот показатель колеблется от 30,9 до 47,4 мг/л, а отношение незаменимых разветвленных аминокислот к заменимым, отражающее диетарное потребление белка, было снижено почти в 2 раза (0,2 против 0,5 у доноров) [23]. Подтверждением участия дефицита незаменимых разветвленных аминокислот в развитии БЭН при ХБП служит также тот факт, что назначение этих аминокислот улучшает аппетит и увеличивает диетарное потребление белка [24–26].
В отношении «специфических» факторов, ответственных за анорексию у ПД-больных, мнения специалистов порой не совпадают. Это касается, например, дозы ПД, рассчитываемой по уравнению кинетики мочевины (Kt/V). Были получены данные, как установившие взаимосвязь между адекватностью диализной программы и развитием нутритивных нарушений, так и показавшие, включая большое рандомизированное исследование ADEMEX, что увеличение дозы ПД не привело к какому-либо явному улучшению нутритивных параметров [6, 27–31]. Еще одна характеристика адекватности программы ПД, участие которой в возникновении анорексии обсуждается, – это состояние гидратации пациента и тесно связанные с этим наличие или отсутствие остаточной функции почек. Ряд исследований, в т.ч. и собственное, свидетельствует, что доля больных с отсутствием остаточной функции почек более характерна для страдающих БЭН [6, 32]. Больные анурией для достижения целевой ультрафильтрации вынуждены использовать средне- и высокоосмолярные растворы, которые приводят к увеличению как всасывания глюкозы, так и внутрибрюшного давления, тем самым усиливая анорексию. Сообщается о наличии положительной связи между остаточной функцией почек и шкалой определения пищевого статуса – субъективной глобальной оценкой (СГО), а также белковым эквивалентом выведения азота (БВА) и сывороточным альбумином [33, 34]. Однако китайские специалисты убедительно продемонстрировали, что быстрое снижение остаточной почечной функции у больных ХБП, получающих лечение ПД, не обязательно сопровождается снижением аппетита, уменьшением диетарного потребления белка и ухудшением питательного статуса [10, 35]. В настоящее время умеренная гипергидратация не является обычным состоянием для ПД-больных, как это считалось ранее. Современные возможности ПД и использование специальных растворов позволяют обеспечивать идеальный водный статус пациента и снижать поступление глюкозы в организм [36]. Тем не менее трудно представить, что неадекватность ПД не влияет на развитие БЭН, поскольку такие больные как бы попадают в порочный круг: гипергидратация и накопление уремических токсинов вследствие малой дозы ПД угнетают аппетит, что приводит к недостаточному потреблению белка и энергии, а это – к усиленному катаболизму белка, распаду мышечной массы, уменьшению жировых запасов организма и появлению и/или прогрессированию нутритивных нарушений с повышением содержания в крови продуктов распада эндогенного белка, в свою очередь усиливающих анорексию [37].
Ряд исследований продемонстрировал негативную роль возраста, мужского пола, наличие сахарного диабета и длительности лечения ПД на развитие БЭН, однако в нашем исследовании ни один из перечисленных факторов не подтвердился [6, 10, 14]. R. Zhang и соавт. [38] показали, что пациенты старше 65 лет имели худшие параметры пищевого статуса и более высокие показатели перитонеального транспорта. Высокие транспортные характеристики брюшины, скорее всего, могут приводить к ухудшению пищевого статуса за счет большей потери белка и аминокислот, повышенного риска развития гипергидратации из-за ограниченной ультрафильтрации, большего поступления в организм глюкозы вследствие использования средне- и гиперосмолярных растворов, но они не обязательно связаны со старшим возрастом пациентов [6].
Ряд исследований акцентирует внимание на тесной связи БЭН и сердечно-сосудистой патологии у ПД-больных [10, 14, 39]. Эта взаимосвязь нарушений пищевого статуса и сократительной функции миокарда в настоящее время хорошо известна. С одной стороны, выраженная и длительно существующая БЭН приводит к развитию атрофических процессов не только в скелетных мышцах, но и в миокардиальном синцитии, с другой – низкий сердечный выброс нарушает доставку пищевых веществ к клеткам организма и их усвоение на клеточном уровне. Кроме того, клеточная гипоксия, обусловленная сердечной недостаточностью, инициирует развитие синдрома гиперметаболизма. Кроме того, в результате клеточной гипоксии, снижения тканевого и органного кровотока, гипоксии печени и поджелудочной железы угнетаются процессы полостного и пристеночного пищеварения и нарушается транспорт пищевых веществ.
Необходимо помнить, что даже достаточное суточное потребление белка ПД-больными не исключает потенциальной возможности у них БЭН, поскольку существуют и другие пути ее развития. Один из них – это синдром гиперметаболизма-гиперкатаболизма, проявляющийся повышенным распадом тканевых белков и усиленным расходом углеводно-липидных резервов, и тесно связанный с системной воспалительной реакцией, метаболическим ацидозом, дисбалансом гормонов с анаболическим действием. В свою очередь диагностируемая почти у половины ПД-больных системная воспалительная реакция помимо причин, характерных в целом для ХБП (снижение клиренса цитокинов, сердечно-сосудистая патология, воспалительные заболевания почек и других органов, очаги острой и хронической инфекции), имеет дополнительный источник – диализный перитонит [10, 14, 28, 40]. Так, частота диализного перитонита составила 1 эпизод на 12,9 и 16,9 месяца лечения соответственно у больных среднетяжелой и легкой БЭН против 1 эпизода на 25,2 месяца лечения у больных без БЭН (р<0,0001). Кроме того, среди имеющих БЭН чаще встречаются пациенты с повышенным уровнем С-реактивного белка и α2-фракции глобулинов, относящихся к провоспалительным субстанциям. Наконец, для ПД-больных характерна гипер-γ-глобулинемия, отражающая напряженность гуморального иммунитета и развивающаяся, по-видимому, в ответ на системный воспалительный процесс [6, 13].
Метаболический ацидоз вызывает усиление деградации мышечных белков за счет увеличения транскрипции генов протеолитических ферментов, включая убиквитин-протеасомный путь, а его коррекция способствует активизации анаболических процессов и улучшению нутритивных показателей: снижению деградации тканевых белков и выведению мочевины при неизменном диетарном потреблении белка, а также увеличению концентрации разветвленных аминокислот плазмы и массы тела пациентов [32, 41–45]. Следует отметить, что в настоящее время метаболический ацидоз встречается у единичных больных благодаря использованию диализирующего раствора с нейтральной рН [6].
 К факторам, повышающим катаболизм белка, относится паратиреоидный гормон (ПТГ), и недавно выполненное исследование продемонстрировало негативное влияние вторичного гиперпаратиреоза на состояние белково-энергетическго обмена при додиализной ХБП [46]. Но полученные нами данные не подтвердили катаболического эффекта ПТГ у ПД-больных, что может быть следствием активно проводимых у них профилактики и лечения вторичного гиперпаратиреоза. Катаболизму белка и уменьшению мышечной массы может способствовать встречающееся при ХБП нарушение функции гормонов с анаболическим действием: резистентность к гормону роста, дефицит андрогенов, подавление ингибитора ростового фактора-1.
К факторам, повышающим катаболизм белка, относится паратиреоидный гормон (ПТГ), и недавно выполненное исследование продемонстрировало негативное влияние вторичного гиперпаратиреоза на состояние белково-энергетическго обмена при додиализной ХБП [46]. Но полученные нами данные не подтвердили катаболического эффекта ПТГ у ПД-больных, что может быть следствием активно проводимых у них профилактики и лечения вторичного гиперпаратиреоза. Катаболизму белка и уменьшению мышечной массы может способствовать встречающееся при ХБП нарушение функции гормонов с анаболическим действием: резистентность к гормону роста, дефицит андрогенов, подавление ингибитора ростового фактора-1.
Еще одна важная причина развития БЭН у ПД-больных − повышенные потери белка и аминокислот через брюшину в диализирующий раствор. Суточная потеря белка с диализатом может достигать от нескольких до 15 г у больных, получающих лечение автоматизированным ПД, и с нарушением пищевого статуса она больше [6, 47]. Определяется высокая степень зависимости и тяжести БЭН, содержания в сыворотке крови общего белка и альбумина с величиной общей суточной потери белка [6, 13]. В свою очередь потеря белка в диализат тесно связана с перенесенным диализным перитонитом, в период которого она увеличивается в 1,5–2,0 раза и остается повышенной в течение длительного времени, а об участии диализного перитонита в развитии БЭН уже говорилось.
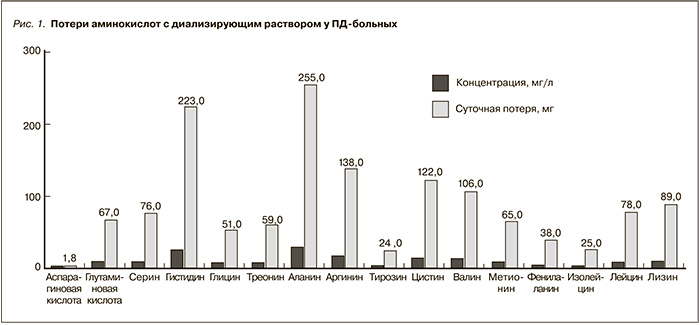
Потеря аминокислот с диализирующим раствором колеблется в пределах 2–4 г/сут. Изучение аминокислотного профиля у ПД-больных показало, что их общая суточная потеря составила 1,5 г, из них половина – незаменимых/условно незаменимых аминокислот (рис. 1) [23, 48].
Диагностика БЭН
Динамическое исследование пищевого статуса, выявление факторов риска формирования и ранняя диагностика БЭН – важная составляющая в организации лечебного процесса у ПД-больных. Оценка пищевого статуса складывается из анализа субъективных (клинических) и объективных (соматометрических, лабораторных, функциональных, биоимпедансометрических) показателей [18]. Информативность существующих методик оценки пищевого статуса у ПД-больных различна. Проведенный нами сравнительный анализ демонстрирует – частота БЭН составляет 8,9–25,9% при использовании индекса массы тела (ИМТ), но 39,3–57,9% при использовании различных комплексных способов оценки пищевого статуса (рис. 2).
Клиническое обследование предполагает регулярный анализ собранных у больных за последнюю неделю диетических интервью и данных, полученных из пищевых дневников, на основании которых судят о суточном потреблении белка, жиров, углеводов, рассчитывают энергетическую ценность суточного рациона.
Антропометрическое обследование пациента предполагает определение его веса, расчет индекса массы тела (ИМТ), измерение специальным циркулем-каллипером толщины кожно-жировой складки над трехглавой мышцей (трицепсом) плеча (КЖСТ) и сантиметровой лентой окружности плеча (ОП) с последующим определением окружности мышц плеча по формуле: ОМП=ОП−3,14×КЖСТ. Информация о весе пациента должна быть максимально полной: вес в настоящее время, обычный вес, динамика веса за последнее время, идеальный вес, сухой вес, а также безотечный вес, который рассчитывается по формуле: безотечный вес=сухой вес – (идеальный вес–сухой вес)×0,25. Использование сугубо антропометрических показателей, таких как ИМТ, толщина КЖСТ и ОП, не совсем надежно для диагностики БЭН у ПД-больных. Значение ИМТ более 18,5 кг/м2, отражающее нормальный пищевой статус в общей популяции, оказалось неприемлемым для диализной категории больных. Доказано, что у них величина ИМТ уже менее 22 кг/м2 ассоциируется с увеличением риска летальных исходов [49]. Но и это минимальное значение ИМТ не всегда «работает» у ПД-больных. Еще менее специфичны для оценки пищевого статуса два других антропометрических показателя – толщина КЖСТ и ОП. Лишь ОМП достаточно объективно отражает запасы соматического белка и может быть использована для диагностики белковой недостаточности. В целом же проведение антропометрического обследования ПД-больных – довольно трудоемкий процесс, требующий специальных/профессиональных навыков, а его результаты зависят от столь изменчивого у этих больных водного баланса и поэтому имеют недостаточную информативность.
К лабораторным диагностическим критериям БЭН относят некоторые сывороточные белки, такие как альбумин, преальбумин, С-реактивный белок, трансферрин, сывороточная концентрация неорганического фосфора, а также численность лимфоцитов периферической крови и белковый эквивалент выведения азота (БВА).
Наиболее методически простым и доступным в широкой клинической практике является определение сывороточной концентрации альбумина. Давно показано, что содержание в крови альбумина представляет собой важнейший индикатор выживаемости ПД-больных, его снижение менее 35 г/л ассоциируется с увеличением смертности на 1,38% [50, 51]. Альбумин относится к наибольшей по количеству фракции белков крови и отражает состояние висцерального пула белков. Его содержание в крови есть результирующая нескольких процессов – синтеза в печени (10–12 г/сут), распада (катаболизма), потери из организма (с мочой, диализирующим раствором), разведения в объеме циркулирующей крови и распределения/перераспределения между сосудистым руслом и интерстициальным пространством. Как нутритивный маркер альбумин крови обладает высокой специфичностью, но недостаточной чувствительностью из-за влияния на него многих «ненутритивных» факторов: нарушения функции печени, потери при заболеваниях желудочно-кишечного тракта и диализном перитоните, достаточно часто встречающихся гиперволемии, синдрома хронического воспаления и др. [13, 40, 52].
Гипоальбуминемия – распространенная ситуация для ПД-больных, вызывающая серьезную озабоченность многих клиницистов. Так, согласно нашим данным, подавляющее большинство (88,5%) пациентов имели сывороточный альбумин менее 40 г/л: в отсутствие БЭН – 83,3%, при наличии – 92,3%; среднее его содержание составило соответственно 36,1±3,1, 37,7±2,2 и 34,8±3,2 г/л [13]. Гипоальбуминемия не служит синонимом БЭН, но она тесно связана с этим состоянием, представляя одно из ее проявлений: чем меньше концентрация альбумина в крови, тем более выражена БЭН [6, 13]. Поэтому, несмотря на многие ограничения, динамическое определение сывороточного альбумина остается общепринятым лабораторным критерием оценки пищевого статуса ПД-больных. Более того, сывороточная концентрация альбумина как один из параметров включен в ряд комплексных способов оценки пищевого статуса, о которых пойдет речь ниже.
Преальбумин, так же как и альбумин, не может считаться сугубо нутритивным параметром, поскольку он связан и с синдромом хронического воспаления, и с остаточной функцией почек, но подобно альбумину является предиктором смертности диализных пациентов [50]. Дискуссия о том, какое состояние в большей степени отражают сывороточные альбумин и преальбумин – БЭН, синдром хронического воспаления или коморбидность – продолжается, что привело к некоторому диагностическому нигилизму в отношении этих параметров [53].
Синтез С-реактивного белка в печени стимулируется острым или хроническим воспалением, инфекцией, стрессом и не может быть отнесен к сугубо нутритивным параметрам, но его определение помогает правильно интерпретировать содержание других висцеральных белков.
Трансферрин – представитель β-глобулиновой фракции белков крови с относительно коротким периодом полураспада (8 дней). Однако его синтез в печени, а следовательно, и уровень в крови определяются в первую очередь обменом железа, а также реагируют на гемоторансфузию и введение эритропоэзстимулирующих средств. Все это делает трансферрин недостаточно чувствительным маркером пищевого статуса.
Недостаточное потребление белка приводит к гипофосфатемии, но при вторичном гиперпаратиреозе с костной резорбцией уровень фосфора в крови может быть нормальным или иметь тенденцию к повышению. Стойкая гипофосфатемия у ПД-больного, не принимающего фосфатсвязывающих средств, отражает дефицит диетарного белка.
БВА представляет собой классический нутритивный показатель, динамическое определение которого позволяет контролировать суточное потребление белка. Это «золотой» стандарт, но только для диагностики белковой составляющей БЭН и совершенно не отражающий калорийность суточного рациона. У ПД-больных БВА вычисляется по формуле:
БВА, г/кг/сут=15,1+0,195×(суточная экскреция мочевины с диализирующим раствором и мочой, ммоль)+(суточная экскреция белка с мочой, г). БВА необходимо стандартизовать на размер тела пациента путем деления на V/0,58, где V – общий объем воды тела и 0,58 – стандартная доля воды в массе тела.
Следует отметить, что если при додиализной ХБП БВА служит достаточно надежным критерием потребления белка, то у ПД-больных его информативность остается спорной с учетом существенных ограничений [18]. Ряд исследований, в т.ч. и собственное, свидетельствует о необходимости осторожной оценки результатов его определения в силу отсутствия строгой зависимости между ним и суточным потреблением белка [5, 6].
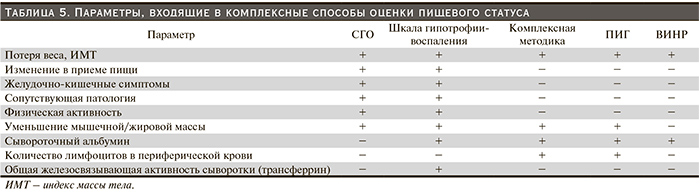
У ПД-больных для динамической оценки пищевого статуса и диагностики БЭН предпочтительнее использовать комплексные индексы и методики, включающие сочетание различных нутритивных параметров (табл. 5).
К ним относятся:
- субъективная глобальная оценка (СГО) A.S. Detsky et al. [54] в модификации G. Enia еt al. [55];
- шкала гипотрофии-воспаления (malnutrition-inflammation score – MIS), разработанная К. Kalantar-Zadeh et al. [56];
- комплексная методика в модификации G.L. Bilbrey–T.L. Cohen [57];
- прогностический индекс гипотрофии (ПИГ), предложенный И.Е. Хорошиловым [58];
- возрастной индекс нутритивного риска (ВИНР) [59, 60].
СГО – простой и быстрый комплексный способ, позволяющий опытному врачу определить пищевой статус ПД-пациента на основании данных как субъективного, так и объективного анамнеза, а также на основании результатов физикального осмотра. Изначально метод предназначался для анализа пищевого статуса больных в предоперационном периоде, но позже был рекомендован и для больных ХБП. Для ПД-больных была разработана и апробирована модифицированная семибалльная система оценки пищевого статуса с анализом 7 параметров [61]. Общая оценка выражается в баллах от 0 (тяжелое нарушение пищевого статуса) до 7 (отсутствие нарушения питательного статуса) и не является средним значением всех показателей: 6–7 баллов – отсутствие нарушений пищевого статуса, 4–5 – легкая БЭН, менее 5 баллов – среднетяжелая-тяжелая БЭН. СГО характеризуется высокой чувствительностью и специфичностью. Именно результаты СГО, а также сывороточный альбумин явились предиктором летальности ПД-пациентов [62]. Очевидно, что СГО не представляет сложности для лечащего врача, она дешева в исполнении, легко воспроизводима, но, к сожалению, не лишена недостатков: во-первых, вследствие определенного субъективизма она более эффективна в «руках» одного клинициста, во-вторых, в ней отсутствует критерий, отражающий висцеральные белки организма.
Сказанное послужило отправной точкой для разработки К. Kalantar-Zadeh и соавт. [56] шкалы гипотрофии-воспаления (MIS): к семи параметрам, используемым в СГО, он добавил еще три объективных показателя – ИМТ, сывороточную концентрацию альбумина и общую железосвязывающую активность сыворотки крови (трансферрин). Каждый из параметров оценивается в баллах от 0 (норма) до 3 (тяжелое нарушение пищевого статуса) и общая оценка представляет их сумму: 0–5 баллов – нормальный пищевой статус, 6–10 – легкая БЭН, 11–20 – среднетяжелая БЭН и более 21 балла – тяжелая БЭН. Шкала гипотрофии-воспаления (MIS) предполагает участие в оценке пищевого статуса специалиста-диетолога, она достаточно трудоемка для исполнения и воспроизведения, а также требует дополнительного лабораторного обследования.
При использовании комплексной методики в модификации G.L. Bilbrey–T.L. Cohen [57] определяется 5 параметров, каждый из которых выражается в баллах от 0 (отсутствие нарушения пищевого статуса) до 3 (тяжелое нарушение пищевого статуса) в зависимости от отношения к общепринятым нормам. Общая оценка представляет сумму полученных баллов: 0–1 баллов – нормальный питательный статус, 2–5 – легкая БЭН и более 6 баллов – среднетяжелая-тяжелая БЭН.
Предложенный И.Е. Хорошиловым [58] ПИГ рассчитывается по формуле: ПИГ=140 – 1,5×(альбумин) – ОП – 0,5×(толщина КЖСТ) – 20×(лимфоциты) и выражается в %: 0–20% – нормальный пищевой статус, 21–30 – легкая БЭН и более 30% – среднетяжелая-тяжелая БЭН.

Последние два способа обладают высокой и сравнимой информативностью, и каждая из них может быть использована для мониторинга пищевого статуса, диагностики и оценки тяжести БЭН у ПД-больных. Однако и комплексная методика, и ПИГ достаточно трудоемки, требуют навыков антропометрии и дополнительного лабораторного обследования.
ВИНР был разработан для выявления нарушений пищевого статуса и определения прогноза для пожилых больных, находящихся на стационарном лечении. Позже японские исследователи показали высокую, сравнимую со шкалой гипотрофии–воспаления информативность ВИНР в определении риска развития нарушений пищевого статуса, а также его прогностическую значимость у гемодиализных больных [63, 64]. ВИНР рассчитывается всего по трем параметрам пациента – весу, росту и сывороточной концентрации альбумина: ВИНР=[14,89×альбумин (г/дл)]+41,7×[(масса тела/идеальная масса тела], где идеальная масса тела для женщин=рост (см) – 100 – [(рост – 152)×0,2] и идеальная масса тела для мужчин=рост (см) – 100 – [(рост – 152)×0,4]. ВИНР >98 – отсутствие риска развития нутритивных нарушений, ВИНР=92≤98 – низкая степень риска нутритивных нарушений и ВИНР <92 средняя и высокая степени риска.
На наш взгляд, ВИНР служит оптимальным и надежным комплексным способом оценки пищевого статуса у ПД-больных [60]. Проведенное нами исследование свидетельствуют о том, что ВИНР достаточно точно отражает разнообразные индивидуальные – антропометрические, биохимические, биоимпедансные – нутритивные параметры ПД-больных, а также служит прогностическим фактором. ПД-больные с ВИНР менее 92 имели худшие отдаленные результаты лечения: они быстрее нуждались в прекращении программы ПД (медиана продолжительности ПД – 8 месяцев против 17 у больных ВИНР≥92, р<0,001) и чаще умирали (1 случай на 30 пациенто-лет, против 1 случая на 55 пациенто-лет у больных ВИНР≥92, р<0,001). ВИНР также обнаруживает высокой степени корреляцию с общепринятыми комплексными способами оценки пищевого статуса – СГО, шкалой гипотрофии–воспаления, комплексной методикой и ПИГ. Он характеризуется простотой методики, высокой чувствительностью и информативностью, легкостью для повторных исследований, позволяет рано уловить изменяющуюся тенденцию пищевого статуса. ВИНР – недорогой метод анализа пищевого статуса у ПД-пациента, не требующий дорогостоящих лабораторных исследований (кроме стандартного определения сывороточной концентрации альбумина) и больших временных затрат для выполнения сложных антропометрических измерений. Погрешность при использовании ВИНР у ПД-больных, равно как и при использовании других способов оценки пищевого статуса, может быть связана с гипергидратацией, а следовательно, завышенным весом пациента. Рекомендуется оценивать массу тела и степень гидратации (отсутствие/наличие отечного синдрома) пациента совокупно. С той же целью целесообразно регулярное проведение биоимпедансометрического спектрального анализа (БИА) компонентного состава тела.
Нутритивные параметры, рекомендуемые для мониторинга пищевого статуса ПД-больных, их целевые значения и кратность выполнения представлены в табл. 6.
Оценку компонентного состава тела и соотношения жировой и мышечной тканей проводят путем либо антропометрии, либо с использованием инструментальных методов: БИА и двухфотонной рентгеновской абсорбциометрии (DEXA, Dual-emission X-ray absorptiometry). Необходимость динамического определения компонентного состава тела диктуется тем фактом, что у ПД-пациентов по мере лечения, как правило, наблюдается уменьшение мышечной массы и увеличение количества жировой клетчатки [2].
БИА – наиболее перспективный и оптимальный метод оценки компонентного состава тела у ПД-больных [65]. Он основан на различной электропроводности тканей вследствие разного содержания в них жидкости и электролитов. Мышечная ткань содержит много жидкости и электролитов и обладает хорошей электрической проводимостью; жировая масса, кости и кожа, наоборот, – плохой проводимостью и высоким сопротивлением. БИА характеризуется:
- неинвазивностью, надежностью, наличием компьютерного программного обеспечения, позволяющего проводить динамический, индивидуальный контроль в системе реального времени;
- высокой чувствительностью, точностью и хорошей воспроизводимостью;
- доступностью, простотой и удобством в обращении и безопасностью при многократном использовании;
- сопоставимой с другими способами оценки пищевого статуса информативностью;
- возможностью одновременной оценки водных секторов организма.
В настоящее время в России для проведения БИА доступны отечественный анализатор «АВС-01», немецкий прибор «ВСМ» (Body Composition Monitor/монитор состава тела) и др. Для повышения точности исследования ПД-пациентам БИА проводят после удаления диализирующего раствора из брюшной полости [66]. Сравнительный анализ показывает, что у ПД-больных разница между антропометрическим и биоимпедансным измерениями жировой и тощей массы тела может достигать нескольких килограммов, но в целом достоверность различий между обоими методами исследования отсутствует. БИА помимо информации о пищевом статусе дает одновременно полезную информацию и о степени гидратации пациента, позволяя критически оценивать его вес («сухой», идеальный, динамика веса) [67]. Поэтому при необходимости определения компонентного состава тела предпочтительнее использовать БИА, нежели антропометрию.
Метод DEXA основан на использовании рентгеновского излучения, которое поглощается различными тканями в разной степени. Оно обладает большей, чем антропометрия и БИА, точностью в определении компонентного состава тела, его результативность практически не зависит от гипергидратации. Однако DEXA является дорогостоящим и доступным для крупных клинических центров методом исследования, требующим специального оборудования, а также вызывающим лучевую нагрузку на организм [68].
Заключение
БЭН относится к достаточно распространенной сопутствующей патологии у больных ХБП, получающих заместительную терапию ПД. Она имеет многофакторное происхождение с различным вкладом того или иного патогенетического механизма. Анализ факторов, приводящих к формированию БЭН, важен в плане составления программы рационального ведения этих больных.
Существует масса разнообразных методик для диагностики БЭН у ПД-больных, однако идеальный маркер для оценки пищевого статуса пока не разработан. Предпочтение следует отдавать комплексным способам оценки пищевого статуса, включающим несколько разноплановых нутритивных параметров. Для клинициста важно – заключение о нарушении пищевого статуса на основании всего одного (любого!) исследования недопустимо; лишь динамическая оценка пищевого статуса позволит установить те или иные его отклонения.



