Разработаны Научным обществом нефрологов России и Ассоциацией нефрологов России
Рабочая группа по подготовке текста рекомендаций
Председатель
Кутырина И.М. – д.м.н., профессор, ведущий научный сотрудник НИО нефрологии научно-исследовательского центра ГБОУ ВПО «Первый МГМУ им. И.М. Сеченова» МЗ РФ, Москва
Ответственный секретарь
Швецов М.Ю. – к.м.н., в.н.с. НИО нефрологии научно-исследовательского центра ГБОУ ВПО «Первый МГМУ им. И.М. Сеченова» МЗ РФ
Члены рабочей группы:
Фомин В.В. – д.м.н., проф. кафедры внутренних профессиональных заболеваний и пульмонологии медико-профилактического факультета ВПО ГБОУ ВПО «Первый МГМУ им. И.М. Сеченова» МЗ РФ
Шестакова М.В. – чл.-корр. РАН, д.м.н., проф., директор Института диабета, зам. директора ФГБУ «Эндокринологический научный центр» МЗ РФ, зав. кафедрой детской эндокринологии и диабетологии педиатрического факультета ВПО ГБОУ ВПО «Первый МГМУ им. И.М. Сеченова» МЗ РФ
Шутов А.М. – д.м.н., проф., зав. кафедрой терапии и профессиональных болезней медицинского факультета ФГБОУ ВПО «Ульяновский государственный университет»
Цыгин А.Н. – д.м.н., проф., руководитель отделения нефрологии ФГБУ «Научный центр здоровья детей», Москва
Сокращения
- α-, β-АБ альфа- и бета-адреноблокатор
- α-АБ альфа-адреноблокатор
- β-АБ бета-адреноблокатор
- АГ артериальная гипертензия
- АД артериальное давление
- АК антагонист кальция (блокатор кальциевых каналов)
- АКд антагонист кальция дигидропиридинового ряда
- АКнд антагонист кальция недигидропиридинового ряда
- АУ альбуминурия
- БРА блокатор рецепторов ангиотензина II 1-го типа
- ДАД диастолическое артериальное давление
- ИАПФ ингибитор ангиотензинпревращающего фермента
- ИМТ индекс массы тела
- ИР ингибитор ренина
- НГ нет градации
- НПВП нестероидные противовоспалительные препараты
- ОПП острое почечное повреждение
- ОТ окружность талии
- ПУ протеинурия
- РААС ренин-ангиотензин-альдостероновая система
- РКИ рандомизированные клинические исследования
- САД систолическое артериальное давление
- СКАД самостоятельный контроль артериального давления пациентом
- СКФ скорость клубочковой фильтрации
- СМАД суточное автоматическое мониторирование артериального давления
- СНС степень ночного снижения АД
- СПА стеноз почечной артерии
- ССО сердечно-сосудистые осложнения
- ТПН терминальная почечная недостаточность
- УЗДГ ультразвуковая допплерография
- ХБП хроническая болезнь почек
- ХГН хронический гломерулонефрит
Введение
Между артериальной гипертензией (АГ) и хронической болезнью почек (ХБП) существует тесная взаимосвязь: с одной стороны, развитие ХБП и снижение функции почек приводят к повышению артериального давления (АД), с другой – наличие АГ связано со значительным ухудшением прогноза пациентов с ХБП из-за повышенного риска развития терминальной почечной недостаточности (ТПН) и сердечно-сосудистых осложнений (ССО).
Распространенность АГ при ХБП в 2–3 раза выше, чем в общей популяции. АГ, хотя и не входит в число диагностических критериев ХБП, является важным ее проявлением. Нередко повышение АД бывает первым симптомом, который заставляет пациента с ХБП обратиться к врачу и пройти обследование. Развитие АГ характерно для наиболее активных и тяжелых форм нефропатий; повышение АД или ухудшение ответа на антигипертензивную терапию может указывать на обострение заболевания почек или его прогрессирование.
В то же время уменьшение выраженности АГ свидетельствует об эффективности патогенетического лечения заболевания почек, послужившего ее причиной.
По данным популяционных исследований повышение АД, в первую очередь систолического, связано с увеличением риска ТПН независимо от возраста, пола и расы. Адекватная коррекция АГ достоверно отдаляет наступление ТПН. Неблагоприятное влияние АГ на риск ССО усиливается при наличии ХБП, взаимодействуя с почечными факторами риска ССО (снижение функции почек, нарушения фосфорно-кальциевого обмена и вторичный гиперпаратиреоз, анемия, хроническое воспаление, гиперурикемия и др.). Механизмы повышения АД при нефропатиях разной природы имеют свои особенности, определяемые их патогенезом. В то же время АГ может рассматриваться как универсальный фактор риска прогрессирования ХБП, а ее адекватное лечение является важной составляющей нефро/кардиопротективной стратегии.
Принципы оценки повышения АД и его коррекции, разработанные для эссенциальной АГ, не могут быть механически перенесены на пациентов с вторичной почечной АГ, которая имеет ряд особенностей. Наличие ХБП – повышенной альбуминурии/протеинурии и нарушения функции почек – меняет подходы к стратификации риска сердечно-сосудистых осложнений, определению целевого АД, выбору лекарственных препаратов и требует существенного пересмотра всей тактики антигипертензивной терапии. Вследствие этого проблема диагностики и лечения вторичной почечной АГ требует рассмотрения в рамках отдельных рекомендаций.
По современным представлениям, определять тактику коррекции АГ и оценивать ее эффективность следует в русле двуединой кардио/нефропротективной стратегии, направленной на снижение частоты ССО, представляющих основную причину гибели пациентов с ХБП, и на снижение риска развития ТПН. К сожалению, в исследованиях, проведенных в прошлые годы, не предусматривалось комбинированной оценки почечных и сердечно-сосудистых исходов.
Имеющиеся на сегодняшний день рандомизированные клинические исследования (РКИ) в основном посвящены оценке эффективности различных лекарственных препаратов в отдельных группах больных, сформированных в соответствии с определенными критериям отбора. Число исследований по определению целевых значений АД при ХБП, изучению комбинированной терапии почечной АГ невелико, а их результаты противоречивы, в связи с чем рекомендации, посвященные этим важнейшим вопросам, не обладают большой доказательностью и силой и постоянно пересматриваются. Для совершенствования тактики коррекции АГ при ХБП необходимы длительные обсервационные исследования, ценную информацию могут дать регистры ХБП.
Данные рекомендации являются продолжением серии клинических рекомендаций Научного общества нефрологов России (НОНР) и используют подходы к коррекции АГ при ХБП, сформулированные в международных и зарубежных национальных рекомендациях [5, 13, 16, 17, 22, 67, 71, 88, 92], отражают достижения российской науки в этой области медицины. Они согласуются с рекомендациями по диагностике и лечению АГ Российского медицинского общества по артериальной гипертонии Всероссийского научного общества кардиологов [23], учитывают опыт и современные воззрения, обобщенные в учебниках и руководствах.
Рекомендации адресованы нефрологам, а также кардиологам, эндокринологам, терапевтам, семейным врачам, врачам кабинетов медицинской профилактики и Центров здоровья, которые могут сталкиваться в своей практике с проблемой АГ у пациентов с ХБП.
1. Определения
Почечная АГ, самый частый вариант вторичной АГ, – синдром, который является проявлением заболевания почек, характеризуется повышением уровня АД (САД≥140 мм рт.ст. и/или АД диаст.≥90 мм рт.ст.), приводит к поражению сердечно-сосудистой системы и ускоряет прогрессирование ХБП.
Однако наиболее частой причиной сочетания повышенного АД и ХБП в популяции является не вторичная почечная АГ, а развитие гипертонической нефропатии у больных эссенциальной АГ. Возможно и развитие самостоятельного заболевания почек, например хронического гломерулонефрита (ХГН), у лиц, уже страдающих в течение ряда лет эссенциальной АГ. Вторичная почечная АГ имеет ряд особенностей, связанных с природой первичного заболевания почек и возможностью воздействовать на АГ путем проведения его патогенетической терапии (табл. 1).

Но в реальной клинической практике, когда отсутствуют данные о профилактических регулярных измерениях АД и достоверный нефрологический анамнез, дифференцировать разные варианты причинно-следственных связей между АГ и ХБП затруднительно или невозможно. Важно подчеркнуть, что с момента появления сочетания АГ и ХБП независимо от того, что послужило первопричиной, данные факторы начинают взаимодействовать по принципу «порочного круга»: наличие неконтролируемой АГ способствует дальнейшему повреждению почек, а прогрессирование ХБП приводит к появлению дополнительных причин повышения АД.
В соответствии с Российскими и международными рекомендациями по диагностике и лечению АГ [23, 88] выделяют несколько категорий нормального и повышенного АД (табл. 2).
Как показали клинические исследования, в подавляющем большинстве случаев ХБП уровни САД и ДАД либо соответствуют одной категории, либо имеется изолированная систолическая АГ. Изолированная диастолическая АГ встречается редко [31]. В процессе прогрессирования ХБП и снижения функции почек отмечается увеличение как САД, так и ДАД, но САД растет в большей мере – за счет ремоделирования и кальциноза магистральных артерий со снижением их эластичности вследствие нарушения фосфорно-кальциевого обмена и воздействия уремических токсинов. Таким образом, тяжесть АГ при ХБП в первую очередь определяет САД [36]. В соответствии с этим во многих клинических исследованиях, включающих пациентов с ХБП, уровень САД был использован в качестве основного целевого показателя.
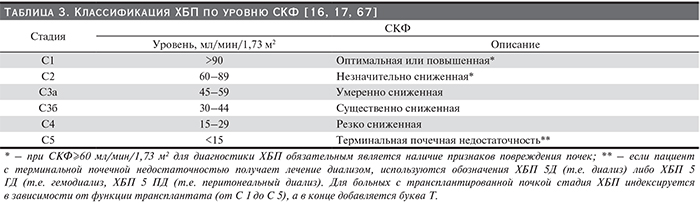
Хроническая болезнь почек (ХБП) – наднозологическое понятие, объединяющее всех пациентов с признаками повреждения почек или значительным снижением их функции (скорость клубочковой фильтрации ниже [СКФ] 60 мл/мин/1,73 м2), сохраняющимся в течение 3 и более месяцев [16, 17, 67].

2. Частота АГ при различных заболеваниях почек. Клиническое и прогностическое значение АГ у пациентов с ХБП
2.1. Трактовку АГ при ХБП следует проводить с учетом патогенетических особенностей заболевания почек, стадии ХБП и всего комплекса клинических проявлений. Наличие АГ, как правило, свидетельствует о более тяжелом течении нефропатии (НГ).
Частота АГ при ХБП 3–5-й стадий значительно выше, чем в общей популяции, и увеличивается по мере снижения функции почек. Связь АГ с СКФ показана в крупных популяционных исследованиях [101, 103]. На 1–2-й стадиях ХБП частота АГ составляет 40%, т.е. близка к частоте АГ в общей популяции. При СКФ ниже 60 мл/мин/1,73 м2 частота АГ резко увеличивается и при СКФ ниже 30 мл/мин/1,73 м2 достигает 75%, а у больных ТПН до начала проведения заместительной почечной терапии (ЗПТ) превышает 90%. Это связано со снижением функции почек, приводящим к неадекватной экскреции натрия, дисбалансу почечных прессорных, депрессорных гормональных систем и развитием новых дополнительных причин повышения АД, характерных для поздних стадий ХБП: кальцинозом и склерозом артерий, эндотелиальной дисфункции и повреждения вследствие нарушения элиминации почками воспалительных цитокинов, усугубления нарушений липидного и пуринового обменов, анемии [121].
Частота и выраженность АГ зависят от нозологического диагноза, особенно на ранних стадиях ХБП. АГ занимает важное место в клинической картине различных заболеваний почек, отражает их активность и особенности течения [3, 10, 11, 102].
Наиболее высокая частота АГ отмечается при сосудистых нефропатиях (ишемической болезни почек, тромботических микроангиопатиях) – 80–90%. АГ развивается на ранних стадиях заболевания, нередко является первым клиническим проявлением поражения почек. Тяжесть АГ, как правило, отражает выраженность ишемии почечной ткани и коррелирует со снижением СКФ. АД и СКФ на ранних стадиях могут быть нормализованы при улучшении почечного кровотока. На поздней стадии заболевания спонтанная нормализация АД может быть признаком снижения функции сердца и предвестником острой левожелудочковой недостаточности. Для сочетания выраженной АГ, раннего, потенциально обратимого снижения СКФ и минимальной протеинурии как характерного для сосудистых нефропатий симптомокомплекса в последние годы предложено название «синдром ишемической (сосудистой) нефропатии».
У пациентов с ХБП при сахарном диабете частота АГ достигает 70–85% [6]. Высокий уровень АД отражает как тяжесть поражения почек, так и выраженность метаболических нарушений, в первую очередь ожирения. Кроме того, тяжелая АГ нередко является проявлением атеросклероза почечных артерий и сосудов головного мозга, характерным для больных сахарным диабетом, но может развиваться независимо от наличия и течения диабетической нефропатии [6, 24].
При первичном и вторичных гломерулонефритах АГ встречается в 60–70% случаев [11, 20]. Развитие АГ на ранних стадиях нефрита в сочетании с гематурией входит в понятие «остронефритический синдром», который отражает активность нефрита. Развитие АГ на ранних стадиях ХГН нередко сочетается со снижением функции почек; при этом оба нарушения потенциально обратимы в случае успешной иммуносупрессивной терапии. Корреляции АД с уровнем протеинурии не наблюдается: у больных с массивной протеинурией и нефротическим синдромом может быть нормальное АД или склонность к гипотензии. Однако сочетание нефротического синдрома с АГ более неблагоприятно для прогноза, чем изолированный нефротический синдром. Частота АГ при разных морфологических вариантах ХГН варьируется в широких пределах. Она наиболее высока при экстракапиллярном (нефрите с полулуниями) и мембранопролиферативном вариантах ХГН (более 85%), несколько реже – при фокально-сегментарном гломерулосклерозе, мезангиопролиферативном гломерулонефрите и мембранозной нефропатии (60–80%). Значительно реже АГ встречается при болезни минимальных изменений (40–60%), она характерна для поздней стадии данного морфологического варианта ХГН.
Самая низкая частота АГ (20–35%) наблюдается при хроническом тубулоинтерстициальном нефрите и амилоидозе почек (при AL-амилоидозе возможна тяжелая гипотензия, связанная с отложением амилоида в надпочечниках и симпатических ганглиях). Развитие АГ при этих заболеваниях наблюдается на поздних стадиях, когда имеется выраженное нарушение функции почек.
2.2. АГ при ХБП следует рассматривать как прогностически неблагоприятный фактор, повышающий риск развития ТПН и сердечно-сосудистых осложнений (1A).
Методика стратификации комбинированного риска развития ТПН и ССО, предложенная экспертами KDIGO [67], строится на определении категорий снижения функции почек и альбуминурии и не предусматривает оценку уровня АД. Однако это не означает отрицания роли АГ в прогрессировании ХБП и как фактора высокого сердечно-сосудистого риска. Напротив, в условиях олигонефронии (дефицита функционально активной почечной ткани), приводящей к нарушению работы почек по выведению натрия, воспалительных цитокинов и других факторов, повреждающих эндотелий, даже высокое нормальное АД может оказывать неблагоприятное воздействие на почки и сердечно-сосудистую систему.
У людей без ХБП система саморегуляции почечного кровотока препятствует передаче системной АГ на почечные клубочки за счет адекватного сужения прегломерулярных почечных сосудов мышечного типа. При эссенциальной гипертонии в результате работы этих механизмов почки поражаются значительно позже других органов-мишеней. При вторичной почечной АГ отмечается гиперактивация ренин-ангиотензиновой (РАС), симпато-адреналовой систем, гиперпродукция эндотелиального релаксирующего фактора (NO), что приводит к дисрегуляции почечного кровотока, проявляющейся дилатацией прегломерулярных сосудов мышечного типа и сужением выносящих артериол. В результате развивается гиперперфузия почечных клубочков и клубочковая гипертензия. Даже незначительное повышение системного АД усугубляет клубочковую гипертензию, приводя к повреждению почечного эндотелия, гломеруломегалии, сопровождающейся перерастяжением мезангия и повреждением подоцитов с формированием гломерулосклероза. На ранних стадиях ХБП нарушения почечного кровотока носят функциональный и потенциально обратимый характер. Прогрессирование нефросклероза и длительное повреждающее воздействие системной АГ на почечные сосуды мышечного типа ведут к развитию артериолосклероза, в результате чего происходит необратимая утрата их способности регулировать перфузию клубочков и защищать их от гемодинамического повреждения при повышенном системном АД.
Данные о неблагоприятном влиянии высокого АД на почки получены в крупных популяционных исследованиях, однако они касаются в первую очередь пациентов с эссенциальной гипертонией. Влияние вторичной почечной АГ на прогрессирование ХБП оценить труднее, поскольку она взаимодействует с рядом прогностических факторов. По данным проведенных клинических исследований больных ХГН, сахарным диабетом, поликистозной болезнью почек, было показано, что уровень АД независимым образом влияет на риск дальнейшего ухудшения функции почек [20, 82]. Исследования о влиянии АГ на риск ССО у пациентов с ХБП также показывают ее неблагоприятное прогностическое значение, а коррекция АГ, по данным отдельных исследований, при первичных нефропатиях приводит к улучшению прогноза [112, 126], однако доказательная база невелика.
3. Тактика обследования пациентов с АГ при ХБП
3.1. Основу диагностики АГ при ХБП составляет измерение АД врачом или другим медицинским работником методом Н.С. Короткова в условиях покоя (НГ).
Повторные измерения АД врачом на сегодняшний день остаются наиболее достоверным методом диагностики АГ, по которому имеется наибольшая доказательная база. Измерение АД при ХБП проводится в условиях относительного покоя (в положении сидя после 5-минутного отдыха) в соответствии с методикой, описанной в Национальных рекомендациях по диагностике и лечению АГ [23]. Для оценки уровня АД на каждой руке следует выполнять не менее двух измерений с интервалом не менее 1 минуты; при разнице АД≥5 мм рт.ст. производят одно дополнительное измерение; за конечное (регистрируемое) значение принимают минимальное из трех измерений.
При подозрении на поражение периферических сосудов (в рамках системного васкулита, атеросклероза и т.д.) АД и пульс определяют на руках и ногах.
Учитывая высокий риск ортостатической гипотензии у пациентов с ХБП, измерение АД в стандартных условиях рекомендуется периодически дополнять измерением в вертикальном положении тела сразу после вставания. Если после вставания САД снижается на 20 и более мм рт.ст. и/или ДАД снижается на 10 и более мм рт.ст., это определяется как ортостатическая (постуральная) гипотензия. Особо важное значение данная проба имеет в период подбора антигипертензивной терапии, при назначении альфа-адреноблокаторов и других средств, которые могут вызывать резкое снижение АД.
3.2. Измерение АД является обязательным исследованием при каждом осмотре пациента с ХБП терапевтом, нефрологом или врачом другой специальности (НГ).
Измерение АД входит в число обязательных исследований пациента с ХБП. Разовое обнаружение повышенных цифр АД недостаточно для диагностики АД, оно должно получить подтверждение при 2–3 повторных измерениях.

Необходимость многократных измерений у пациента с диагностированной АГ обусловлена высокой лабильностью цифр АД, которая может усиливаться на поздних стадиях ХБП вследствие гиперактивации симпато-адреналовой системы, тяжелой эндотелиальной дисфункции, нарушения работы барорецепторов, ремоделирования сердечно-сосудистой системы и других причин. Изменение течения ХБП, необходимость точной оценки ответа на патогенетическое лечение заболевания почек и антигипертензивную терапию также требуют регулярных измерений АД. Недостаточно частые измерения могут быть причиной как недостаточной эффективности антигипертензивной терапии (из-за недооценки тяжести АГ и недостижения целевых показателей АД), так и ее осложнений, обусловленных развитием эпизодов гипотензии.
Цифры АД должны указываться в протоколе врачебного осмотра. В эпикризе и другой медицинской документации, отражающей состояние пациента за длительный период времени, следует приводить наиболее типичное, а также максимальное и минимальное значения АД за время наблюдения. Если за период наблюдения происходили изменения выраженности повышения АД на фоне терапии или вследствие прогрессирования заболевания почек, эти изменения также должны отражаться в медицинской документации.
3.3. Суточное мониторирование АД (СМАД), а также регулярный самостоятельный контроль АД пациентом (СКАД) существенно расширяют возможности диагностики АГ, помогают в оценке эффективности и безопасности антигипертензивной терапии при ХБП и должны по возможности дополнять измерения АД врачом (НГ).
СМАД и СКАД дают более полное и точное представление о состоянии системы регуляции АД и тяжести АГ, позволяют оценивать АД в естественных для пациента условиях вне медицинского окружения, выявлять кратковременные подъемы АД колебания АД на фоне привычных нагрузок, эпизоды гипотензии на фоне лечения, приводящие к ишемии сердца, головного мозга и почек. СМАД, кроме того, позволяет диагностировать феномен гипертонии и гипотензии в период сна, оценивать показатели суточного ритма АД, имеющие самостоятельное прогностическое значение при ХБП [12, 43].
Критерии диагностики АГ по результатам измерений АД, сделанных врачом, полученных самим пациентом в домашних условиях, и СМАД различны (табл. 5). Изолированная клиническая АГ (т.н. феномен гипертонии на белый халат, т.е. несовпадение данных измерений АД врачом, показывающих повышенные значения, и самоизмерений АД пациентом в домашних условиях или СМАД, показывающих нормальные значения) при наличии ХБП следует рассматривать как состояние, не требующее назначения антигипертензивных препаратов [23, 88].
Изолированная амбулаторная АГ (или «скрытая гипертония», т.е. несовпадение данных измерений АД врачом, показывающих нормальные значения, и самоизмерений АД пациентом в домашних условиях или СМАД, показывающих повышенные значения) независимо от наличия ХБП является состоянием, связанным с повышенным риском ССО; тактика лечения строится, как при обычной АГ [23, 88].
Среднее дневное (среднее значение АД за период бодрствования) и среднее ночное АД (среднее значение АД за период ночного сна) – показатели СМАД с лучшей воспроизводимостью по сравнению с данными разовых измерений АД врачом и более четко коррелирующие с неблагоприятным прогнозом со стороны почек и сердечно-сосудистой системы [12, 43].
Степень ночного снижения (СНС) АД рассчитывается по формуле: (АДср. дневное–АДср. ночное)х100%/АДср. дневное.
У здоровых лиц в ночные часы отмечается физиологическое снижение АД на 10–22% от среднедневного уровня. Недостаточная СНС (<10%) встречается с высокой частотой на поздних стадиях ХБП и связана с повышенным риском ее прогрессирования. Избыточное снижение АД в ночные часы (>22%) также является неблагоприятным вариантом нарушения суточного ритма, поскольку связано с развитием ночной гипотензии, приводящей к гипоксическому повреждению сердца, головного мозга, почек и вызывает компенсаторную гиперактивацию вазопрессорных механизмов в период бодрствования. Дополнительные показатели вариабельности АД (стандартное отклонение от средних значений, скорость утреннего подъема) у пациентов с ХБП могут свидетельствовать о гиперактивации симпато-адреналовой системы, особенно характерной для поздних стадий ХБП, однако их клиническое и прогностическое значения требуют уточнения.
Учитывая значительное повышение сердечно-сосудистого риска и нестабильность АД, нарушение физиологического снижения АД в ночные часы при ХБП, коррелирующие со степенью снижения СКФ [12, 19, 81], наличие ХБП служат показанием к проведению СМАД у пациентов с признаками АГ по данным измерений врачом или при подозрении на изолированную амбулаторную АГ (при нормальном уровне АД при измерении врачом, но повышенных его значениях при СКАД или наличии гипертрофии миокарда левого желудочка, гипертонической ретинопатии): при первичном обследовании, в дальнейшем – один раз в год или при изменении течения АГ и ответа на терапию (резком нарастании тяжести АГ, развитии резистентности к лечению, появлении нестабильности АД по данным самоизмерений, появлении симптомов гипотензии).
Проведение СМАД не исключает необходимость регулярного СКАД пациентом. Для СКАД рекомендуются аппараты с осциллометрическим принципом измерения АД с манжетой, накладываемой на плечо, удобные для самоконтроля и не требующие специальных навыков измерения. Однако от врача требуется убедиться в правильности самоизмерения АД пациентом, проконтролировав его технику и проведя контрольное измерение методом Н.С. Короткова; при необходимости провести его обучение. Больные ХБП с наличием АГ должны самостоятельно контролировать АД не реже 2 раз в сутки. Полученные результаты следует фиксировать в дневнике самоконтроля и представлять лечащему врачу при каждом обследовании. На основании результатов СКАД и контрольного измерения АД врачом выносится заключение об эффективности антигипертензивной терапии, ее адекватности определенным для данного больного целевым значениям АД.

3.4. Сочетание ХБП и АГ требует исключения реноваскулярной болезни, которая может как быть первой причиной повышения АД и нарушения функции почек, так и развиваться на фоне уже существующей АГ и ХБП (НГ).
К наиболее частым причинам поражения почечных артерий относятся атеросклероз и фибромускулярная дисплазия; более редкие причины – системные васкулиты, антифосфолипидный синдром. Бессимптомный атеросклеротический стеноз почечной артерии (СПА) встречается у 1,7% условно здорового населения, фибромускулярная дисплазия – у 6,6% [93]. Среди лиц с резистентной АГ частота СПА достигает 20% [63].
Атеросклеротический СПА является одной из ведущих причин ТПН у пожилых. В то же время наличие снижения функции почек, сахарного диабета [24] служит фактором риска ускоренного развития атеросклероза. Таким образом, ишемическая болезнь почек может развиваться на фоне уже существующих АГ и ХБП как новая причина повышения АД и падения СКФ, существенно ухудшая прогноз и меняя подходы к лечению.
Оценка наличия факторов риска реноваскулярной болезни (табл. 6) должна проводиться как у лиц с впервые выявленной АГ, так и у пациентов с длительным анамнезом повышения АД и ХБП, особенно в случаях изменения характера АГ [9]. Лицам, входящим в группу высокого риска реноваскулярной болезни, показано проведение ультразвуковой допплерографии (УЗДГ) как неинвазивного и безопасного метода исследования почечных сосудов. При обнаружении признаков гемодинамически значимого СПА по данным УЗДГ и высокой вероятности успеха ангиопластики (см. Рекомендации по консервативному ведению реноваскулярной артериальной гипертонии и ишемической болезни почек) необходимо направлять пациента в Центр сосудистой хирургии, где проводятся рентгеноконтрастные исследования или МРТ-ангиография для верификации диагноза и определения тактики хирургического лечения.
3.5. Обследование пациента с АГ при ХБП включает комплекс физических, лабораторных и инструментальных методов, который определяется особенностями ХБП, задачами уточнения причин и факторов риска повышения АД, оценки состояния органов-мишеней АГ и риска сердечно-сосудистых осложнений (НГ).
План обследования пациента с АГ при ХБП строится на основе рекомендаций по ведению данной нозологической формы ХБП, а также отражает задачи уточнения причин повышения АД, оценки риска ССО и разработки тактики его снижения. В ряде случаев АГ является первым симптомом системного аутоиммунного заболевания, заставившим пациента обратиться к врачу. Впервые выявленное сочетание АГ, прогрессирующего снижения функции почек и мочевого синдрома (который нередко носит умеренный характер) требует специального исследования для исключения системной красной волчанки, системного васкулита, антифосфолипидного синдрома (антител к нативной ДНК, антинуклеарных антител, С3- и С4-фракций комплемента, антител к цитоплазме нейтрофилов, антител к кардиолипину, антител к бета2-гликопротеину 1-го типа, волчаночного антикоагулянта).
Повышение АД и риска ССО при ХБП, как правило, обусловлено рядом факторов – как общепопуляционных (злоупотребление солью, сахарный диабет, ожирение, гиперлипидемия, курение), так и связанных с заболеванием почек (снижение СКФ, нарушения фосфорно-кальциевого обмена, анемия и хроническое воспаление, синдром белково-энергетической недостаточности), многие из которых изменяемы. Комплексное обследование, учитывающее их во всей совокупности, служит важным условием правильной оценки прогноза и разработки оптимальной стратегии кардио/нефропротективной терапии. Общие принципы обследования больного АГ, изложенные в Национальных рекомендациях по диагностике и лечению АГ [23], применимы и к пациентам с ХБП. Однако существует ряд особенностей в подходах к обследованию пациентов с АГ при ХБП, в первую очередь стадий С3–5, когда на первый план выходят специфические почечные факторы сердечно-сосудистого риска, резко повышается частота ССО и существенно меняется их спектр.
Для выявления ведущих причин АГ необходимы тщательное изучение анамнеза, сопоставление сроков выявления АГ и ХБП, оценка изменения выраженности повышения АД и чувствительности к антигипертензивным препаратам на фоне этиотропной и патогенетической терапии заболевания почек. При физическом и инструментальном исследовании особое внимание уделяют состоянию центральных и периферических сосудов, учитывая развитие ремоделирования магистральных артерий и раннего атеросклероза у пациентов с ХБП (табл. 7).

Большое значение имеет диагностика нарушений обмена веществ, спектр которых на поздних стадиях ХБП значительно расширяется. Наличие протеинурии, при этом развитии синдрома белково-энергетической недостаточности, проявляющееся низким ИМТ, дефицитом жировой и мышечной ткани, гипоальбуминемией, может иметь более неблагоприятное значение, чем избыточное питание.
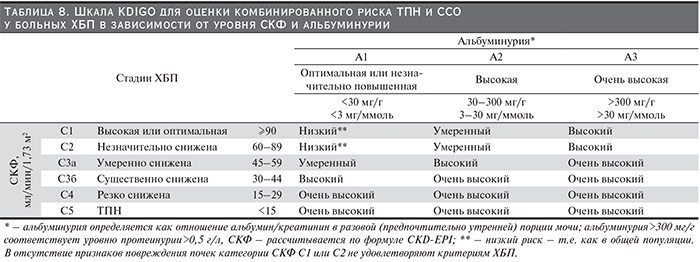
3.6. Наличие АГ, степень повышения АД и риск ССО отражаются в диагнозе пациента после указания нозологической формы ХБП, ее стадии (табл. 3) и категории альбуминурии/протеинурии (табл. 4). Стратификация риска ССО проводится с учетом СКФ и альбуминурии/протеинурии (табл. 8) (НГ).
Стратификация риска ССО при ХБП имеет свои особенности. Использование шкалы SCORE или Фремингемской методики расчета сердечно-сосудистого риска при ХБП дает неправильные (существенно заниженные по сравнению с реальными исходами больных) результаты [124]. Рекомендуется использовать систему стратификации комбинированного риска ТПН и ССО у больных ХБП, разработанную экспертной группой KDIGO (Kidney Disease: Improving Global Outcomes) [67], которая базируется на двух основных показателях – уровне СКФ и категории альбуминурии/протеинурии (табл. 8).
Написанию рекомендаций KDIGO по ведению ХБП, ставших важной вехой в развитии концепции ХБП, предшествовал мета-анализ 45 когорт, включивших представителей общей популяции, групп риска ХБП, людей с выявленной ХБП – в общей сложности 1 555 332 человека [78]. С высокой степенью доказательности было установлено, что при СКФ ниже 60 мл/мин/1,73 м2 отмечается резкое повышение смертности и риска неблагоприятных почечных исходов, что существует прямая связь между выраженностью альбуминурии и риском ССО и ТПН, что пациенты с одной и той же стадией ХБП характеризуются более неблагоприятным прогнозом при более выраженной альбуминурии, причем эти закономерности отмечаются у лиц как моложе, так и старше 65 лет. На основании этого исследования экспертная группа KDIGO подтвердила, что альбуминурия 30–300 мг/г (т.е. в пределах, когда тест на протеинурию может быть слабоположительным или отрицательным) имеет неблагоприятное значение и служит достоверным критерием ХБП. Более того, повышение общей и сердечно-сосудистой смертности было отмечено даже при альбуминурии 10–29 по сравнению с категорией <10 мг/г.
Серия опубликованных в последующем мета-анализов показала, что неблагоприятное влияние на риск развития ТПН и ССО СКФ ниже 60 мл/мин/1,73 м2 и повышения альбуминурии проявляется вне зависимости от возраста, пола, наличия артериальной гипертонии и сахарного диабета [52, 58, 86, 94].
Ключевое значение величины СКФ и альбуминурии/протеинурии для оценки риска развития ТПН и ССО у пациентов с ХБП не умаляет важности коррекции АГ для улучшения общего и почечного прогноза. При этом уровень альбуминурии/протеинурии служит определяющим критерием индивидуального выбора целевого АД и антигипертензивных препаратов.
4. Целевое АД у пациентов с АГ при ХБП
4.1. Определение целевого АД и тактика ведения пациентов с АГ при ХБП должны быть подчинены общим задачам кардио/нефропротекции и индивидуализированы с учетом возраста, нозологической формы ХБП, выраженности альбуминурии/протеинурии, функции почек, наличия сердечно-сосудистых заболеваний и метаболических нарушений (НГ).
По современным представлениям, определять тактику коррекции АГ и оценивать ее эффективность следует в русле двуединой кардио/нефропротективной стратегии, направленной на снижение частоты ССО, представляющих основную причину гибели пациентов с ХБП, и на снижение риска развития ТПН [14, 17]. Существуют рациональные аргументы в пользу более строгого контроля АД при АГ, связанной с ХБП, как с точки зрения задач нефропротекции, поскольку вследствие нарушений ауторегуляции почечного кровотока даже начальное повышение АД вызывает клубочковую гипертензию и развитие гломерулосклероза, так и кардиопротекции, поскольку ХБП является доказанным фактором повышенного риска ССО. Однако наличие ХБП связано с повышением резистентности к лечению, а также существенным повышением риска побочных эффектов антигипертензивных препаратов. По этим двум причинам задача более строгого контроля АД при ХБП может быть трудновыполнимой и связанной с серьезными осложнениями.
На сегодня становится очевидным, что пациенты с ХБП – гетерогенная группа, по-разному отвечающая на антигипертензивную терапию. Преимущества более строгого контроля АД, определенных классов антигипертензивных препаратов, чувствительность к терапии, снижающей АД, ее переносимость и безопасность – на все эти важнейшие характеристики, от которых зависит тактика лечения, влияет целый ряд факторов.

Возраст, величина альбуминурии/протеинурии и степень снижения функции, определяющие риск ССО, наличие сахарного диабета, ожирения – важнейшие из них. Наличие нарушений мозгового кровообращения, ишемической болезни сердца, нарушений ритма необходимо учитывать при выборе целевого АД и антигипертензивных препаратов в соответствии с Национальными рекомендациями по контролю АГ [23]. Нарушения липидного и пуринового обменов связаны с высоким риском ССО, резистентностью к антигипертензивным препаратам, повышенным риском их побочных действий [16, 22].
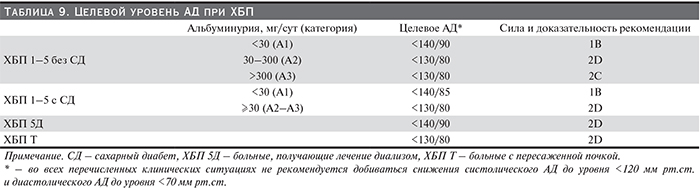
4.2. Больным ХБП без сахарного диабета с нормальной или незначительно повышенной альбуминурией (категория А1) рекомендуется начинать лечение препаратами, снижающими АД, при стойком повышении САД≥140 или ДАД≥90 мм рт.ст. и добиваться достижения уровня САД<140 и ДАД<90 мм рт.ст. (табл. 9) (1В).
4.3. Больным ХБП без сахарного диабета с высокой альбуминурией (категория А2) целесообразно начинать лечение препаратами, снижающими АД, при стойком повышении САД≥130 или ДАД≥80 мм рт.ст. и добиваться достижения уровня САД<130 и ДАД<80 мм рт.ст. (2D).
4.4. Больным ХБП без сахарного диабета с очень высокой альбуминурией и/или протеинурией >0,5 г/сут (категория А3) целесообразно начинать лечение препаратами, снижающими АД, при стойком повышении САД≥130 или ДАД≥80 мм рт.ст. и добиваться достижения уровня САД<130 и ДАД<80 мм рт.ст. (2С).
4.5. Больным ХБП и сахарным диабетом с нормальной или незначительно повышенной альбуминурией (категория А1) рекомендуется начинать лечение препаратами, снижающими АД, при стойком повышении САД≥140 или ДАД≥85 мм рт.ст. и добиваться достижения уровня САД<140 и ДАД<85 мм рт.ст. (1В).
4.6. Больным ХБП и сахарным диабетом с высокой и очень высокой альбуминурией и/или протеинурией >0,5 г/сут (категории А2 и A3) целесообразно начинать лечение препаратами, снижающими АД, при стойком повышении САД≥130 или ДАД≥80 мм рт.ст. и добиваться достижения уровня САД<130 и ДАД<80 мм рт.ст. (2D).
4.7. Независимо от этиологии ХБП и уровня альбуминурии/протеинурии не рекомендуется добиваться снижения систолического АД до уровня <120 мм рт.ст. и диастолического АД до уровня <70 мм рт.ст. (НГ).
4.8. Важнейшим условием эффективности и безопасности терапии, снижающей АД, для пациентов с ХБП является регулярный контроль переносимости лечения, стабильности достигнутых результатов, выявление резких колебаний АД, эпизодов ортостатической и ночной гипотензии по данным СКАД, СМАД (по возможности) и измерений АД врачом в ортостатической пробе (НГ).
4.9. Обеспечение хорошей индивидуальной переносимости антигипертензивной терапии и исключение эпизодов гипотензии у пациентов с ХБП приоритетно по отношению к задаче снижения АД до целевого уровня (НГ).
4.10. При плохой переносимости антигипертензивной терапии пациентов с ХБП необходима коррекция целевого уровня АД в сторону более высоких значений: если первоначально целевой уровень САД определялся <130 мм рт.ст., то при плохой переносимости он должен быть повышен до 130–139 мм рт.ст.; при плохой переносимости целевого уровня САД<140 мм рт.ст. он должен быть повышен до 140–149 мм рт.ст. (НГ)
4.11. Достижение целевого уровня АД при ХБП должно проводиться постепенно с регулярным контролем переносимости антигипертензивной терапии, что важно как для повышения безопасности терапии, так и для хорошей приверженности лечению со стороны пациентов (НГ).
Идея о целесообразности снижения АД до уровня ниже высокого нормального с целью предотвращения развития ТПН была основана на результатах эпидемиологических исследований. Так, исследование MRFIT (332 544 мужчины, средняя длительность наблюдения – 16 лет) показало, что у лиц с высоким нормальным АД риск ТПН в 1,9 раза выше, чем у лиц с оптимальным АД (<120/80 мм рт.ст.) [73]. Интервенционное исследование MDRD, в котором было изучено влияние сочетания малобелковой диеты и строгого контроля АД на скорость снижения функции почек, показало, что более строгий контроль АД по сравнению со стандартной терапией (АД<140/90 мм рт. ст.) снижал риск ТПН у больных выраженной протеинурией [74], что нашло отражение в многочисленных рекомендациях по контролю АД [23, 41, 48, 92].
Однако положение о необходимости более строгого (<130/80 мм рт.ст.) контроля АД при ХБП до настоящего времени остается недоказанным. Оценка отдаленных исходов вне рамок основного исследования MDRD, а также других исследований по контролю АД при ХБП не показала достоверных различий по риску неблагоприятного почечного исхода у больных с более строгим контролем АД [29, 107, 110]. По данным мета-анализа, включившего 37 348 больных, более интенсивный контроль АД оказывал дополнительное вазопротективное действие, однако не уменьшал смертность пациентов с ХБП [85].
У больных сахарным диабетом в исследовании United Kingdom Prospective Diabetes Study (UKPDS) [118] были установлены преимущества более строгого контроля АД в отношении риска ССО. В исследовании Hypertension Optimal Treatment (HOT) [59] также было показано, что достижение уровня ДАД<85 мм рт.ст. сопровождается улучшением прогноза больных сахарным диабетом за счет снижения риска ССО. На основании данных исследований современные европейские рекомендации по контролю АГ [88] определяют целевой уровень ДАД у больных сахарным диабетом<85 мм рт.ст.
Исследование ACCORD, где сравнивалась эффективность более строгого (<130 мм рт.ст.) контроля САД по сравнению с 130–140 мм рт.ст. у больных сахарным диабетом [44], а также мета-анализ, посвященный результатам традиционного и более строгого контроля АД у больных сахарным диабетом [30], не показали преимуществ более агрессивной тактики.
Современные американские рекомендации по контролю АД [65, 123] и ведению пациентов с ХБП С1–3 [100] в отличие от более ранних не предусматривают более строгого контроля АД при ХБП. В то же время рекомендации KDIGO по контролю АГ при ХБП, рекомендации-2013 Европейского общества кардиологов 2013 г. и Российские рекомендации по кардионефропротекции не исключают попытку достижения АД ниже 130/80 мм рт.ст. при хорошей переносимости [17, 71, 88].
Сохраняющаяся неопределенность относительно целевого уровня АД при ХБП – одного из важнейших вопросов нефропротективной стратегии – объясняется прежде всего малой доказательной базой, особенно касающейся пациентов с выраженной протеинурией. Значительная неоднородность пациентов с ХБП, многообразие факторов, влияющих на их общий и почечный прогноз, затрудняют анализ результатов клинических исследований. Для доказательства пользы и безопасности строгого контроля АД при ХБП требуются РКИ, включающие очень большое число пациентов и предусматривающие многолетнее наблюдение.
Важным требованием к РКИ, направленным на уточнение уровня целевого АД при ХБП, является комплексный анализ неблагоприятных почечных и сердечно-сосудистых исходов. Имеются данные, согласно которым более строгий контроль АГ с момента ее выявления даже если и не влияет на риск развития ТПН, но улучшает выживаемость пациентов за счет снижения риска ССО на стадии проведения ЗПТ [76].
Наиболее часто применяемыми средствами для снижения АД при ХБП являются ИАПФ и БРА, обладающие помимо антигипертензивного антипротеинурическим и нефропротективным действиями, кроме того, назначаются малобелковая диета и другие компоненты нефропротективного лечения. Поэтому оценить самостоятельный вклад достижения целевого АД в улучшение прогноза представляет сложную задачу. Кроме того, строгого контроля АД удается достичь лишь 20–50% пациентов с ХБП из-за высокой частоты резистентности к лечению, а больным пожилого возраста, составляющим большую долю лиц с ХБП, строгий контроль АД может быть опасен из-за риска сердечно-сосудистых осложнений.
Установленным на сегодня фактором, существенно влияющим на эффективность строгого контроля АД при ХБП, является уровень протеинурии [74]. Длительное наблюдение за лицами, входившими в исследование AASK, хотя не установило преимуществ более строгого контроля АД в целом по группе, однако показало их в подгруппе лиц с выраженной протеинурией [29]. Значение исходного уровня протеинурии для целесообразности более низкого целевого АД при ХБП с точки зрения почечных исходов показал и мета-анализ [84].
Таким образом, для всех пациентов с ХБП не вызывает сомнений необходимость снижения АД до уровня ниже 140/90 мм рт.ст. (за исключением больных сахарным диабетом, у которых была доказана целесообразность снижения ДАД до уровня ниже 85 мм рт.ст. [59, 118], и особых возрастных групп – см. главы «Принципы лечения АГ при ХБП у детей и подростков» и «Принципы лечения АГ при ХБП у пациентов пожилого и старческого возраста»). Для больных высокой и очень высокой альбуминурией/протеинурией, составляющих прогностически наиболее неблагоприятную группу, представляется целесообразной, несмотря на малую доказательную базу, попытка достижения АД ниже 130/80 мм рт.ст. при условии хорошей переносимости (табл. 9).
Вопрос о нижнем пределе оптимальных значений АД при ХБП, крайне важный для обеспечения безопасности терапии, недостаточно отражен в современных рекомендациях также из-за малой доказательной базы. В рекомендациях KDOQI по контролю АД при ХБП [92] обозначена нижняя граница оптимальных значений САД – 110 мм рт.ст. на основе данных завершенного незадолго до их написания мета-анализа, показавшего, что в отношении функции почек неблагоприятны цифры систолического АД как выше 130, так и ниже 110 мм рт.ст. [64]. При низких цифрах АД вследствие централизации кровотока развивается ишемия почек, приводящая к их повреждению. Роль гипоксии как самостоятельного фактора прогрессирования ХБП обсуждается в литературе [49, 91], однако на сегодня, к сожалению, отсутствуют доступные и достоверные методы, позволяющие мониторировать изменения внутрипочечной гемодинамики на фоне антигипертензивной терапии.
Вторичный анализ результатов исследований Atherosclerosis Risk in Communities Study (ARIC) и Cardiovascular Health Study (CHS) [125], посвященный риску ССО при ХБП в зависимости от уровня АД, выявил J-образную зависимость между ними: риск сосудистых катастроф был достоверно выше при САД как выше 130, так и ниже 120 по сравнению с диапазоном 120–130 мм рт.ст., признанный авторами оптимальным при ХБП.
Большое значение для выявления нестабильности АД на фоне терапии эпизодов гипотензии имеет СМАД, а также самоконтроль. Стремление достичь целевого уровня АД не должно приводить к эпизодам гипотензии, чреватым не только ухудшением коронарного и церебрального кровотока, но и развитием ишемии почек.
Достижение целевого АД должно проводиться постепенно (при 2–3-й степенях повышения АД – в срок от нескольких недель до нескольких месяцев) с использованием СКАД, СМАД (по возможности), под контролем динамики креатинина и калия сыворотки крови, избегая эпизодов гипотензии, плохого самочувствия. Постепенность снижения АД способствует лучшей переносимости терапии и повышению приверженности пациентов. Кроме того, при постепенном подходе к снижению АД при ХБП исключается необоснованно большой объем фармакотерапии, поскольку окончательное решение о необходимом числе антигипертензивных препаратов и выбор их оптимальных доз осуществляются, когда уже реализованы долгосрочные эффекты диеты и других немедикаментозных методов лечения, имеющих большое значение при ХБП.
5. Образ жизни и диета больных АГ при ХБП
5.1. Диета и коррекция образа жизни являются важной составляющей лечения больных АГ при ХБП. Хотя при наличии ХБП одних этих методов, как правило, недостаточно для снижения АД до целевого уровня, они необходимы, т.к. существенно повышают ответ на медикаментозное лечение, уменьшают его объем и повышают безопасность (НГ).
5.2. Диета больным АГ при ХБП подбирается с учетом ее особенностей и стадии. Она должна быть в первую очередь подчинена задачам нефропротекции, коррекции метаболических и электролитных нарушений, связанных с заболеванием почек (НГ).
Диета и коррекция образа жизни, направленные на снижение АД, не применяются при ХБП самостоятельно – без медикаментозной антигипертензивной терапии (в отличие от эссенциальной АГ без ХБП, при которой на ранних стадиях возможно ограничиться только нелекарственными методами лечения). Однако их роль при ХБП очень велика, поскольку нелекарственные методы не только существенно повышают эффективность лекарств, снижающих АД, но и повышают их безопасность. Низкосолевая и малобелковая диеты увеличивают антигипертензивное и антипротеинурическое действие ингибиторов АПФ и блокаторов рецепторов ангиотензина II 1-го типа (БРА) в 1,5–2,0 раза.
Диета при ХБП сложна, особенно на 3б–5-й-стадиях, поскольку подчинена целому комплексу задач профилактики и коррекции нарушений фосфорно-кальциевого, пуринового, липидного обменов, гиперкалиемии и метаболического ацидоза. Продукты, богатые калием, широко рекомендуемые пациентам с эссенциальной АГ, должны быть строго ограничены при ХБП С3б–5, т.к. не только усугубляют склонность к гиперкалиемии, но и способствуют развитию гиперурикемии и гиперфосфатемии. На этих стадиях также должно быть ограничено употребление рыбы, овсяной и гречневой круп, богатых фосфором (табл. 10).
В условиях снижения функции почек особое значение приобретает сбалансированность и полноценность рациона. Питание должно быть регулярным, по возможности частым – 3 основных приема пищи плюс 2 легких «перекуса». Рацион должен содержать большое количество овощей и фруктов (с учетом некоторых ограничений – табл. 10). Субпродукты, консервы, пищевые концентраты, продукты быстрого приготовления и полуфабрикаты, а также шипучие напитки, богатые фосфором, содержащие искусственные красители и синтетические вкусовые добавки, должны быть исключены.
5.3. Всем больным АГ при ХБП рекомендуется ограничение потребления соли – менее 2 г (<90 ммоль) натрия (соответствует 5 г хлорида натрия), если нет противопоказаний (1С).
Увеличение потребления соли – важный фактор, способствующий повышению АД у пациентов с ХБП. Ограничение потребления соли при эссенциальной гипертонии оказывает достоверный антигипертензивный эффект [45]. Несмотря на отсутствие крупномасштабных долгосрочных РКИ по изучению роли ограничения потребления соли у пациентов с ХБП, нет оснований полагать, что при этом не должно наблюдаться снижение АД. Установлено, что низконатриевая диета приводит пациентов, получающих БРА, не только к дополнительному снижению АД, но и к альбуминурии или протеинурии [47, 98, 113, 120]. Ограничение потребления хлорида натрия нецелесообразно в клинических ситуациях, связанных с повышенной потерей натрия с мочой («сольтеряющая почка»), поскольку может приводить к гиповолемии.
Возможность косвенного контроля потребления соли дает биохимический анализ мочи с расчетом суточной экскреции натрия.
5.4. Всем больным АГ при ХБП, за исключением пациентов с нефротическим синдромом, ХБП С5Д и другими состояниями, связанными с задержкой жидкости, целесообразно соблюдение расширенного водного режима – потребление не менее 2 литров воды в сутки (2D).
Потребление жидкости в объеме не менее 2 литров в сутки на сегодня принято в качестве нормы здорового образа жизни. Однако, по данным анкетирования работников одного из предприятий Москвы [15], 65,7% опрошенных старались ограничивать потребление жидкости, что сочеталось со значительно более высокой частотой альбуминурии по сравнению с лицами, потреблявшими много жидкости (отношение рисков – 1,357 [0,837–2,199]).

Неоправданное ограничение потребления жидкости ведет к гиповолемии, сопровождается уменьшением перфузии почек и развитием их хронической ишемии, патологической активацией РАС и системы аргинин–вазопрессин, является причиной функциональной перегрузки канальцевого аппарата почек, фактором риска его токсического повреждения вследствие высокой концентрированности мочи, развития инфекции мочевых путей [83].
Неблагоприятное значение сниженного потребления жидкости в отношении функции почек было показано в эпидемиологических исследованиях [42, 115]. В условиях гиповолемии существенно повышается риск побочных эффектов препаратов, подавляющих РАС (см. рекомендацию 2.16).
Расширенный водный режим для больных с АГ при ХБП должен сочетаться со строгим ограничением потребления натрия (см. выше).
5.5. Всем взрослым больным ХБП С3а-5 и детям с ХБП С4–5 (не получающим диализа) с целью нефропротекции, а также для повышения эффективности антигипертензивных препаратов рекомендуется малобелковая диета (0,6–0,8 г/кг) с проведением регулярного контроля питательного статуса и профилактикой синдрома белково-энергетической недостаточности (1С).
5.6. Всем больным АГ при ХБП рекомендуется поддерживать индекс массы тела (ИМТ) в пределах 20–25 кг/м2 (1D).
Пациентам с ХБП С1–2 рекомендуется обычное потребление белка (1,0–1,2 г/кг/сут). Избыточное потребление белка (≥1,3 г/кг/сут) может неблагоприятно влиять на течение ХБП и должно быть исключено. Начиная с 3а-стадии ХБП показана малобелковая диета (0,6–0,8 г/кг); чем значительнее снижение СКФ, тем более строгое ограничение потребления белка требуется. Малобелковая диета благоприятно влияет на почечную гемодинамику, уменьшая клубочковую гипертензию и гиперфильтрацию. Ограничение потребления белка способствует более полной коррекции АГ, уменьшению выраженности нарушений пуринового, фосфорно-кальциевого обмена, гиперкалиемии и метаболического ацидоза. На 4–5-й стадиях ХБП (до начала заместительной терапии), когда отмечается выраженное повышение продуктов азотистого обмена, может быть использована низкобелковая диета (0,3–0,6 г/кг/сут). В условиях значительного ограничения потребления белка важно, чтобы не менее половины его было представлено белками животного происхождения, обладающими наибольшей пищевой ценностью.
Исключение составляют дети, у которых, учитывая важность достаточного потребления белка для роста и развития и отсутствие доказательной базы о влиянии малобелковой диеты на течение ХБП в этой возрастной группе, она рекомендуется на 4–5-й стадиях ХБП (до начала лечения диализом) с целью коррекции гиперфосфатемии и уремии, а также пациенты с ХБП С5Д, которым показана высокобелковая диета в связи со значительными потерями белка в течение процедуры диализа.
Избыточный вес и ожирение, которые все чаще встречаются у пациентов с ХБП в последние годы, связаны с резким повышением риска ССО, развитием резистентности к антигипертензивной и нефропротективной терапии [122]. Больным ХБП рекомендуется поддержание ИМТ в пределах 20–25 кг/м2 и окружности талии <102 см у мужчин и <88 см у женщин. Лиц с ожирением уменьшение массы тела на 5–10% от исходной приводит к достоверному снижению риска развития ССО, улучшению контроля АД, что крайне важно для прогноза ХБП. Снижение веса должно быть постепенным и обеспечиваться за счет планомерного ограничения высококалорийных продуктов, богатых легкодоступными углеводами, дозированных физических нагрузок. Применение пищевых добавок для снижения веса, вызывающих обезвоживание организма, «сухого голодания» недопустимо.
Дефицит потребления незаменимых аминокислот и недостаточная калорийность суточного рациона приводят к развитию синдрома белково-энергетической недостаточности, при котором наблюдаются гиперкатаболизм и утилизация собственных белков организма, в первую очередь мышц, резкое повышение смертности от сердечно-сосудистых и инфекционных осложнений. Синдром белково-энергетической недостаточности – одно из серьезных осложнений, часто встречающихся на поздних стадиях ХБП (С4–С5) и неблагоприятно влияющих на прогноз. Развитию данного синдрома способствует снижение аппетита и отвращение к белковой пище, часто возникающих вследствие уремии, а также неадекватная диета. Ограничение потребления белка при ХБП должно быть контролируемым и не вызывать ухудшения нутритивного статуса.
Признаки синдрома белково-энергетической недостаточности могут быть выявлены при осмотре больного (снижение веса и ИМТ, уменьшение толщины кожно-жировой складки, окружности бицепса), при проведении биохимического анализа крови (альбумин<35 г/л, парадоксальный рост мочевины и мочевой кислоты, калия, несмотря на дефицит потребления аминокислот).
Назначение комплекса кетоаналогов незаменимых аминокислот (кетостерил по 1 таблетке на 5 кг массы тела в сутки или 0,1 г/кг/сут) и высокая калорийность рациона (30–35 ккал/кг в сутки) в сочетании с достаточной физической активностью позволяют ограничивать потребление белка, избегая синдрома белково-энергетической недостаточности, при этом наблюдается замедление прогрессирования ХБП [16, 51, 55, 62]. При назначении низкобелковой диеты использование препаратов кетокислот обязательно.
С учетом сложности диеты при ХБП изменения ее требований в зависимости от стадии заболевания, важности строгой сбалансированности пациентам с ХБП с высоким и очень высоким риском ТПН и ССО показаны консультация диетолога, регулярный контроль рациона питания и нутритивного статуса, ведение пищевых дневников.
5.7. Всем больным АГ при ХБП рекомендуется индивидуальный подбор комплекса лечебной физкультуры с учетом состояния сердечно-сосудистой системы и переносимости. Физические упражнения должны быть равномерно распределены в течение недели, их общая продолжительность должна составлять не менее 3 часов в неделю (1D).
Благоприятное разностороннее влияние дозированных физических нагрузок на показатели здоровья показано в многочисленных исследованиях представителей общей популяции. Несмотря на отсутствие клинических исследований влияния физических упражнений на уровень АД и прогноз пациентов с ХБП (кроме единичных небольших по объему исследований пациентов с ТПН), нет оснований полагать, что их эффекты должны быть иными, чем у представителей общей популяции.
Дозированные физические нагрузки показаны всем пациентам с ХБП, кроме больных с тяжелыми формами нефротического синдрома с олигурией, больным с острым повреждением почек. Аэробные нагрузки (плавание, быстрая ходьба, занятия на велотренажере и эллиптическом тренажере) необходимы для оптимизации веса, АД, снижения риска ССО. Полезны и силовые упражнения для улучшения белкового обмена, укрепления мышц. В то же время бег трусцой, занятия на беговой дорожке, верховая езда и другие упражнения, связанные со значительным сотрясением тела, нежелательны людям, склонным к опущению почки.
Занятия физкультурой должны быть регулярными и равномерно распределены в течение недели – как минимум по 30 минут в день 5–7 раз в неделю или по часу 3 раза в неделю.
5.8. Всем больным АГ при ХБП, подверженным курению, рекомендуется отказ от него, в т.ч. с целью кардио- и нефропротекции (1D).
5.9. Потребление алкоголя больными АГ при ХБП рекомендуется ограничить – не более 20 г чистого этанола в сутки для мужчин и не более 10 г/сут для женщин (1D).
Курение является одним из основных изменяемых факторов риска развития ССО, развития ХБП и развития ТПН у пациентов с уже имеющейся ХБП. Прием алкоголя вызывает как кратковременное, так и долгосрочное повышение АД. Систематический обзор результатов четырех исследований [45] показал, что ограничение потребления алкоголя в общей популяции привело к снижению САД на 3,8 мм рт.ст. (95% ДИ – 1,4–6,1), а ДАД – на 3,2 мм рт.ст. (95% ДИ 1,4–5,0). Пагубное потребление алкоголя негативно влияет и на состояние почек.
Несмотря на отсутствие клинических исследований влияния отказа от курения, ограничение потребления алкоголя на уровень АД и прогноз пациентов с ХБП, нет оснований полагать, что их эффекты должны быть иными, чем у представителей общей популяции.
5.10. Необходимо тщательно изучать фармакологический анамнез больных АГ при ХБП, по возможности ограничивать или исключить прием препаратов, повышающих АД и неблагоприятно влияющих на почки (анальгетики, нестероидные противовоспалительные средства, включая селективные ингибиторы циклооксигеназы-2) (НГ).
Значительная часть пациентов с ХБП в России регулярно принимает анальгетики и НПВП (по данным анкетирования до 30%) по поводу головных болей, болей в спине, артралгий, болезненных месячных, как правило, не ставя об этом в известность нефролога. Регулярный прием анальгетиков, НПВП, включая селективные ингибиторы циклооксигеназы-2, связан с развитием резистентности к антигипертензивной терапии вследствие снижения экскреции натрия, оказывает токсическое и ишемическое повреждающее действие на почки, приводящее к тубулоинтерстициальному фиброзу и нарушению их функции. При обследовании пациента с АГ при ХБП необходимо целенаправленно выявлять наличие болевого синдрома любой локализации, который сам предрасполагает к развитию резистентной АГ, и факт регулярного приема анальгетиков, НПВП, а также других препаратов, способствующих повышению АД (гормональные контрацептивы, заместительная терапия женскими половыми гормонами, симпатомиметики, препараты спорыньи, анаболические стероиды и др.), с последующим направлением к соответствующему специалисту с целью коррекции терапии с максимально возможным ограничением приема препаратов, оказывающих нежелательное влияние на уровень АД, сердечно-сосудистую систему и почки.
6. Фармакотерапия АГ при ХБП
6.1. Выбор препаратов для снижения АД при ХБП определяется в первую очередь целями нефро/кардиопротекции и должен проводиться с учетом данных клинических исследований об их влиянии на почечные и сердечно-сосудистые исходы, а также данных о безопасности их применения на данной стадии ХБП (НГ).
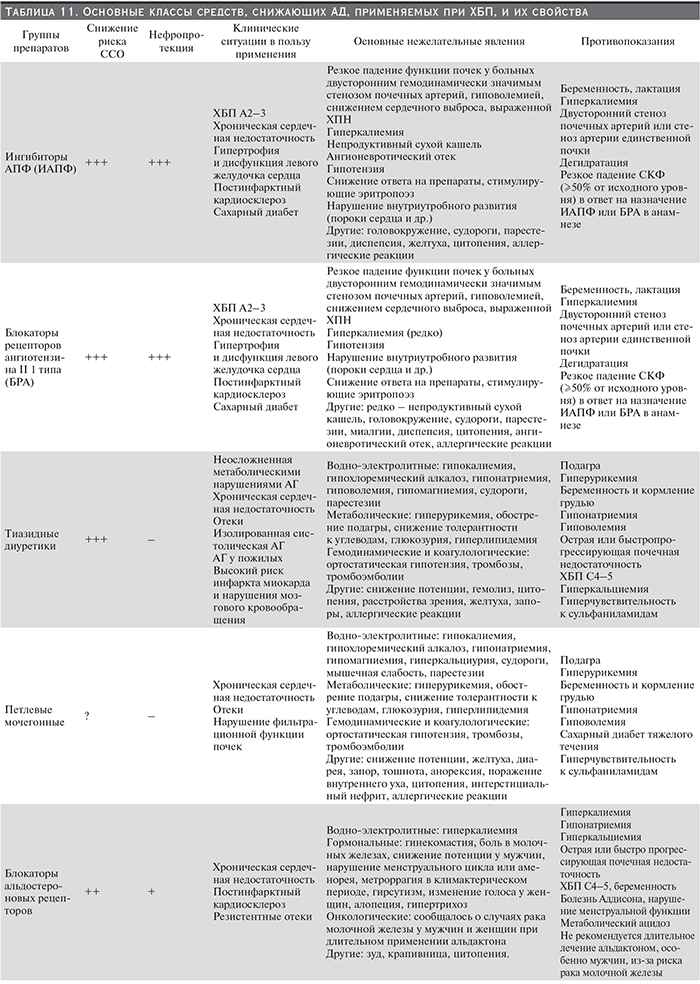
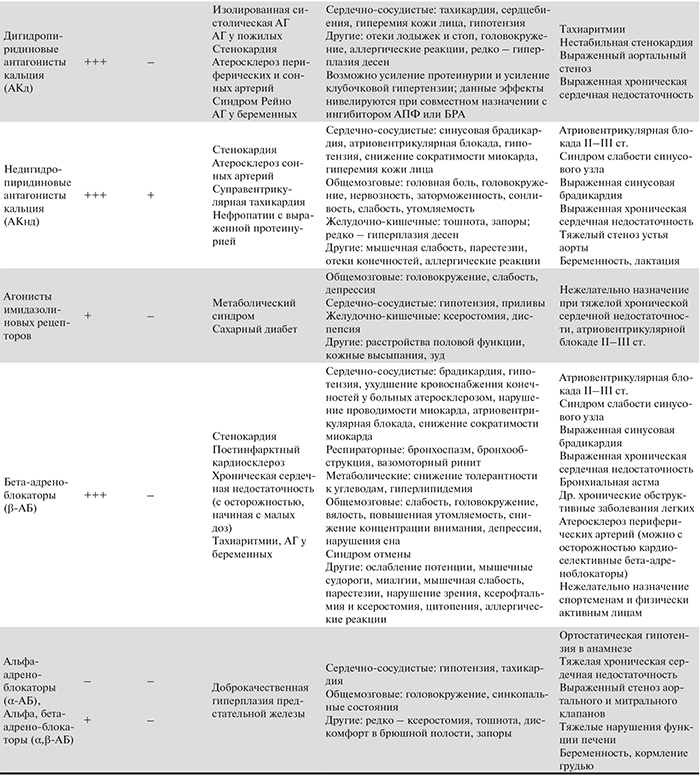
Группы препаратов, снижающих АД, существенно различаются по влиянию на центральную гемодинамику, ССО и прогрессирование ХБП (табл. 11).
При выборе препаратов отдают предпочтение средствам, оказывающим помимо снижения АД дополнительные органопротективные эффекты в отношении почек и сердечно-сосудистой системы. Задачи нефропротекции приоритетны, особенно для пациентов с высоким риском прогрессирования ХБП (табл. 8), поскольку сохранение функции почек при ХБП является важнейшим условием снижения риска ССО.
Нефропротективные свойства, т.е. способность достоверно отдалять наступление ТПН по данным РКИ, доказаны для представителей двух классов – ингибиторов АПФ (ИАПФ) и блокаторов рецепторов ангиотензина II 1-го типа (БРА) – для пациентов с очень высокой альбуминурией или выраженной протеинурией (категория А3). При альбуминурии категории А2 имеются рациональные аргументы и мнения экспертов в пользу назначения ИАПФ или БРА, однако в настоящее время отсутствуют РКИ, с высокой степенью доказательности подтверждающие преимущества препаратов, подавляющих РАС, перед другими препаратами, снижающими АД (см. рекомендации 0–2.15). При альбуминурии класса А1 препараты, подавляющие РАС, не имеют преимуществ по сравнению с другими антигипертензивными средствами [71].
В экспериментальных исследованиях было показано, что антагонисты кальция недигидропиридинового ряда (АКнд) могут оказывать антипротеинурический эффект за счет снижения внутриклубочкового давления, воздействуя, подобно ИАПФ и БРА, преимущественно на выносящую артериолу. В то же время нифедипин преимущественно расширяет приносящую артериолу, усиливая гиперперфузию клубочков, клубочковую гипертензию и повышая альбуминурию. Однако значение этих особенностей при клиническом применении АК остается недостаточно изученным. Самостоятельное применение АКнд с нефропротективной целью – как альтернативы ИАПФ или БРА – не рекомендуется. Сочетанное применение с препаратами, подавляющими РАС, нивелирует негативное влияние АКд на почечную гемодинамику и альбуминурию.
Благоприятное влияние на риск ССО показано для многих классов препаратов, снижающих АД (табл. 11), в крупных РКИ, включающих в т.ч. пациентов с ХБП и больных сахарным диабетом.
Особенности влияния различных групп препаратов, снижающих АД, на риск ССО в зависимости от наличия ХБП, ее стадии, нозологической формы не изучены. При определении препаратов выбора пациентами с ХБП руководствуются общими принципами, изложенными в Национальных рекомендациях по лечению АГ [22, 23], учитывая наличие ишемической болезни сердца, аритмии, сердечной недостаточности, облитерирующего атеросклероза периферических артерий, метаболического синдрома.
Поскольку антигипертензивная терапия назначается на длительное время, немаловажное значение для выбора препаратов играют факторы, влияющие на приверженность пациентов лечению: использование препаратов, более доступных по цене, имеющих пролонгированное действие с возможностью однократного приема в течение суток, фиксированных комбинаций антигипертензивных средств, которые позволяют уменьшить число принимаемых таблеток.
6.2. У пациентов с ХБП без сахарного диабета с очень высокой альбуминурией и/или протеинурией>0,5 г/сут (категория А3) рекомендуется назначение ингибитора ангиотензинпревращающего фермента (ИАПФ) или блокатора рецепторов ангиотензина II 1-го типа (БРА) (1B).
6.3. Пациентам с ХБП без сахарного диабета с высокой альбуминурией (категория А2) целесообразно назначение ингибитора ангиотензинпревращающего фермента (ИАПФ) или блокатора рецепторов ангиотензина II 1-го типа (БРА) (2D).
6.4. Пациентам с ХБП с сахарным диабетом, с очень высокой альбуминурией и/или протеинурией>0,5 г/сут (категория А3) рекомендуется назначение ингибитора ангиотензинпревращающего фермента (ИАПФ) или блокатора рецепторов ангиотензина II 1-го типа (БРА) (1B).
6.5. Пациентам с ХБП с сахарным диабетом с высокой альбуминурией (категория А2) целесообразно назначение ингибитора ангиотензинпревращающего фермента (ИАПФ) или блокатора рецепторов ангиотензина II 1-го типа (БРА) (2D).
Гиперактивация РАС, приводящая к нарушению почечной гемодинамики (клубочковой гипертензии и ишемии почечного тубулоинтерстиция), усилению протеинурии и протеинурического ремоделирования почечных канальцев, играет ключевую роль в прогрессировании ХБП [119]. Поэтому применение препаратов, подавляющих РАС, – ИАПФ и БРА, занимает центральное место в нефропротективной стратегии [46]. Снижение АД является лишь одним из механизмов благоприятного воздействия данных лекарственных средств на течение ХБП: они также обладают антипротеинурическим действием, устраняют клубочковую гипертензию и ишемию почечного тубулоинтерстиция, подавляют процессы воспаления и фиброгенеза [75]. По данным ряда проспективных исследований, лечение ИАПФ или БРА существенно снижает риск развития ТПН у больных ХБП диабетической и недиабетической природы [39, 80, 90, 106]. Так, в исследовании REIN при использовании ингибитора АПФ рамиприла больными недиабетическими формами ХБП (хроническим гломерулонефритом, поликистозной болезнью почек) риск развития ТПН или значительного снижения СКФ уменьшался на 49% по сравнению с группой получавших плацебо в дополнение к обычной антигипертензивной терапии [55].
Однако широкое применение агрессивной блокады РАС и «шаблонное» назначение данных препаратов всем пациентам с ХБП без учета их индивидуальных особенностей – неоправданный подход. Важно учитывать, что РАС при ХБП не только взаимодействует с механизмами гемодинамического и протеинурического повреждения почек, но ее гиперактивация играет определенную приспособительную роль, поддерживая внутриклубочковое давление, особенно в условиях гипоперфузии почек, например при застойной сердечной недостаточности, атеросклерозе почечных артерий.
Как нефропротективный потенциал, так и частота осложнений при лечении препаратами, подавляющими РАС, варьируются в широких пределах. Их эффективность влияет на исходный уровень альбуминурии/протеинурии [103], генетические особенности, в частности полиморфизм гена ангиотензинпревращающего фермента (АПФ) [37, 95]: наиболее отчетливое благоприятное влияние терапии на почечные исходы отмечается в самых прогностически неблагоприятных группах – у больных исходно более высокой протеинурией и DD-вариантом полиморфизма гена АПФ.
Большое значение имеет раннее назначение препаратов, подавляющих РАС: хотя они не теряют способности оказывать антипротеинурическое и нефропротективное действия на поздних стадиях заболевания, однако решающую роль играет продолжительность их приема – по мере увеличения длительности терапии положительные почечные эффекты данных средств накапливаются [108].

К сожалению, ранние предикторы, позволяющие предсказывать хороший нефропротективный эффект препаратов, подавляющих РАС, до настоящего времени не разработаны. По данным РКИ [56] их благоприятное влияние на скорость прогрессирования ХБП прямо пропорционально их антипротеинурическому действию. Хорошим признаком может считаться снижение протеинурии в 1,5–2 раза от исходного уровня или ее стойкое уменьшение до уровня ниже 0,5 г/сут, однако оно достигается не сразу, а спустя 3–6 месяцев непрерывного лечения, когда и следует оценивать эффект.
6.6. Назначение препаратов, подавляющих РАС, пациентам с ХБП С3а–5 связано с повышенным риском осложнений, который нарастает по мере снижения функции почек и у больных пожилого возраста. Лечение данными средствами должно проводиться на фоне тщательного мониторинга уровня креатинина и калия сыворотки. Пациентов необходимо информировать о необходимости во время данного лечения соблюдать адекватный водный режим, исключающий гиповолемию, и ограничивать потребление продуктов, богатых калием, предупреждать о нежелательности его сочетания с препаратами, ухудшающими почечный кровоток (анальгетики и НПВП, включая селективные ингибиторы циклооксигеназы-2), противопоказании данных препаратов во время беременности.
6.7. При стойком (сохраняющемся в течение двух недель) повышении концентрации креатинина сыворотки более чем на 30% от исходного уровня препарат, подавляющий РАС, должен быть отменен и проведено обследование для исключения реноваскулярной болезни (НГ).
Данные РКИ [39, 80, 90, 106], а также многолетний опыт применения ИАПФ и БРА показывают, что они могут назначаться с высокой степенью безопасности как на ранних, так и на поздних стадиях ХБП. Тем не менее при использовании препаратов, подавляющих РАС, пациентам с ХБП требуется повышенная осторожность. Кроме мучительного сухого кашля, ангионевротического отека, нарушений внутриутробного развития плода при их приеме во время беременности следует учитывать такие серьезные побочные действия, как гиперкалиемия, острое повреждение почек, анемия, характерные для пациентов с ХБП, риск которых прямо пропорционален степени снижения СКФ.
Основным механизмом нефропротективного действия ИАПФ и БРА является расширение выносящей артериолы, приводящее к устранению клубочковой гипертензии, которая развивается в условиях гиперперфузии почечных клубочков и характерна для большинства больных ХБП. В противоположной ситуации – гипоперфузии почечных клубочков, развивающейся при гиповолемии, уменьшении сердечного выброса, нарушении проходимости почечных сосудов вследствие их обструкции или вазоконстрикции; препараты, подавляющие РАС, перестают оказывать нефропротективное действие и могут вызывать острое повреждение почек, поскольку устраняют сужение выносящей артериолы – единственный механизм, поддерживающий клубочковое давление при снижении их кровоснабжения.
Факторами риска гипоперфузии почечных клубочков являются пожилой возраст, наличие сахарного диабета, застойной сердечной недостаточности, тяжелого атеросклероза, неадекватный водный режим, неадекватный и бесконтрольный прием диуретиков, анальгетиков и НПВП. В этих ситуациях нужна повышенная осторожность: начальное назначение препаратов, блокирующих РАС, необходимо проводить в минимальных дозах с постепенным их титрованием, обеспечивать более ча-стый мониторинг уровня креатинина и калия сыворотки крови.
Гиперкалиемия развивается при назначении ИАПФ и БРА вследствие подавления продукции альдостерона. Ее предотвращению способствуют низкокалиевая диета и назначение салуретиков.
БРА по сравнению с ИАПФ значительно реже вызывают сухой кашель, ангионевротический отек и гиперкалиемию и могут рассматриваться в качестве альтернативы при непереносимости ИАПФ.
Риск развития острого повреждения почек при использовании обеих групп препаратов, подавляющих РАС, одинаков, поэтому при появлении данного осложнения обе группы в дальнейшем должны быть исключены.
Контроль уровня креатинина и калия сыворотки крови должен проводиться до назначения препарата, подавляющего РАС, или увеличения его дозы и затем повторно через 3–5 дней. Увеличение уровня креатинина на величину менее 30% от исходного считается благоприятным признаком, поскольку отражает устранение клубочковой гипертензии и гиперфильтрации. При его повышении на 30–50% рекомендуется повторное определение с интервалом в неделю. Если повышение уровня креатинина через 2 недели наблюдения сохраняется выше 30%, препарат должен быть отменен. Если повышение уровня креатинина составляет ≥50% от исходного, препарат должен быть немедленно отменен. При резком (≥30%) повышении уровня креатинина сыворотки больной должен быть направлен на обследование для исключения реноваскулярной болезни.
6.8. В большинстве случаев АГ при ХБП монотерапия оказывается недостаточной и следует применять комбинированное лечение препаратами, снижающими АД, из разных фармакологических групп. При САД≥160 и/или ДАД≥100 возможно начинать лечение сразу двумя препаратами. Нередко для достижения целевого уровня АД при ХБП требуется сочетание 3–4 антигипертензивных препаратов с соблюдением мер безопасности (НГ).
По данным РКИ, в которых ставилась задача более строгого контроля АД, для достижения его целевого уровня при ХБП необходима комбинация из 3 и более препаратов. К сожалению, возможности комбинированной терапии АГ при ХБП изучены в небольшом числе исследований.
При альбуминурии категории А1, при которой ИАПФ и БРА не обладают преимуществами по сравнению с антигипертензивными препаратами других групп, комбинированная терапия проводится в соответствии с общими принципами, сформулированными в Национальных рекомендациях по лечению АГ [23].
При более выраженной альбуминурии/протеинурии, когда ИАПФ или БРА являются препаратами первого выбора, эффективность дополнительной антигипертензивной терапии должна оцениваться с точки зрения ее влияния на риск развития ТПН и ССО.
Учитывая ключевую роль гиперактивации РАС в прогрессировании ХБП и ремоделировании миокарда, в последние годы активно изучалась возможность агрессивной ее блокады с использованием препаратов, действующих на данную вазоактивную систему на разном уровне. Однако, как показал ряд РКИ, посвященных различным сочетаниям ИАПФ, БРА и ингибитора ренина [32, 53, 89, 96], такая тактика не обладает преимуществом перед монотерапией ИАПФ или БРА в отношении почечных исходов и общей выживаемости и при этом связана со значительным повышением риска побочных эффектов.
Так, в исследовании ONTARGET, спланированном с целью изучить клиническую эффективность и безопасность стратегии двойной блокады РААС с помощью ИАПФ рамиприла и БРА телмисартана и включившем свыше 25 тыс. пациентов с периодом наблюдения более 5,5 лет, прицельная оценка почечных исходов показала, что комбинация ИАПФ и БРА была ассоциирована с повышением риска необходимости в диализе, удвоения уровня креатинина сыворотки и смертности по сравнению с изолированным применением обоих препаратов [89].
В исследовании NEPHRON-D [54], в которое включены пациенты с диабетической нефропатией с выраженной альбуминурией (не менее 300 мг/г), при которой преимущества комбинированного лечения должны были бы проявляться наиболее отчетливо, в группе комбинированного лечения лозартаном и лизиноприлом частота неблагоприятных почечных исходов была незначительно ниже по сравнению с монотерапией лозартаном, не было преимуществ в отношении смертности и сердечно-сосудистых исходов. В то же время частота гиперкалиемии и острой почечной недостаточности была достоверно выше при комбинированной терапии. Систематический обзор, включивший 21 708 пациентов, также не показал преимуществ комбинированного лечения при ХБП в отношении риска снижения функции почек и ССО [87].
Еще одна комбинация, на которую возлагали определенные надежды в отношении более эффективной нефропротекции, – присоединение к ИАПФ или БРА антагониста альдостерона, роль которого в прогрессировании нефросклероза и кардиосклероза активна [8, 28, 60, 111]. Однако мета-анализ, включивший 27 контролируемых или квазиконтролируемых исследований, в которых изучали эффекты присоединения альдактона к ИАПФ или БРА или их сочетанию [37], показал, что комбинированное лечение более эффективно снижает протеинурию, но в то же время чаще вызывает гиперкалиемию и не имеет преимуществ в отношении сохранения функции почек и риска ССО.
Таким образом, достижение максимального антипротеинурического эффекта за счет использования агрессивной комбинированной блокады РАС в настоящее время признана рискованной тактикой, не дающей заметных преимуществ в отношении эффективности нефропротекции и значительно повышающей риск осложнений.
Наиболее оптимальными считаются комбинации ИАПФ или БРА с диуретиком или антагонистом кальция. Назначение тиазидного или петлевого мочегонного в 1,5–2,0 раза усиливает антигипертиензивный и антипротеинурический эффект препаратов, подавляющих РАС [47, 120]. Однако при назначении мочегонных следует учитывать опасность гиповолемии и ограничение в использовании тиазидов при выраженном снижении СКФ.
Post hoc-анализ результатов крупного исследования ACCOMPLISH свидетельствует о превосходстве комбинации ИАПФ (беназеприл) с антагонистом кальция (амлодипин) над комбинацией беназеприла с тиазидным диуретиком (гидрохлортиазид) в отношении замедления прогрессирования ХБП [33].
В исследовании OSCAR, в которое включили пожилых пациентов с СКФ ниже 60 мл/мин/1,73 м2, были показаны преимущества в отношении эффективности контроля АД и неблагоприятных сердечно-сосудистых исходов комбинированного лечения БРА олмесартаном в сочетании с антагонистом кальция амлодипином по сравнению с монотерапией БРА в высокой дозе [72]. В исследовании ZAFRA [104] показано, что назначение АКд лерканидипина в дополнение к терапии, подавляющей РАС, приводит к дополнительному снижению протеинурии и тенденции к повышению СКФ. Комбинация АКд с препаратом, подавляющим РАС, как говорилось выше, нивелирует его неблагоприятное действие на почечную гемодинамику. Польза такого сочетания обусловлена более частым достижением целевого АД в группе комбинированной терапии.
При недостаточном контроле АД в качестве дополнения к проводимой комбинированной терапии – ИАПФ (или БРА) и диуретик и/или антагонист кальция – могут назначаться агонисты имидазолиновых рецепторов, бета-адреноблокаторы.
Альфа-адреноблокаторы, оказывающие мощный антигипертензивный эффект, но не обладающие органопротективными свойствами, а также альфа-, бета-адреноблокаторы используются как препараты резерва в случае тяжелой, резистентной к стандартной терапии АГ. При их назначении необходимо исключать ночную гипотензию и ортостатическую гипотензию.
Следует избегать сочетания АКнд и бета-адреноблокатора, учитывая их однонаправленное влияние на ЧСС и проводимость миокарда.
6.9. У больных с нарушением функции почек меняется фармакокинетика и эффективность многих препаратов, снижающих АД, повышается риск их побочных действий, что необходимо учитывать при выборе лекарств и их доз (НГ).
При СКФ<60 мл/мин/1,73 м2 нарушается фармакокинетика препаратов с преимущественно почечным путем выведения, возникает риск передозировки даже при использовании средних терапевтических доз, поэтому следует отдавать предпочтение средствам с преимущественно печеночным путем выведения (табл. 12).
Снижение функции почек приводит к уменьшению чувствительности к тиазидным и в меньшей степени петлевым диуретикам, что требует увеличения их доз. В то же время из-за сниженной экскреции мочевой кислоты при использовании тиазидных и в меньшей степени петлевых мочегонных повышается риск развития уратного криза, что лимитирует их использование.
Антагонисты альдостерона не рекомендуются к использованию при ХБП С4–5 из-за высокого риска гиперкалиемии.
6.10. Антигипертензивная терапия пациентов с АГ при ХБП должна сочетаться с коррекцией нарушений пуринового, липидного, углеводного, фосфорно-кальциевого обменов, анемии в соответствии с общими принципами нефро/кардиопротективной стратегии (НГ).
Разнообразные нарушения обмена веществ встречаются при ХБП значительно чаще, чем в общей популяции, и усугубляются по мере ее прогрессирования. Гиперурикемия, гиперлипидемия, снижение толерантности к углеводам, нарушения фосфорно-кальциевого обмена и анемия способствуют повышению АД и риска ССО. Кроме того, они могут лимитировать назначение некоторых антигипертензивных препаратов (диуретиков, бета-адреноблокаторов).
Для своевременного выявления и коррекции данных нарушений должны проводиться регулярные обследования с последующим индивидуальным подбором диеты и при необходимости – медикаментозной терапии (аллопуринол, статины, эзетимиб и др.) в соответствии с Рекомендациями по диагностике и ведению ХБП, лечению анемии, гиперлипидемии, нарушений фосфорно-кальциевого обмена [7, 16, 22, 68–71].
6.11. Больные резистентной АГ нуждаются в дополнительном обследовании для уточнения причин недостаточного ответа на антигипертензивную терапию и ее коррекции, а также более частом мониторинге основных целевых показателей ХБП и маркеров ССО.
Резистеность или рефрактерность к антигипертензивной терапии при ХБП представляет серьезную проблему, поскольку более чем половине пациентов не удается достичь целевых значений АД [77]. Резистентной считают АГ, при которой сохраняется САД≥140 и/или ДАД≥90 мм рт.ст., несмотря на регулярный прием комбинации из трех и более препаратов, снижающих АД [25, 127].
Следует отличать истинную резистентность от мнимой, связанной с низкой приверженностью пациентов принципам лечения, и другими причинами, приводящими к невозможности выполнить в полной мере назначение врача по приему антигипертензивных препаратов [109, 114, 127].
При выяснении причин резистентности АГ к лечению необходимо уточнять правильность соблюдения рекомендаций, касающихся диеты (ограничения соли), исключения курения, употребления наркотических препаратов, алкоголя, возможную связь данного феномена с одновременным приемом лекарственных средств, способствующих повышению АД и снижению чувствительности к антигипертензивным средствам (анальгетики, НПВП, препараты спорыньи, препараты женских половых гормонов, анаболические стероиды, циклоспорин, такролимус, препараты, стимулирующие эритропоэз, симпатомиметики и др.). Если назначены энтеросорбенты, необходимо исключить их одновременный прием с антигипертензивными и другими препаратами.
В отсутствие ответа на антигипертензивную терапию также необходимо исключить феномен т.н. псевдогипертонии, связанной с неправильной методикой измерения АД (использование манжеты размером, не соответствующим окружности плеча) или выраженным атеросклерозом и кальцинозом сосудов у пожилых и пациентов с ХБП С4–5, когда вследствие очень высокой жесткости плечевой артерии она не может быть пережата манжетой.
К основным причинам истинной резистентности АГ к лечению при ХБП относятся персистирующая активность нефрита при аутоиммунных заболеваниях почек, выраженное снижение СКФ, ожирение и инсулинорезистентность, синдром ночного апноэ, выраженный атеросклероз сосудов, кровоснабжающих головной мозг, развитие вазоренальной АГ, наличие системного васкулита, антифосфолипидного синдрома, развитие на фоне ХБП других вариантов вторичной АГ (эндокринных). Выявление феномена резистентной АГ требует повторного многостороннего обследования с целью исключения перечисленных факторов, которое включает проведение СМАД и УЗДГ сосудов почек.
Преодоление резистентности возможно за счет увеличения объема антигипертензивной терапии – сочетания препарата, подавляющего РАС, с несколькими мочегонными (тиазид+ петлевой диуретик; антагонист альдостерона+петлевой диуретик), АКд, β-АБ, α-АБ или α, β-АБ. Новые назначения должны делаться поэтапно с интервалом не менее 5–7 дней для оценки переносимости.
Современные методы хирургического лечения резистентной АГ – эндоваскулярная абляция симпатического сплетения почечной артерии (почечная денервация) и электрическая стимуляция барорецепторов каротидного синуса – остаются недостаточно изученными [57]. Их эффективность и безопасность при наличии ХБП требуют оценки в ходе проспективных исследований. В настоящее время СКФ<45 мл/мин/1,73 м2 является противопоказанием к их проведению.
7. Особенности лечения АГ у больных, получающих заместительную почечную терапию
7.1. Больным, получающим лечение гемодиализом, необходима максимальная индивидуализация тактики лечения АГ с обеспечением стабильности АД, исключением эпизодов интрадиализной и ортостатической гипотензии (НГ).
7.2. Больным, получающим лечение гемодиализом, в большинстве случаев целесообразно начинать терапию препаратами, снижающими АД, при стойком повышении САД≥140 или ДАД≥90 мм рт.ст. и добиваться при хорошей переносимости достижения уровня САД<140, но не ниже 120 и ДАД<90, но не ниже 70 мм рт.ст. (2D).
7.3. Больным, получающим лечение перитонеальным диализом, целесообразно начинать терапию препаратами, снижающими АД, при стойком повышении САД≥140 или ДАД≥90 мм рт.ст. и добиваться при хорошей переносимости достижения уровня САД<140, но не ниже 120 и ДАД<90, но не ниже 70 мм рт.ст. (2D).
7.4. Больным трансплантированной почкой целесообразно независимо от уровня альбуминурии/протеинурии начинать лечение препаратами, снижающими АД, при стойком повышении САД≥130 или ДАД≥80 мм рт.ст. и добиваться при хорошей переносимости достижения уровня САД<130, но не ниже 120 и ДАД<80, но не ниже 70 мм рт.ст. (2D)
7.5. При плохой переносимости указанных целевых значений АД для пациентов с ХБП С5, получающих ЗПТ, склонности к эпизодам гипотензии проводится коррекция тактики лечения.
7.6. Для детей и подростков, больных пожилого и старческого возраста, получающих ЗПТ, устанавливаются целевые значения АД в соответствии с теми же принципами, что и для пациентов данных возрастных групп с АГ и ХБП, не получающих ЗПТ (см. главы «8. Принципы лечения АГ при ХБП у детей и подростков» и «9. Принципы лечения АГ при ХБП у пациентов пожилого и старческого возраста»).
Определение тактики коррекции АГ у больных, получающих заместительную почечную терапию (ЗПТ), представляет большие трудности [79]. С одной стороны, они входят в группу очень высокого риска ССО (относительный риск смертности от ССО у пациентов, получающих лечение гемодиализом в десятки раз выше, чем в общей популяции [50]), что может служить весомым аргументом в пользу более строгого контроля АД. С другой стороны, для них характерна высокая лабильность АД, в связи с чем на фоне мощной антигипертензивной терапии возможны эпизоды гипотензии, связанные с риском ишемического поражения сердца и головного мозга, а также с гиперактивацией вазопрессорных гормональных систем, приводящих к дальнейшему резкому повышению АД [18].
К сожалению, до настоящего времени отсутствует доказательная база, позволяющая оценивать влияние различной тактики антигипертензивной терапии пациентов с ХБП-С5Д и ХБП-Т на риск осложнений и выживаемость. Высокая смертность, связанная с рядом факторов, значительная неоднородность пациентов, получающих ЗПТ, по клиническим характеристикам, прогностическим факторам и тактике самой ЗПТ ограничивают возможность установить самостоятельное влияние антигипертензивной терапии на прогноз.
ЗПТ является основным средством снижения АД для пациентов с ТПН, развитие или нарастание тяжести АГ может быть одним из проявлений неадекватности диализа или развития дисфункции трансплантата почки. Имеются данные, согласно которым эффективный в отношении достижения «сухого веса» гемодиализ позволяет добиваться нормализации АД большинству пациентов с ХБП С5Д [40, 61].
В то же время в течение процедуры гемодиализа возможно развитие эпизодов как резкого повышения АД, так и интрадиализной гипотензии. Интрадиализная гипотензия является серьезным осложнением, требующим преждевременного прекращения процедуры гемодиализа. К ее основными причинами относятся особенности режима проведения гемодиализа (высокая скорость ультрафильтрации, которую приходится устанавливать у больных, не соблюдающих водно-солевой режим, что приводит к избыточной задержке жидкости в междиализный период, неправильное определение «сухого веса»), сердечная недостаточность, тяжелая вегетативная дисфункция, характерные для пациентов с ХБП С5Д. Одной из дополнительных причин интрадиализной гипотензии может быть и неадекватная (агрессивная) антигипертензивная терапия.
Учитывая большую вариабельность АД в интрадиализный и междиализный период, наиболее информативным методом оценки тяжести АГ у больных, получающих лечение гемодиализом, является 48-часовое автоматическое мониторирование [26, 27, 34]. СКАД у пациентов с ХБП С5Д также несет важную информацию – данные самоизмерений более тесно коррелируют с развитием гипертрофии миокарда левого желудочка у этих больных, чем цифры АД, измеренные врачом до или после диализа [27].
При каузальных измерениях АД для оценки эффективности антигипертензивной терапии следует ориентироваться на уровень АД непосредственно перед очередным сеансом гемодиализа. Для ответа на вопрос, насколько антигипертензивная терапия безопасна, следует учитывать измерения АД, выполненные в течение процедуры диализа. У пациентов с ХБП С5Д при врачебных осмотрах также рекомендуется чаще выполнять тест на наличие постуральной (ортостатической) гипотензии.
Высокая вариабельность АД характерна и для пациентов с ТПН, получающих лечение перитонеальным диализом, у которых часто отмечается ночная гипертония [4], что определяет важность проведения у них регулярного СМАД.
ИАПФ и БРА, а также АК занимают важное место в лечении пациентов, получающих лечение диализом, благодаря их кардио- и вазопротективным свойствам. Больные со склонностью к интрадиализной гипотензии или гипертонии могут использовать антигипертензивные препараты с коротким периодом полувыведения, что позволяет избирательно, соответственно, ослаблять или усиливать воздействие на уровень АД во время процедуры гемодиализа.
Пациенты с трансплантированной почкой – также очень неоднородная группа, характеризующаяся сочетанием многих факторов, влияющих на уровень АД. Ингибиторы кальциневрина, назначаемые с целью профилактики отторжения трансплантата, могут ухудшать почечный кровоток и способствовать повышению АД. В то же время высокий уровень АД неблагоприятно влияет на функцию трансплантата и повышает риск смерти от ССО. Тактика антигипертензивной терапии этих пациентов с ТПН в отличие от больных ХБП С5Д определяется двойной целью: снижения риска ССО и сохранения функции трансплантата почки.
На стадиях, когда проводится подбор иммуносупрессивной терапии и велик риск резкого ухудшения функции трансплантата, следует отдавать предпочтение при выборе антигипертензивной терапии АКд, повышающим перфузию клубочков. Больные со стабильной функцией трансплантата, наличием повышенной альбуминурии/протеинурии могут использовать ИАПФ или БРА с целью как кардиопротекции, так и защиты трансплантата от гемодинамического повреждения вследствие его гиперперфузии [2].
Таким образом, для пациентов с ХБП, получающих ЗПТ, необходима максимальная индивидуализация лечения препаратами, снижающими АД. При лечении гемодиализом и перитонеальным диализом, когда антигипертензивная терапия назначается с целью снижения риска ССО, в большинстве случаев целесообразно добиваться снижения АД до уровня <140/90 мм рт.ст. При склонности к интрадиализной, ортостатической или ночной гипотензии целевой уровень может быть увеличен до <150/90 мм рт.ст., эксперты не видят оснований для пересмотра принятой в прошлые годы точки зрения, что для данной категории больных, характеризующихся крайне высоким риском ССО, желательно поддерживать систолическое АД на уровне <140 мм рт.ст.
И в то же время необходимо принимать усиленные по сравнению с более ранними стадиями ХБП меры по обеспечению безопасности антигипертензивной терапии и исключению эпизодов гипотензии (интрадиализной, ночной, ортостатической).
Пациентам пожилого и старческого возраста, процент которых ежегодно увеличивается среди получающих ЗПТ, рекомендуется придерживаться общих принципов коррекции АГ для данной возрастной группы (см. главу «9. Принципы лечения АГ при ХБП у пациентов пожилого и старческого возраста»). Это же касается детей и подростков, получающих ЗПТ (см. «8. Принципы лечения АГ при ХБП у детей и подростков»).
8. Принципы лечения АГ при ХБП у детей и подростков
8.1. Детям и подросткам с ХБП рекомендуется начинать лечение препаратами, снижающими АД, при его уровне, стойко превышающем 90-ю перцентиль для соответствующего пола и возраста (1С).
8.2. При лечении АГ у детей и подростков с ХБП целесообразно добиваться снижения систолического и диастолического АД до уровня ниже 90-й перцентили для соответствующего пола и возраста (2D).
8.3. Предпочтительной комбинацией для лечения АГ у детей является сочетание ИАПФ и АК (2D).
8.4. Лечение АГ у младенцев целесообразно начинать с применения амлодипина (2D).
Развитие АГ в детском возрасте имеет наиболее неблагоприятное значение, поскольку означает, что в течение многих десятков лет почки и сердечно-сосудистая система будут подвергаться пагубному воздействию повышенного АД [21], при этом снижение АД в данной возрастной группе хорошо переносится. В РКИ, включившем 385 детей и подростков в возрасте от 3 до 18 лет, по данным 5-летнего наблюдения отмечено преимущество при более строгом контроле АД (до уровня ниже 50-й перцентили для соответствующего пола и возраста), по сравнению с менее строгим контролем (в пределах 50–95-й перцентили) – относительный риск развития ТПН в первой группе составил 0,65 (0,44; 0,94) [128]. На этих данных основывается мнение экспертов группы KDIGO [71] о том, что в детском и подростковом возрасте при наличии ХБП необходимо снижать АД до уровня ниже 50-й перцентили для соответствующего пола и возраста, вызывающее возражение оппонентов [116] в связи с недостаточностью доказательной базы для столь агрессивного подхода.
Необходимы долгосрочные и более представительные РКИ для определения целевого АД у детей и подростков с АГ при ХБП. Авторы данных рекомендаций считают на сегодня целесообразным проводить антигипертензивную терапию в соответствии с общими принципами, отраженными в Национальных рекомендациях по лечению АГ у детей и подростков [1], т.е. до уровня ниже 90-й перцентили. Вместе с тем не исключается попытка более строгого контроля АД, особенно при выраженной протеинурии, при обязательном условии тщательного контроля переносимости.
ИАПФ и БРА занимают столь же важное место в коррекции АГ у детей и подростков с ХБП, что и у взрослых. При этом авторы считают, что их выбор должен определяться, так же как и у взрослых, выраженностью альбуминурии/протеинурии. Учитывая данные о нарушении органогенеза (развитии пороков сердца, нарушении развития сосудов и тубулярного аппарата почек) при медикаментозной блокаде РАС у беременных, а также отсутствие сведений о безопасности ИАПФ и БРА в младенческом возрасте, авторы не рекомендуют использовать данные препараты в этой возрастной группе.
9. Принципы лечения АГ при ХБП у пациентов пожилого и старческого возраста
9.1. У пациентов с ХБП пожилого и старческого возраста тактика снижения АД должна быть максимально адаптированой к возрастным особенностям, состоянию сердечно-сосудистой системы, учитывать наличие сопутствующих заболеваний. Оптимальный уровень АД подбирается индивидуально с учетом переносимости лечения (НГ).
9.2. Пациентам с впервые выявленной АГ при ХБП в пожилом возрасте моложе 80 лет рекомендуется начинать ее лечение при стойком повышении САД до уровня ≥160 мм рт.ст. и поддерживать его в пределах 140–149 мм рт.ст. (1С).
9.3. Пациентам с впервые выявленной АГ при ХБП в пожилом возрасте моложе 80 лет с очень высокой альбуминурией или выраженной протеинурией (категория А3) целесообразно начинать ее лечение при стойком повышении САД в пределах 140–159 мм рт.ст. и поддерживать его в пределах 120–139 мм рт.ст. под строгим контролем безопасности терапии и при условии хорошей переносимости (2D).
9.4. Пациентам с впервые выявленной АГ при ХБП в возрасте ≥80 лет целесообразно начинать ее лечение при стойком повышении САД до уровня ≥160 мм рт.ст. и поддерживать его в пределах 140–149 мм рт.ст. под строгим контролем безопасности терапии и при условии хорошей переносимости (2D).
9.5. Диастолическое АД у пациентов пожилого и старческого возраста с АГ при ХБП рекомендуется во всех случаях снижать до уровня ниже 90 мм рт.ст., кроме больных сахарным диабетом, которым рекомендуется поддерживать ДАД на уровне ниже 85 мм рт.ст. (1С).
9.6. Лечение АГ при ХБП у пациентов пожилого и старче-
ского возраста следует начинать с небольших доз с постепенным их увеличением под тщательным контролем, учитывая очень высокий риск водно-электролитных нарушений (в т.ч. дегидратации, гипер- и гипокалиемии), острого нарушения функции почек, ортостатической гипотензии, нежелательных лекарственных взаимодействий (НГ).
9.7. Пациентам с АГ и ХБП с подобранной и хорошо переносимой антигипертензивной терапией с наступлением пожилого возраста целесообразно ее продолжать в прежнем объеме, поддерживая АД на привычном для пациента уровне с более тщательным контролем переносимости (2Д).
При выявлении АГ или ХБП впервые в пожилом и старческом возрасте необходимо тщательное диагностическое обследование (см. главу «3. Тактика обследования пациентов с АГ при ХБП»), включающее исследование почечных артерий и сосудов шеи для исключения вазоренальной АГ и оценки состояния церебрального кровотока.
Наличие ХБП характеризует прогностически наиболее неблагоприятную часть субпопуляции пожилого и старческого возраста, поскольку отражает прогрессирование гипертонической болезни, сахарного диабета и метаболического синдрома, развитие сердечной недостаточности, лекарственной болезни. Поэтому оценить пользу различных режимов антигипертензивной терапии в данной группе крайне сложно [99].
Контроль АД у пожилых связан со значительными трудностями из-за нестабильности АД, нарушения проходимости коронарных и церебральных артерий, повышения риска побочных эффектов антигипертензивных средств в условиях полипрагмазии и полиорганной недостаточности. Осложнения, обусловленные эпизодами гипотензии на фоне антигипертензивной терапии, могут оказать пагубное влияние на прогноз, перевешивающее благоприятные эффекты достижения целевого АД.
Авторы данных рекомендаций, учитывая крайне ограниченный объем и противоречивые результаты РКИ, касающихся контроля АД у пациентов пожилого и старческого возраста, не считают возможным четко определять целевые значения АД при ХБП для данной возрастной категории.
Авторы также подчеркивают важность максимальной индивидуализации лечения, более тщательного контроля в этой возрастной группе за переносимостью терапии, целесообразность проведения СМАД, измерения АД в ортостатической пробе для исключения склонности к эпизодам ночной и постуральной гипотензии.
Пациентам с впервые выявленной АГ при ХБП в пожилом или старческом возрасте тактика ведения строится в соответствии с общими рекомендациями по контролю АГ [88, 99]. На сегодня не вызывает сомнений необходимость лечения АГ у лиц пожилого возраста, однако в исследованиях, показавших его пользу, достигнутое АД в среднем оставалось выше 140 мм рт.ст. [129]. Имеется солидная доказательная база в пользу того, чтобы больным пожилого и старческого возраста начинать лечение при стойком повышении САД до уровня ≥160 мм рт.ст. и поддерживать его в пределах 140–150 мм рт.ст. [35].
В то же время не отрицается целесообразность лечения пожилых при стойком повышении САД в пределах 140–159 мм рт.ст. [88] и его поддержания в пределах 120–139 мм рт.ст., особенно при наличии выраженной протеинурии (более 0,5 г/л). Однако принцип снижения АД у пожилых до уровня ниже 140 мм рт.ст. на сегодня не имеет строгой доказательной базы. Анализ подгруппы больных старческого возраста в исследовании FEVER выявил уменьшение числа сердечно-сосудистых событий при снижении САД ниже 140 мм рт.ст. по сравнению с их частотой при САД, равном 145 мм рт.ст. [130]. В то же время два японских исследования не подтвердили преимуществ такой тактики [66, 95]. Попытка снижения АД до уровня ниже 140 мм рт.ст. у пожилого больного требует наиболее тщательного контроля безопасности и переносимости лечения (в первую очередь исключения эпизодов гипотензии), возможного только при высокой приверженности регулярным обследованиям, включающим в т.ч. биохимическое исследование сыворотки крови с определением уровня креатинина и калия, и проведении регулярных СКАД, а по возможности – СМАД. Достижение целевого АД у пожилых пациентов с ХБП должно проводиться постепенно с титрованием доз препаратов и контролем переносимости на каждом этапе.
Мета-анализ не показал значения возраста для выбора препаратов, снижающих АД [117]. Он осуществляется в соответствии с принципами, изложенными выше (см. главу «6. Фармакотерапия АГ при ХБП»). При высоких значениях альбуминурии/протеинурии (А3) препаратами выбора являются ИАПФ или БРА. При их использовании пожилыми необходим наиболее тщательный контроль за уровнем креатинина и калия сыворотки, исключение гиповолемии за счет адекватного водного режима.
Заключение
Таким образом, контроль АГ при ХБП по-прежнему занимает важное место в арсенале нефро/кардиопротективной стратегии, обеспечивая достоверное снижения риска развития ТПН и ССО. В то же время представляется первостепенным уделять более пристальное внимание вопросам переносимости и безопасности снижения АД при ХБП. Агрессивная тактика снижения АД и подавления РАС связана с серьезными осложнениями, которые могут перевешивать ожидаемую пользу. Накопленный опыт показывает необходимость индивидуализации терапии в отношении как определения целевого АД, так и препаратов первого выбора. Достижение целевого АД должно проводиться настойчиво, последовательно, но постепенно и неагрессивно.
На сегодняшний день большая часть рекомендаций по лечению АГ у пациентов с ХБП имеет низкую степень доказательности, что отражает не только малую базу РКИ, но и значительную неоднородность больных по спектру факторов, влияющих на почечный и общий прогноз. Не вызывает сомнений необходимость (как в планировании научных исследований, так и в повседневной клинической практике) комплексного подхода с учетом всей совокупности традиционных и «почечных» факторов, влияющих на уровень АД и риск ССО у пациентов с ХБП.
Проблема безопасного преодоления резистентной АГ, отмечающейся более чем у половины пациентов с ХБП, ждет своего разрешения. Необходимы новые РКИ, обсервационные исследования, посвященные разработке критериев для персонифицированного контроля АГ при ХБП.



