Введение
Анализ динамики воспалительной реакции в мочевыводящих путях представляется достаточно субъективным, если необходимо установить начало перехода от хронического к острому воспалению. Это связано с ограниченным набором индикаторов (лейкоцитоз, С-реактивный белок, СОЭ, спектр цитокинов), позволяющих регистрировать переход от одного стационарного состояния клеток крови к другому. Очевидно, что констатация острого пиелонефрита – это и понимание упущенных возможностей для ранней профилактики и лечения. Известно, что реализация воспаления в организме осуществляется путем рекрутирования и миграции лейкоцитов из крови через эндотелий в рыхлую волокнистую соединительную ткань. Однако остаются невыясненными механизмы активации циркулирующих лейкоцитов, хотя факт взаимодействия лейкоцитов и тромбоцитов (Тц) не вызывает сомнений [1]. В процессе развития воспалительной реакции активированные Тц могут индуцировать лейкоциты путем формирования тромбоцитарно-лейкоцитарных агрегатов (ТЛА) [2]. Условием взаимодействия клеток крови является активация тромбоцитов или лейкоцитов, которая проявляется повышением экспрессии адгезивных молекул, в частности CD62Р и CD40L [3]. Предлагается использовать тромбоцитарно-моноцитарные агрегаты (ТМА) как «золотой» стандарт активации тромбоцитов in vivo [4]. Несмотря на проявляемый интерес к отдельным видам ТЛА, значение соотношения разных агрегатов при реализации воспаления остается непонятным. Отсутствуют знания, касающиеся роли различных агонистов, стимулирующих клетки при формировании ТЛА, а также механизмов, обеспечивающих поддержание хронического воспаления, и переход к острой воспалительной реакции. Такая информация могла бы приблизить к пониманию процессов селективного рекрутирования нейтрофилов (Нф), моноцитов (М), лимфоцитов (Лф) и эозинофилов (Эо) из крови, т.е. их активации, адгезии и миграции, а следовательно, механизмов рецидивирования пиелонефрита при уролитиазе.
Цель исследования – установить участие тромбоцитов и роль агонистов (адреналина и АДФ) в формировании тромбоцитарно-лейкоцитарных агрегатов при поддержании хронического воспаления и инициации на этом фоне острой воспалительной реакции у пациентов, страдающих хроническим обструктивным пиелонефритом.
Материал и методы
В исследование включены 43 пациента с хроническим обструктивным пиелонефритом (ХОПН), верифицированным на основании жалоб больных, анамнеза заболевания, объективного осмотра, результатов клинико-лабораторных и инструментальных исследований. В фазе ремиссии ХОПН обследованы 26 больных и в фазе рецидива – 17. Тц выделяли путем центрифугирования из цитратной периферической крови пациентов. Для анализа функционального состояния Тц использовали агонисты АДФ и адреналин (Sigma) в концентрации ЕС50 (5 мкМ), воспроизводящей амплитуду агрегации 50% у здоровых лиц. Оценку агрегации Тц проводили на агрегометре Chrono-log (USA). В мазках периферической крови подсчитывали количество интактных тромбоцитарно-лейкоцитарных агрегатов (ТЛА), т.е. агрегатов тромбоцитов с нейтрофилами, моноцитами, лимфоцитами, эозинофилами, которые сформировались без какого-либо воздействия исследователя на клетки крови. Формирование ТЛА также моделировали in vitro в условиях инкубации стимулированных тромбоцитов (адреналин или АДФ в концентрации ЕС50) и интактных лейкоцитов, выделенных из периферической крови пациентов с ХОПН. В дальнейшем проводили морфометрические исследования мазков суспензии клеток после окраски по методу Романовского–Гимзе. При этом учитывали следующие параметры: количество ТЛА (на 100 лейкоцитов); состав лейкоцитов, вовлеченных в формирование агрегатов (на 100 лейкоцитов); соотношение основных типов агрегатов: тромбоцитарно-нейтрофильных (ТНфА), тромбоцитарно-моноцитарных (ТМА) и тромбоцитарно-лимфоцитарных агрегатов (ТЛфА). Все клинические исследования выполнены по согласованию с комиссией по биоэтике Донецкого национального медицинского университета им. М. Горького.
Статистическая обработка осуществлена с помощью пакета MedStat (ДонНМУ, Украина) и MedCalc (v.12.5.0.0). Размер выборки определен на основании сравнения двух средних с мощностью 80% и на уровне значимости 5%.Точечная оценка величин, подлежащих анализу, проведена путем расчета среднего арифметического признаки (Х) или ее медианы (Me) и соответствующей стандартной погрешности (m). При анализе межгрупповых различий применяли критерий Стьюдента (в случае нормального закона распределения), критерий Вилкоксона (в случае различия закона распределения от нормального). Во всех случаях отличие считалось статистически значимым при уровне значимости р<0,05.
Результаты
Результаты исследования показали, что общее количество ТЛА в фазе рецидива ХОПН на 29,8% больше, чем в фазе ремиссии (соответственно 3,295±0,183 и 2,538±0,116%; р<0,001). Имеет смысл отметить, что в фазу ремиссии ХОПН агрегаты были представлены ТНфА (2,000±0,288%) и ТМА (0,538±0,116%), т.е. Тц в 3,72 чаще взаимодействовали с нейтрофилами, чем с моноцитами. В фазу рецидива спектр ТЛА был представлен всеми исследованными лейкоцитами, в т.ч. ТЭоА и ТЛфА (см. таблицу). При ранжировании количества сформированных агрегатов этот ряд выглядит следующим образом: ТНфА>ТМА>ТЭоА>ТЛфА. Хотя количество ТНфА и ТМА статистически значимо не различались в фазу рецидива и ремиссии (р>0,1), соотношение ТНфА и ТМА в фазу рецидива было ниже 3,1. Таким образом, общая численность интактных ТЛА крови может быть индикатором наличия воспалительной реакции в разных фазах ХОПН, при этом соотношение агрегатов Тц с разными лейкоцитами, вероятно, отражает особенности взаимодействия клеток крови при реализации хронического и острого воспаления.
Установлено, что в фазе ремиссии ХОПН после предварительной стимуляции Тц возрастает их взаимодействие с интактными (не стимулированными) лейкоцитами. Численность ТЛА увеличивается на 64,2% при действии адреналина (р<0,001) и на 25,1% под влиянием АДФ (р<0,05; относительно количества интактных ТЛА). Различия между эффектами адреналина и АДФ, обеспечивающие формирование ТЛА, достигали 31,2% (р<0,01). Следовательно, активация и сенситивность их рецепторов к разным агонистам могут лежать в основе формирования ТЛА. В фазу ремиссии адреналин проявлял более выраженный, чем АДФ, эффект на формирование ТЛА.
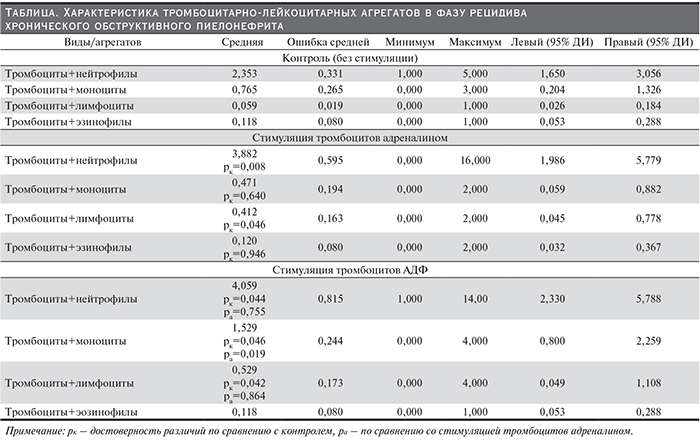
Можно было предположить, что при наличии острого воспаления происходит активация Тц, тем самым создаются условия для рекрутирования лейкоцитов из крови, количество которых при рецидиве значительно больше, чем при ремиссии ХОПН. В фазу рецидива ХОПН адреналин и АДФ вызывали увеличение общего количества ТЛА соответственно на 48,2 (р<0,001) и 89,2% (р<0,001) по сравнению с их численностью до стимуляции. Следовательно, при рецидиве ХОПН эффект АДФ на формирование ТЛА более выраженный, чем у адреналина. При индукции Тц адреналином достигнутый результат не отличался в фазах ремиссии и рецидива ХОПН (р>0,05). Обращает на себя внимание, что адреналин в фазу рецидива вызывал формирование большего количества ТЛА (на 96,4%; р<0,001), чем АДФ, в фазу ремиссии. Таким образом, адреналин и АДФ являются постоянными регуляторами реализации воспалительной реакции при рецидиве и ремиссии ХОПН; более выраженный провоспалительный эффект АДФ проявляется при формировании ТЛА в фазу рецидива ХОПН.
В фазу ремиссии ХОПН Тц, которые предварительно были инкубированы с адреналином, взаимодействовали с основными лейкоцитами, причем по сравнению с контролем количество ТНфА увеличилось на 45,8% (до 2,917±0,442%; р<0,05) и ТМА – на 47,2% (до 0,792±0,241%; р<0,05). При стимуляции тромбоцитов АДФ количество ТНфА повышалось незначительно (на 10,8% до 2,217±0,435%; р<0,05), тогда как ТМА возросли на 45,5% (0,783±0,251; р<0,05) и становились сопоставимыми с таковыми при действии адреналина. В отличие от контроля адреналин и АДФ воспроизводили формирование ТЛфА и ТЭоА. В случае стимуляции Тц адреналином количество ТЛфА достигало 0,375±0,215%; и отношение ТНфА/ТЛфА составило 7,78:1. При стимуляции Тц АДФ количество лимфоцитов, ассоциированных с Тц, было значительно меньше (0,043±0,035%; р<0,01), чем в случае индукции Тц адреналином, в результате чего отношение ТНфА/ТЛфА составило 51,5:1. Можно предположить, что АДФ с помощью Тц воспроизводит иную модель взаимоотношения клеток крови, участвующих в хронизации воспаления, по сравнению с адреналином.
В фазу рецидива ХОПН активированные Тц также формировали ТЛА с различными лейкоцитами. В случае стимуляции Тц адреналином количество ТНфА увеличилось на 65% (р<0,01 по сравнению с контролем). При этом наблюдалась инверсия взаимоотношений активированных Тц с моноцитами и лимфоцитами. Так, ТМА уменьшилась на 46,2% (р=0,640), а ТЛфА существенно повысилась (р=0,046); соотношение ТМА/ТЛфА составило 1,14. Для сравнения в фазе ремиссии такое соотношение агрегатов в условиях стимуляции Тц адреналином составило 2,12. Если моноциты являются регулятором развития воспалительной реакции, в данном случае адреналин с помощью Тц будет ограничивать участие М в хронизации воспаления. В связи с этим имеет смысл сравнить соотношение ТНфА/ТМА в контроле и в условиях стимуляции Тц адреналином соответственно 3,1 и 8,2, т.е. увеличивается количество НФ, стимулированных активированными Тц.
При инкубации Тц с АДФ формирование ТНфА превышало контрольные значения на 72,5% (р=0,044) и количество ТНфА при ремиссии на 83,1% (р=0,018). Количество ТМА и ТЛфА повысилось (р<0,05) и соотношение ТМА/ТЛфА составило 2,89. Если сравнивать с эффектом адреналина в фазу рецидива, то создается впечатление, будто при действии АДФ тромбоциты в большей степени, чем с лимфоцитами, взаимодействуют с моноцитами, Следствием такой кооперации клеток крови может быть ограничение острой воспалительной реакции, иначе, чем можно объяснить уменьшение соотношения ТНфА/ТМА до 2,65 вместо 8,24 в условиях стимуляции Тц адреналином. При регуляции острого воспаления у пациентов с ХОПН, вероятно, АДФ не только повышает количество активированных нейтрофилов с помощью Тц, но и опосредованно через моноциты может ограничивать развитие/выраженность воспалительной реакции. В этом контексте соотношение ТНфА/ТМА в условиях стимуляции Тц адреналином и АДФ (соответственно – 8,24 и 2,65) подтверждает специфичность АДФ как регулятора межклеточной кооперации. Стимуляция Тц адреналином сопровождалась повышением количества ТЛфА примерно в 7 раз по сравнению с контролем (р=0,046) и становилась сопоставимой с таковой при ремиссии (р=0,901). При этом отношение ТНфА/ТЛфА составило 9,42. Участие Тц активированных АДФ приводило к увеличению количества ТЛфА в 8,97 раза по сравнению с контролем (р=0,042) и на 28,4% больше, чем в случае активации Тц адреналином (р=0,864). На фоне повышения обоих типов агрегатов отношение ТНфА/ТЛфА составило 7,67 и было меньше, чем при стимуляции Тц адреналином. Таким образом, в условиях рецидива ХОПН АДФ не только повышает численность активированных нейтрофилов и лимфоцитов, но и, вероятно, обеспечивает поддержание оптимального соотношения этих лейкоцитов при развитии острого воспаления.
Обсуждение
Проспективная оценка реактивности Тц в диагностике прогрессирования заболеваний почек остается невостребованной в нефрологии. Хотя участие Тц в тромбогенезе и развитии воспаления не вызывает сомнений, привлечение индикаторов функционального состояния Тц для анализа воспалительной реакции в почках и мочевыводящих путях встречается крайне редко. Причины этого кроются прежде всего в недостаточности фактов, объясняющих взаимодействие Тц и лейкоцитов при реализации хронического и острого воспаления. Тем не менее можно констатировать, что прикрепление активированных Тц к лейкоцитам приводит к стимуляции последних [5], в результате этого повышается продукция цитокинов и экспрессия молекул адгезии на поверхности лейкоцитов. При формировании ТНфА доказано увеличение хемотаксиса лейкоцитов в органы и амплификация воспалительной реакции, опосредованной нейтрофилами [6]. Этим, вероятно, можно объяснить истощение активности миелопероксидазы у 50% нейтрофилов, связанных с Тц [7]. Тромбоциты при взаимодействии с нейтрофилами могут не только усиливать, но и ограничивать воспалительную реакцию. Подтверждение тому можно найти в исследовании [8]. Оказалось, что докозагексаеновая кислота преобразуется тромбоцитарной 12-липоксигеназой в 13S, 14S-эпокси-Маресин, который в нейтрофилах трансформируется в Маресин-1 (MaR1). Внутрисосудистый MaR1 обладает протективными свойствами, которые проявляются снижением нейтрофильной инфильтрации, отека и гипоксии тканей, а также секреции молекул, вызывающих воспаление. Таким образом, тромбоцитарно-нейтрофильные взаимодействия характеризуются продукцией MaR1, который регулирует развитие воспаления в органах. Установлено участие тромбоцитарно-лимфоцитарных агрегатов в фиброзировании миокарда [9]. В литературе приводятся доказательства, согласно которым увеличение численности тромбоцитарно-моноцитарных агрегатов в крови является ранним индикатором воспаления. Последующее развитие событий характеризуется образованием провоспалительного фенотипа моноцитов CD14 (+++) CD16 (+), которые демонстрируют повышенную адгезию к эндотелию [10].
В свете данного факта становится понятным, почему изменения в тромбоцитарно-моноцитарных взаимодействиях связаны с повышенным риском смертности у пожилых пациентов при сепсисе [11]. Достигаемый эффект при взаимодействии Тц и лейкоцитов, вероятно, определяется спектром биологически активных веществ, которые секретируются активированными Тц. Так, [12] продемонстрировали, что при инкубации Тц, выделенных из крови больных с лихорадкой денге, моноциты здоровых добровольцев секретировали провоспалительные цитокины (ИЛ-1β, 8, 10), тогда как при инкубации Тц и моноцитов здоровых лиц этот эффект не воспроизводился. Логично предположить, что ингибирование формирования ТЛА позволит ограничивать развитие воспаления. Проведенные исследования в этом направлении прибавляют оптимизма. В 2011 г. [13] констатировали, что у пациентов с острым ишемическим инсультом на 10-й день лечения аспирином не выявлены различия значений воспалительных биомаркеров при исследовании как интактных, так и стимулированных Тц. Однако уже в 2013 г. приводятся данные доклинических и клинических исследований человеческого анти-Р-селектина (Inclacumab), влияющего на взаимодействие лейкоцитов и Тц [14]. Доказано, что препарат подавляет формирование ТЛА у здоровых лиц и пациентов с заболеваниями периферических артерий, а также ингибирует активацию лейкоцитарного интегрина Mac-1 и адгезию лейкоцитов с Тц. Эффект воспроизводился независимо от антагониста индуцирующего Тц. Казалось бы, формирование ТЛА не зависит от синтеза ТхВ2 и определяется исключительно адгезивными молекулами, которые секретируются активированными Тц. В 2014 г. [15] публикуют сообщение, что антагонист P2Y12-рецепторов (ticagrelor) оказывает противовоспалительное действие и полностью ингибирует образование тромбоцитарно-нейтрофильных агрегатов. Данная публикация, по сути, может рассматриваться как доказательство того, что АДФ принимает участие в формировании ТЛА. Использование разных агонистов для активации Тц при моделировании ТЛА означает, что они могут принимать участие в регуляции воспалительной реакции. Оставалась невыясненной роль адреналина и АДФ в реализации хронического и острого воспаления. Проведенные исследования показали, что оба агониста принимают участие в формировании ТЛА, обеспечивающих индукцию и поддержание воспаления при ХОПН. Однако, если в фазу рецидива ХОПН АДФ проявляет более выраженный эффект на формирование ТЛА по сравнению с адреналином (при использовании в обоих случаях одинаковой концентрации ЕС50), то можно предположить наличие разных фенотипов Тц при развитии острого и поддержании хронического воспаления в мочевыводящих путях. Не менее важным представляется вопрос: почему при стимуляции Тц одними и теми же агонистами (адреналином и АДФ) формируется разный состав ТЛА в фазах ремиссии и рецидива? При формулировании ответа необходимо руководствоваться тем фактом, что активации подвергались только Тц, а лейкоциты оставались интактными. В этом случае возможно: (а) Тц секретируют разный спектр провоспалительных молекул (СТ, Са2+, АДФ, ФАТ, адреналин, активные формы кислорода и др); (б) имеет место различная чувствительность рецепторов лейкоцитов к секретируемым биологически активным веществам; (в) в силу индивидуальной реактивности организма существует разное сочетание функционирующих рецепторов (паттерн рецепторов) к одним и тем же агонистам на поверхности моноцитов, нейтрофилов, лимфоцитов и эозинофилов. Дальнейшие исследования позволят не только подойти к пониманию регуляции оптимального соотношения разных видов лейкоцитов при развитии острого воспаления, но и обосновать новые возможности управления фазой рецидивирования ХОПН.



