Введение
Хроническая обструктивная болезнь легких (ХОБЛ) является значимой медико-социальной проблемой, обусловленной как высокой распространенностью заболевания, так и многочисленными внелегочными эффектами [1]. Среди системных эффектов ХОБЛ ведущее место занимают сердечно-сосудистые проявления, являющиеся основной причиной летальности. Развитию кардиоваскулярной патологии при ХОБЛ, несомненно, способствует суммарное воздействие различных факторов риска (ФР), имеющихся у пациентов с данной патологией, – длительный стаж курения, возраст, преимущественно мужской пол, прием β2-адреноагонистов, хроническое системное воспаление [2]. Поскольку сопутствующие заболевания напрямую влияют на прогноз пациентов с ХОБЛ, их своевременная диагностика и лечение имеют важное значение [3].
В настоящее время доказано, что ключевым моментом в развитии и прогрессировании как кардиоваскулярной патологии, так и дисфункции почек является альбуминурия, что нашло отражение в международных рекомендациях экспертов [4, 5]. С современных позиций уровень альбуминурии свыше 10 мг/сут имеет достоверную взаимосвязь с риском сердечно-сосудистых осложнений и достоверно повышает смертность от всех причин [4, 5]. Имеются отдельные работы, в которых изучалась протеинурия у пациентов с ХОБЛ, однако выбора оптимальной методики оценки протеинурии не проводилось, кроме того, не изучалась и взаимосвязь протеинурии с частотой обострений ХОБЛ и тяжестью симптомов [6, 7].
Цель исследования: оценить частоту альбуминурии и информативность различных методов определения протеинурии у пациентов с ХОБЛ.
Материал и методы
В исследование включены 200 пациентов ГБУЗ ККБ № 2 Краснодара с диагнозом ХОБЛ (70% мужчин, средний возраст – 65,9±10,8 года, средний стаж болезни – 17,2±2,2; 30% женщин, средний возраст – 62,1±6,9 года, средний стаж болезни – 8,7±2,1) и 25 здоровых добровольцев сопоставимого возраста и пола. Диагноз ХОБЛ установлен в соответствии с рекомендациями GOLD (2014) с учетом количества обострений в год, тяжести одышки по модифицированной шкале MRC (mMRC), качества жизни по шкале респираторного вопросника госпиталя св. Георгия (SGRQ) для больных ХОБЛ, показателей 6-минутного шагового теста (6-МШТ), оценочного САТ – теста оценки вентиляционной функции [8, 9]. Пациенты разделены на 4 группы – группы А и В с редкими (0–1 в год), группы С и D с частыми (2 и более в год) обострениями. Группы А и D – с маловыраженными, группы В и C – с выраженными симптомами (табл. 1). Степень никотиновой зависимости определена по индексу курящего человека (ИКЧ), рассчитанного как количество выкуриваемых сигарет в день, умноженное на стаж курения (годы)/20 [8]. На первом этапе всем пациентам проведено определение уровня протеинурии полуколичественным методом «сухой химии» с помощью тест-полосок в рамках стандартного общеклинического обследования. Кроме того, всем пациентам как минимум в двух последовательных тестах (разовая утренняя порция мочи) исследован уровень протеинурии. Данному методу было отдано предпочтение, т.к. он, по современным представлениям, оптимален по информативности и удобству сбора [10]. С целью коррекции возможных погрешностей из-за водного режима проведен расчет соотношений общий белок–креатинин (Об/Кр) и альбумин–креатинин (Ал/Кр).
Исследование уровня протеинурии проведено методом спектрофотометрии с пирогаллоловым красным, определение альбуминурии и креатинина мочи исследовано с помощью кинетического теста, основанного на реакции Яффе, уровень электролитов – непрямой потенциометрией с использованием ионселективных электродов. С целью исследования состояния канальцевого аппарата почек проведено исследование экскреции β2-микроглобулина турбидиметрическим методом с латексным усилением [11, 12]. Индексация протеинурии осуществлена согласно рекомендация KDIGO-2013 и научного общества нефрологов России-2012, где А1 – норма или незначительное повышение (Ал/Кр<3,0 мг/ммоль или Об/Кр<15 мг/моль), А2 – умеренное повышение (Ал/Кр 3–30 или Об/Кр 15–50 мг/ммоль), А3 – значительное повышение (Ал/Кр>30 или Об/Кр>50 мг/ммоль) [13, 14]. Полуколичественный анализ мочи выполнен на автоматическом анализаторе Cobas u 411 с помощью тест-полосок Combur Test M (Roche Diagnostics). Остальные исследования выполнены на автоматическом анализаторе для клинической химии AU640 с использованием реагентов производства Beckman Coulter (США) и BioSystems (Испания). Оценка вентиляционной функции проведена на спирографе EasyOne Pro фирмы Ultrasound Spirometry Lab (Швейцария).

Исследование выполнено в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинкской декларации. Протокол исследования был одобрен локальным этическим комитетом. До включения в исследование от всех пациентов получено письменное информированное согласие.
Статистическая обработка проведена методами вариационной статистики с использованием пакета статистической программы Statistica 7.0 for Windows. Для проверки нормальности распределения признака использовали метод Колмогорова–Смирнова, распределение считали нормальным при р>0,05. С целью изучения статистической взаимосвязи между явлениями применен коэффициент ранговой корреляции Спирмена. Оценка значимости различий двух средних величин при нормальном распределении осуществлена с помощью t-критерия Стьюдента, при отклонении от нормального нормального использовали критерий Манна–Уитни. Для оценки статистической значимости различий двух или нескольких относительных показателей использован критерий χ2. Разница считалась достоверной при достигнутом уровне значимости р<0,05. Данные представлены в виде М±SD.
 Результаты исследования
Результаты исследования
Согласно полученным нами данным, значимых различий по возрасту, длительности заболевания, ИМТ, ИКЧ, показателям функции внешнего дыхания между группами пациентов с ХОБЛ не выявлено (табл. 1).
Сравнительный анализ средних с помощью t-критерия Стьюдента для парных выборок выявил статистически достоверные различия (p<0,05) показателей протеинурии при исследовании методом «сухой химии» и количественным методом с пирогаллоловым красным (табл. 2).
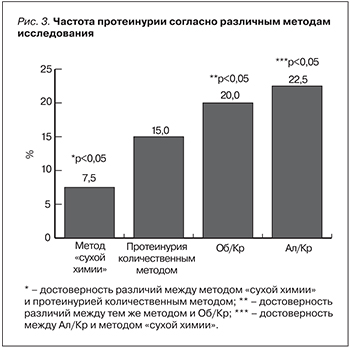
Сравнительный анализ процентных соотношений показал, что при применении количественного метода частота выявления протеинурии у больных ХОБЛ достоверно выше (p<0,05).
В группах с редкими обострениями (группы А и В) различия не достигали достоверных значений, но отчетливо видна тенденция к занижению уровня протеинурии у пациентов с ХОБЛ при использовании полуколичественных методов (рис. 1).
В группе добровольцев протеинурия выявлена только при оценке количественным методом, средний уровень ее составил 0,05±0,01 г/л. Согласно полученным данным, наиболее высокий средний уровень протеинурии (0,06±0,01 г/л) при оценке полуколичественным методом был выявлен у больных ХОБЛ в группе D; эти различия были достоверными по сравнению с пациентами группы А и В (p<0,05). Вместе с тем различия между группами С и D были недостоверными (p>0,05). Наиболее высокие средние уровни протеинурии по данным количественного исследования выявлены в группах C и D (0,09±0,02 и 0,13±0,04 г/л соответственно), что достоверно выше, чем в группе контроля (0,03±0,01 г/л, p<0,05). Кроме того, различия были достоверными между группами больных ХОБЛ с редкими обострениями (А и В) и группой контроля, а также между группой А и группой D (0,06±0,02 vs. 0,13±0,04 г/л соответственно, p<0,05).
На основании расчета альбумин-креатининового соотношения у больных ХОБЛ выявлена достоверно более высокая доля пациентов с клинически значимой протеинурией (А2, А3), составившая 22,5%. Вместе с тем при использовании соотношения Об/Кр доля пациентов ХОБЛ с протеинурией составила 15%. Распределение пациентов по группам представлено на рис. 2. При сравнении данных по частоте протеинурии, полученной различными методами, статистическая достоверность была достигнута только в группах с редкими обострениями (p<0,05).

При расчете белок-креатининового соотношения выявлено, что средние значения данного показателя в группе D достоверно выше, чем в группах больных ХОБЛ с редкими обострениями (группы А и В) и в группе контроля (19,8±4,8 ммоль/л в группе D vs. 7,5±2,6 ммоль, 10,5±2,8 ммоль и 2,7±0,3 мг/ммоль в группах А, В и контрольной соответственно, p<0,05). Между группами С и D достоверных различий не получено (p>0,05). При этом значения, соответствовавшие градации А2 – Об/Кр 15–50 мг/ммоль, соответствовавшие умеренному повышению экскреции белка, выявлены в группах с редкими обострениями (4,5 и 11,1% в группах А и В соответственно) (рис. 2) [13, 14]. Доля пациентов с соотношением Об/Кр в диапазоне 15–50 мг/ммоль (А2-повышенный уровень) была достоверно выше в группах с частыми обострениями (11,9 и 14,7% пациентов в группах С и D vs. 4,5 и 2,7% в группе А и В, p<0,05). Начиная с группы В, у 2% пациентов величина Об/Кр превысила 50 мг/ммоль, что относится к высокой протеинурии (А3; Об/Кр>50 мг/ммоль). Доля пациентов с протеинурией >50 мг/ммоль оказалась также достоверно выше в группе D (20,6% vs. 2% в группе В, 0% в группе А), между группами С и D достоверных различий не выявлено (p>0,05). Среди пациентов группы контроля диагностически значимых величин протеинурии (Oб/Кр>15 мг/ммоль) выявлено не было.
 Средние уровни АУ у пациентов с ХОБЛ были достоверно выше по сравнению с контрольной группой (30,4±4,2 vs. 7,6±2,1 мг/л, p<0,05). Наибольший уровень АУ выявлен в группе D (49,9±8,4 мг/л vs. 7,6±2,1 мг/л в контрольной группе, p<0,05). Также различия уровней АУ были достоверными между группой контроля и группами А, В, С (7,6±2,1 мг/л vs. 16,2±3,5 мг/л, 26,4±2,9 мг/ммоль, 29,7±4,9 мг/л соответственно, p<0,05). Получена отрицательная корреляция средней силы между показателем ОФВ1 и АУ (r=-0,574, p<0,05).
Средние уровни АУ у пациентов с ХОБЛ были достоверно выше по сравнению с контрольной группой (30,4±4,2 vs. 7,6±2,1 мг/л, p<0,05). Наибольший уровень АУ выявлен в группе D (49,9±8,4 мг/л vs. 7,6±2,1 мг/л в контрольной группе, p<0,05). Также различия уровней АУ были достоверными между группой контроля и группами А, В, С (7,6±2,1 мг/л vs. 16,2±3,5 мг/л, 26,4±2,9 мг/ммоль, 29,7±4,9 мг/л соответственно, p<0,05). Получена отрицательная корреляция средней силы между показателем ОФВ1 и АУ (r=-0,574, p<0,05).
Наименьший средний уровень соотношения Ал/Кр выявлен в контрольной группе (0,9±0,2 мг/ммоль), что оказалось достоверно ниже, чем у пациентов с ХОБЛ (0,9±0,2 мг/ммоль vs. 5,4±1,7 мг/ммоль в группе А, 10,8±2,5 мг/ммоль в группе В, 16,3±6,3 мг/ммоль в группе С, 23,4±4,8 мг/ммоль в группе D, p<0,05). Уровень Ал/Кр в группе D был достоверно выше по сравнению с группой А и В (23,4±4,8 мг/ммоль vs. 5,4±1,7 мг/ммоль и 10,8±2,5 мг/ммоль соответственно, p<0,05). Диагностически значимый уровень Ал/Кр, соответствовавший А2 (3–30 мг/ммоль), в группе контроля был обнаружен у 8% пациентов. Достоверные различия в доле пациентов с Ал/Кр-соотношением, соответствовавшим уровню протеинурии А2 (умеренное повышение), выявлены между группами А и С (5,5% vs. 12% соответственно, р<0,05), а также между группами А и D (5,5% vs. 22% соответственно, p<0,05). Доля пациентов с протеинурией, соответствовавшей степени А3 (высокая протеинурия), также была достоверно выше в группе D по сравнению с группой В (16,6% vs. 7,4%, p<0,05). В группе А и группе контроля протеинурия уровня А3 отсутствовала (рис. 3).
Диагностически значимые уровни протеинурии (>0,1 г/л) уже на этапе определения методом «сухой химии» выявлены у 10,3% больных ХОБЛ группы D, что существенно ниже, чем при определении протеинурии количественным методом, выявившим 20,6% пациентов с протеинурией более 0,1 г/л. Это объясняется большей долей погрешности при использовании полуколичественного метода, возникающей из-за неоднородной чувствительности к различным белкам, зависимости от pH мочи и многих других факторов. Стандартные тест-полоски для полуколичественного анализа выявляют общий белок при концентрации выше 100–200 мг/л (0,01–0,02%), т.е. не чувствительны к низким концентрациям альбумина (микроальбуминурии) [13, 14]. Расчет белок- и альбумин-креатининового соотношения проведен с целью нивелировать возможные ошибки, связанные с разведением мочи, что позволяет отказаться от суточного сбора мочи, что было отражено в рекомендациях [13, 14]. Рис. 3 иллюстрирует преимущества определения протеинурии количественным методом перед методом «сухой химии».
Средние уровни β2-МГ у пациентов с ХОБЛ были достоверно выше, чем в контрольной группе (0,56±0,08 vs. 0,04±0,01 мг/л, p<0,05). При межгрупповом сравнении наиболее высокий средний уровень β2-МГ зарегистрирован в группе D (0,78±0,05 vs. 0,34±0,04 мг/л в группе С, 0,15±0,03 – в группе В, 0,09±0,02± мг/л – в группе А, p<0,05).

Обсуждение
В настоящее время уровень АУ рассматривается как независимый предиктор сердечно-сосудистой заболеваемости и смертности даже среди лиц без СД и АГ [15]. Вместе с тем АУ является ранним чувствительным маркером почечного повреждения и прогностически неблагоприятным признаком его прогрессирования [4–6]. В нашем исследовании выявлена высокая частота клинически значимой АУ у пациентов с ХОБЛ, достигшая 22,5% при расчете Ал/Кр-соотношения, что сопоставимо с данными программы CHARM (Candesartan in Heart failure: Assessment of Reduction in Mortality and morbidity), где анализировалась распространенность АУ у пациентов с хронической сердечной недостаточностью, составившей 41% (11% макроальбуминурии и 30% микроальбуминурии) [16]. При артериальной гипертензии частота АУ составляет от 30–40%, что также сопоставимо с полученными нами данными [16]. Причинами развития АУ при ХОБЛ могли стать как собственно системные эффекты ХОБЛ, так и имевшиеся коморбидные заболевания и многочисленные факторы риска дисфункции почек, что находит подтверждение в различных исследованиях [18–20]. Достоверно более высокий уровень мочевой экскреции β2-МГ в группах больных ХОБЛ с частыми обострениями также указывает на неблагоприятное влияние оксидативного стресса, развившегося при ХОБЛ, на канальцевый аппарат почек [11, 12].
Полученные нами данные о более высокой информативности определения протеинурии количественным методом перед методом «сухой химии» согласуются с результатами отечественных и зарубежных исследователей [13, 21]. Достоверные различия в частоте протеинурии, соотношения Об/Кр в группах больных ХОБЛ с частыми обострениями по сравнению с группой контроля, а также обратная корреляция с величиной ОФВ1, вероятно, обусловлены влиянием системного воспаления при ХОБЛ, что показано в некоторых зарубежных работах [6, 7]. Соотношение Ал/Кр показало более высокую частоту клинически значимой протеинурии по сравнению с Об/Кр в группах с редкими обострениями, что демонстрирует преимущества метода, что также согласуется с данными о его более высокой чувствительности [13, 22].
Таким образом, согласно полученным нами данным, наиболее информативным методом диагностики протеинурии как маркера ранней дисфункции почек у больных ХОБЛ является альбумин-креатининовое соотношение.
Выводы
- Наиболее информативным маркером ранней дисфункции почек у пациентов с ХОБЛ является альбумин-креатининовое соотношение.
- Самые высокие средние уровни АУ, белок-, альбумин-креатининового отношения и маркера канальцевой дисфункции β2-МГ выявлены у больных ХОБЛ с частыми обострениями.
- Выявлена достоверная обратная корреляция между тяжестью бронхиальной обструкции и β2-МГ и АУ.



