Введение
Анатомические и клинические аспекты сдавления левой почечной вены в аортомезентериальном пинцете впервые описаны A.R. El-Sadr, E. Mina в 1950 г. [1]. Позднее A. De Schepper назвал это состояние синдромом щелкунчика (NСS – Nutcracker syndrome) [2]. Анатомической основой NСS служит аортомезентериальная (мезаортальная) компрессия левой почечной вены – сдавление левой почечной вены верхней брыжеечной артерией с развитием левосторонней почечной флебогипертензии [3]. К основным причинам сдавления левой почечной вены относят врожденные особенности отхождения верхней брыжеечной артерии от аорты, когда угол между артерией и аортой уменьшается до острого, создавая препятствие нормальному расположению левой почечной вены, а также ретроаортальное, или кольцевидное, расположение самой вены [4].
Следует различать феномен и синдром шелкунчика.
В первом случае сдавление вены не сопровождается формированием градиента давления между левой почечной и нижней полой венами, во втором – компрессия левой почечной вены приводит к гемодинамически значимым нарушениям оттока крови по этому сосуду, превышению венозного давления в левой почечной вене над таковым в нижней полой вене [3].
Таким образом, далеко не у каждого пациента с компрессией левой почечной вены развивается симптоматика NCS: боль в животе, левом боку или малом тазу, мочевые изменения, варикоцеле у мужчин, диспареурия и дисменоррея у женщин [5]. Исследование с помощью мультиспиральной компьютерной томографии (МСКТ) показало сужение левой почечной вены более чем на 50 у 27% бессимптомных пациентов [6].
Истинная распространенность NCS до сих пор не известна. С одной стороны, это объясняется возможной редкостью патологии, с другой – не исключены диагностические ошибки, когда в отсутствие адекватного ангиографического обследования приходят к заключению о наличии у больного инфекции мочевыводящих путей, гломерулонефрита, нефроптоза, солевого диатеза либо мочекаменной болезни [7].
Приводим два характерных случая NCS в нефрологической практике. Оба обнаружены при исследовании анализов мочи на фоне острой респираторной вирусной инфекции, что первоначально послужило основанием подозревать заболевание гломерулонефритом.
Клинический случай 1
Пациент С. 17 лет направлен в нефрологическое отделение в декабре 2017 г. в связи с выявлением протеинурии до 2,24 г/л. Мочевые изменения появились впервые на второй день острого респираторного заболевания. В анамнезе указывалось, что 4 месяца назад пациент оперирован по поводу левостороннего варикоцеле без осложнений. Среди кровных родственников прямых или косвенных указаний на заболевания почек не прослеживалось.
При поступлении жалоб не предъявляет. Температура – 36,6°С, рост – 182 см, вес – 76 кг, индекс массы тела (ИМТ) – 23,0 кг/м2. Отеков нет. Артериальное давление (АД) – 120/70 мм рт.ст. В общем анализе мочи относительная плотность – 1,023, белок– 0,02 г/л, по пробе Нечипоренко лейкоцитов – 2×103/мл, эритроцитов – 4×103/мл. Суточная протеинурия – 0,13 г. Общий белок крови – 73 г/л, альбумины – 47 г/л, мочевина – 5,3 ммоль/л, креатинин – 85 мкмоль/л, скорость клубочковой фильтрации по пробе Реберга – 119 мл/мин/1,73 м2. Эритроциты крови – 5,31×1012/л, гемоглобин – 147 г/л, лейкоциты – 6,96×109/л, тромбоциты – 240×109/л, СОЭ – 4 мм/ч. Показатели гемостаза в норме (фибриноген – 348 мг/дл, активированное частичное тромбопластиновое время – 34 секунды, международное нормализованное соотношение [МНО] –0,93).
При ультразвуковом исследовании (УЗИ) размеры правой почки – 11×49 мм, левой – 115×52 мм, толщина паренхимы – 20 мм с обеих сторон, эхогенность в норме, структура полостной системы почек без патологии.
На основании полученных данных заподозрен хронический гломерулонефрит и выполнена нефробиопсия левой почки.
При светооптическом исследовании все 19 клубочков из серии срезов нормальных размеров, нормоклеточные, мезангий не расширен, капиллярные стенки не утолщены, одноконтурные. Эпителий извитых канальцев со слабой зернистой дистрофией, цилиндров не выявлено. Интерстиций без склероза и клеточной инфильтрации, скоплений пенистых клеток нет. Артериолы и артерии малого калибра сохраняют нормальное строение.
Иммунофлуоресцентное исследование проведено на замороженных срезах с антисыворотками к IgA, IgG, IgM, C3, C1q, k-λ – легким цепям, фибриногену, фибрину. В препарате корковый слой почки до 40 клубочков в срезах, полностью склерозированных клубочков нет. Со всеми реагентами результат в клубочках отрицательный.
Заключение. По светооптическим и иммунофлуоресцентным данным признаков иммунокомплексного поражения, в т.ч. IgA-нефрита, не обнаружено.
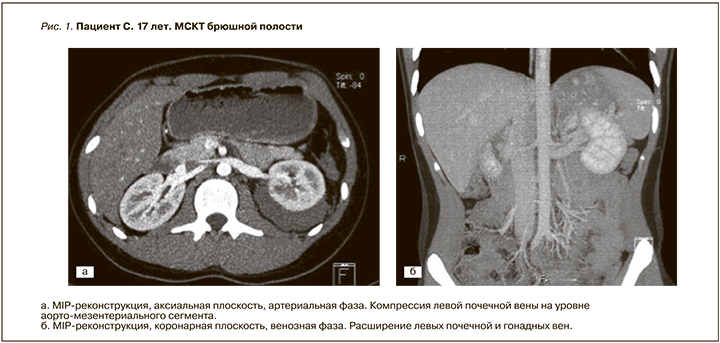
Возникновение мочевого синдрома в юношеском возрасте, указание в анамнезе на оперативное лечение по поводу левостороннего варикоцеле заставили включить в план дифференциального диагноза почечную венозную гипертензию. Для уточнения характера патологических изменений проведена МСКT органов брюшной полости на 16-срезовом томографе «Somatom Emotion» производства фирмы «Siemens», с конфигурацией детекторов 16×1,2 мм, с использованием стандартного внутривенного контрастирования (Омнипак – 350 мг йода/мл из расчета 1,5 мл/кг) и получением изображений в нативную, артериальную, венозную и отсроченную фазы. Визуализирована компрессия левой почечной вены на уровне аортомезентериального сегмента с локальным уменьшением ее диаметра до 3 мм и расширением в области ворот почки более чем в 3,5 раза (до 11 мм), а также дилатацией левой гонадной вены (рис. 1).
Клинический случай 2
У пациента К. 20 лет за полгода до настоящего обследования после переохлаждения и на фоне острого респираторного заболевания появилась дизурия. Обнаружены изменения в моче в виде эритроцитурии до 60 в п/зр. и протеинурии 0,2 г/л. Проводилась антибактериальная терапия, однако мочевые изменения сохранялись и в октябре 2018 г. с предполагаемым диагнозом «хронический гломерулонефрит» госпитализирован для дальнейшего обследования. Семейный анамнез не выявил случаев заболевания почек.
При поступлении в нефрологический стационар жалоб не предъявляет. Состояние удовлетворительное. Температура – 36,6°С. Рост – 179 см, вес – 64 кг, ИМТ – 20,0 кг/м2. АД – 120/70 мм рт.ст. Почки не пальпируются. Вторичные половые признаки развиты соответственно возрасту. Отеков нет.
Обследование подтвердило наличие мочевого синдрома. В общем анализе мочи относительная плотность – 1,026, белок – 0,4 г/л, эритроциты – 3–4 в п/зр. Суточная протеинурия – 0,5 г. По пробе Нечипоренко лейкоцитов 0,75×103/мл, эритроцитов 1,5×103/мл. Бактериологический посев мочи на микрофлору, полимеразная цепная реакция мочи на микобактерии туберкулеза отрицательная.
Общий анализ крови: эритроциты – 4,5×1012/л, гемоглобин – 150 г/л, лейкоциты – 4,5×109/л, тромбоциты – 212×109/л, СОЭ – 5 мм/ч. Белок крови – 73 г/л, альбумины – 41,4 г/л, креатинин – 83,9 мкмоль/л, клубочковая фильтрация по пробе Реберга – 121,4 мл/мин/1,73 м2. Фибриноген – 313 мг/дл, МНО – 1,08.
По УЗИ размеры правой почки –119×47 мм, левой – 113×48 мм, толщина паренхимы обеих почек – 15 мм, положение, контуры, соотношение слоев правильные, эхогенность паренхимы не изменена, чашечно-лоханочная система не расширена.
Проведено патогистологическое изучение биоптата левой почки, которое при светооптическом и иммунофлуоресцентном исследовании по стандартному протоколу не выявило данных за хронический гломерулонефрит (иммунокомплексный, в т.ч. IgA-нефропатию) или фокальный сегментарный гломерулосклероз.
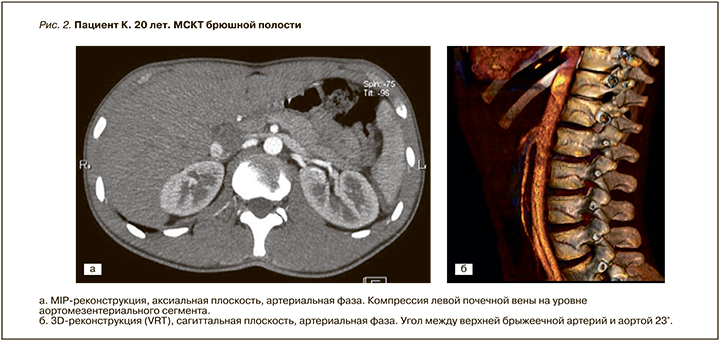
С учетом молодого возраста, данных анамнеза о перенесенной операции по поводу левостороннего варикоцеле исключалась венозная патология почек. Пациенту выполнена МСКТ органов брюшной полости на 64-срезовом томографе «Brilliance» производства фирмы «Phillips» с конфигурацией детекторов 64×0,625 мм и с использованием стандартного внутривенного контрастирования (Ультравист 370 мг йода/мл из расчета 1,5 мл/кг) с получением изображений в нативную, артериальную, венозную, отсроченную фазы. На мультиспиральных компьютерных томограммах визуализируется уменьшение угла между верхней брыжеечной артерией и аортой до 23° с аортомезентериальной компрессией левой почечной вены. Диаметр вены увеличен до 10 мм с формированием варикозной трансформации левой гонадной вены (рис. 2).
Обсуждение
В имеющихся публикациях подчеркивается преобладание женщин среди пациентов с NCS. Так, Rudloff et al. подсчитали, что из 80 (78%) описанных пациентов с NCS 62 – женщины [8]. Наши наблюдения касаются лиц мужского пола, причем возраст пациентов не превышает 20 лет.
В обоих случаях диагностировалось левостороннее варикоцеле, однако до оперативного лечения признаков NCS не наблюдалось. Связь между варикоцеле и NCS хорошо известна. В работе О.Б. Жукова и соавт. из 96 пациентов с левосторонним варикоцеле, которым выполнена флебография и флеботонометрия, у 37 (38,5%) выявлена почечная венозная гипертензия. При этом у 35 из них она была обусловлена аортомезентериальным пинцетом, в 2 случаях – аномалией развития кольцевидной почечной вены [9].
Основным проявлением NCS у наблюдавшихся больных были изменения мочи в виде протеинурии различной степени выраженности и микрогематурии. Колебания в величине потерь белка и эритроцитов с мочой объясняются, очевидно, большей физической активностью пациентов в амбулаторных условиях по сравнению со стационарным режимом [10]. Предполагается, что почечная венозная гипертензия вызывает образование трещин в тонких венах, через которые кровь попадает в системы сбора, тем самым генерируя гематурию и протеинурию [5].
Другим физиологическим фактором, связанным с NCS, является недостаток забрюшинного жира, который может уменьшить аортомезентериальный угол, вызывая компрессию левой почечной вены. Сообщается, что низкий ИМТ коррелировал с более высокой заболеваемостью NCS,и есть свидетельства того, что NCS может развиваться после потери массы тела. По данным Hangge P.T. et al., средний ИМТ пациентов с NСS составил 21,4 кг/м2 против достоверно более высокого показателя для группы с бессимптомным феноменом компрессии левой почечной вены (27,2 кг/м2), а низкий ИМТ привел к более частому развитию боли в животе [11]. В одном из двух приведенных случаев ИМТ пациента также был невысоким (20 кг/м2), что, впрочем, не сопровождалось абдоминальной болью.
Наличие мочевых изменений, в т.ч. гематурии, недостаточно используется как повод для диагностики NCS. J.I.Shin. et al. обследовали когорту из 216 детей с изолированной гематурией и, по данным УЗИ с допплерографией, у 33,3% обнаружили NСS [12]. Поскольку в 43–68% случаев причина изолированной гематурии остается неуточненной, NСS следует чаще рассматривать как возможный источник мочевого синдрома [11].
Ранняя диагностика NCS важна, чтобы избежать ненужных диагностических процедур и осложнений, таких как тромбоз левой почечной вены и повреждение левой почки [13]. Клинические проявления и степень компрессии левой почечной вены в аортомезентериальном пинцете, по данным визуализации, служат основными диагностическими параметрами NCS [14, 15].
В то же время известны случаи, когда NCS сочетался с гломерулярной патологией. Описана атипичная ассоциация синдрома щелкунчика с IgM-нефропатией и с синдромом Альпорта [16]. Как следует из приведенных клинических наблюдений, наследственный характер гломерулонефрита исключался по данным семейного анамнеза, а возможность приобретенного гломерулонефрита отвергнута результатами нефробиопсии.
Лечение NCS обычно имеет хирургический характер и предпринимается в отношении пациентов с изнурительными симптомами или рефрактерной анемией на фоне повторных макрогематурий.
Заключение
До последнего времени синдром щелкунчика (Nutcracker syndrome) – аортомезентериальная (мезаортальная) компрессия левой почечной вены (сдавление левой почечной вены верхней брыжеечной артерией с развитием левосторонней почечной флебогипертензии), в основном был в поле зрения специалистов-урологов. Полученный опыт свидетельствует о необходимости включения этого синдрома в план дифференциального диагноза для пациентов молодого возраста с необъяснимыми мочевыми изменениями. Для данной категории больных обязательным этапом обследования должна быть МСКТ с внутривенным введение йодсодержащего контрастного препарата по стандартной методике болюсного контрастирования.



