Хорошо известно, что белки необходимы для питания человека и животных. Биологическая ценность белка определяется его аминокислотным составом. Одни аминокислоты (незаменимые) не синтезируются в организме при их отсутствии в пище, тогда как другие (заменимые) в аналогичном случае могут синтезироваться в организме. Восемь аминокислот (лизин, треонин, триптофан, метионин, фенилаланин, лейцин, валин и изолейцин) необходимы для всех исследованных видов животных. В то же время гистидин парадоксальным образом является незаменимой аминокислотой для большинства млекопитающих, но заменимой для здорового взрослого человека. Однако при уремии гистидин становится незаменимой аминокислотой для человека. Более того, его введение в организм больных уремией облегчает состояние. Почему так происходит, до конца не выяснено, однако факты говорят сами за себя. Поэтому необходимо сначала рассмотреть обмен гистидина в норме, а потом перейти к патологии.
Гистидин у здоровых взрослых людей
В 1937 г. путем последовательного исключения аминокислот из рациона поодиночке W.C. Роуз et al. [1] установили, что для белых крыс незаменимы девять аминокислот, включая гистидин. Вскоре незаменимость гистидина была установлена для других животных. В то же время W.C. Роуз et al. выяснили, что гистидин вовсе не необходим для обеспечения человеку азотистого равновесия [2].
Срезы человеческой печени были инкубированы с формиатом 14С, и найдено меченое соединение, которое на бумажной хроматографии идентифицировано как гистидин [3].
Более чем у 50 индивидуумов поддерживалось азотистое равновесие или положительный азотистый баланс на диетах, лишенных гистидина [4]. Таким образом, способность взрослого человека успешно обходиться без включения в пищу гистидина является общим явлением и не ограничивается случайным индивидом. Накопленные в лаборатории данные не дали основания решать, синтезируется ли гистидин клетками человека или микроорганизмами, обитающими в пищеварительном тракте. В пользу первой альтернативы важны наблюдения, проведенные в 1952 г. [3].
W.C. Роуз заявляет, что совершенно неожиданно наблюдение относительно гистидина у человека: гистидин требуется всем предварительно протестированным видам млекопитающих, в то время как исключение его для человека не влияет на азотистый баланс, а также на физическое самочувствие [5]. Проведенные опыты не дают приемлемых оснований сомневаться, что гистидин не является необходимым для поддержания азотистого равновесия у взрослого человека. W.C. Роуз также пишет, что результаты дальнейших исследований должны показать, требуется ли гистидин растущему ребенку, поскольку нельзя исключать возможность того, что аминокислоты, которые не являются необходимыми для поддержания азотистого равновесия у нормальных субъектов в обычных условиях, могут становиться незаменимыми при болезнях, а также при таких физиологических состояниях, как репродукция или лактация. Кроме того, W.C. Роуз говорит, что нельзя ни утверждать, ни отрицать участия кишечных микроорганизмов в синтезе гистидина, но в то же время стоит принять во внимание образование гистидина в срезах печени человека [3]. W.C. Роуз заключает, что, к сожалению, это количество гистидина слишком мало, чтобы его полностью охарактеризовать.
Хотя многие экспериментальные животные для роста и обеспечения азотистого равновесия нуждаются в введении гистидина с пищей, имеются данные, согласно которым у молодых здоровых людей азотистое равновесие может сохраняться и при диете, не содержащей гистидина [6]. Эти данные указывают на возможность синтеза гистидина в тканях человека, но их можно толковать и иначе, например предположить, что гистидин синтезируется при участии микрофлоры кишечника или образуется при распаде гемоглобина [6].Однако доказана именно возможность синтеза гистидина в человеческом организме [3], и не случайно также говорится, что для человека гистидин является заменимой аминокислотой и не слишком продолжительное его отсутствие в пище не вызывает никаких расстройств в организме, кроме того, приводится схема биосинтеза гистидина в человеческом организме [7]. Утверждается, что гистидин синтезируется из гистидинола [7], что подтверждено в недавнее время [8, 9]. При этом приводится предполагаемая схема биосинтеза гистидина у человека из пуринового основания аденина, а пуриновые основания, как известно, синтезируются в животном организме. Здесь не имеет смысла приводить эту схему, ибо она наличествует у микроорганизмов, но не подтверждена у человека.
Сообщается, что для младенцев гистидин является незаменимой аминокислотой [10]. В книге «Белковый метаболизм у млекопитающих» в главе «Метаболическая судьба аминокислот» [11] отмечается, что взрослые люди в отличие от растущих крыс не требуют поставок гистидина для поддержания азотистого равновесия [4]. Поскольку потеря гистидина (плюс метилгистидин) с мочой составляет 200–300 мг/сут., поддержку азотистого равновесия нельзя объяснить сохранением уровня гистидина. Это наводит на мысль, согласно которой взрослый человек может синтезировать достаточное количество гистидина.
Рассмотрены потребности в белках и незаменимых аминокислотах людей разных возрастных групп: от младенцев до пожилых [12]. В работе дается ссылка на исследование H.A. Krebs [11] и делается следующий вывод: возможно, гистидин заменим для взрослых людей и детей школьного возраста, но незаменим для младенцев. Отмечается, что гистидин является незаменимой аминокислотой для ребенка, в то время как у взрослого человека азотистое равновесие может поддерживаться безгистидиновой диетой [6]. Эти данные показывают, что потребности взрослого человека в гистидине могут отличаться от таковой в нем у крысы и собаки. Однако такие факторы, как синтез гистидина кишечными бактериями и продолжительность экспериментального периода, могут быть важными соображениями. Конечные выводы не могут быть выведены до тех пор, пока не сделаны заключения, определяющие, синтезируется ли гистидин у взрослого человека [6]. В работе приведена схема метаболизма гистидина, причем только одна реакция – синтез гистидина – под вопросом, ибо в статье идет разговор о превращениях гистидина у животных и человека. В схеме не показаны продукты, из которых гистидин может образовываться. Однако говорится, что наблюдаемая у людей гистидинемия может быть результатом избыточной продукции гистидина.
Настоящим прорывом стала работа, показавшая синтез гистидина в организме взрослого человека [13].У взрослых людей после 22 дней безгистидинового питания NH4Cl был принят через рот, 15N появлялся в общем белке плазмы крови, глобине гемоглобина и мочевине. Причем 15N присутствовал как в аминогруппе гистидина, так и в его имидазольном кольце. Из этого было заключено, что гистидин синтезируется у нормального взрослого человека: это продемонстрировано включением 15N в имидазольное кольцо гистидина. Хотя кишечная микрофлора может вносить свой вклад в биосинтез гистидина, из данного опыта не могут быть определены ни местоположение, ни степень биосинтеза. В том же году провели исследование 48-летнего здорового мужчины из экспериментальной команды [14]. В течение всего периода продолжительностью 72 дня мужчина получал внутривенное питание 48 дней после двух периодов питания через рот. Удаление гистидина из внутривенного раствора принесло близкий к нулю азотистый баланс без заметных изменений в сыворотке уровней мочевины, мочевой кислоты, креатинина и белков короткой продолжительности жизни.
Было отмечено, что гистидин – единственный среди незаменимых аминокислот, при исключительно низком содержании которого в диете в течение короткого времени поддерживалось азотистое равновесие [15]. Показано, что существует несколько гипотез для объяснения этого феномена: 1) гистидин составляет 8% молекулы гемоглобина, и распад гемоглобина обеспечивает наибольшее количество гистидина в пропорции к другим незаменимым аминокислотам; 2) гидролиз дипептида карнозина мышц освобождает гистидин; 3) биосинтез гистидина [13]. Комбинация этих гипотез может объяснить уникальную потребность тканей в гистидине при безгистидиновой диете. Никаких сообщений о потребности женщин в гистидине не найдено. Однако отмечено, что, возможно, у женщин при безгистидиновой диете отрицательный азотистый баланс может развиваться быстрее, чем у мужчин, из-за меньшей мышечной массы и поэтому, возможно, более ограниченных запасов карнозина [15].
В издании книги о современном питании за 2014 г. [16] также подтверждается высказанная возможность синтеза гистидина в организме человека [11]. В этой книге специальный раздел посвящен гистидину, где замечено: хотя незаменимость гистидина показана для крыс, трудно его определить как незаменимую аминокислоту в питании взрослых людей.
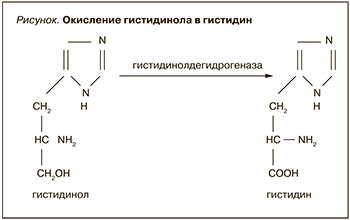 Чем же тогда можно объяснить данный парадокс? Впервые в 2001 г. сообщили об активности в печени и почках крупного рогатого скота фермента гистидинолдегидрогеназы, окисляющей гистидинол в гистидин (см. рисунок) [8].
Чем же тогда можно объяснить данный парадокс? Впервые в 2001 г. сообщили об активности в печени и почках крупного рогатого скота фермента гистидинолдегидрогеназы, окисляющей гистидинол в гистидин (см. рисунок) [8].
Причем количество гистидина, образующегося в этой реакции, полностью удовлетворяет потребность в нем крупного рогатого скота. Отсюда был сделан вывод: для крупного рогатого скота гистидин может быть заменимой аминокислотой, если из предшественников образуется достаточно гистидинола. Активность гистидинолдегидрогеназы из печени и почек крупного рогатого скота сравнивали с таковыми у свиньи, не являющейся жвачным животным [8]. Было установлено, что количество синтезируемого гистидина не может удовлетворять потребность в нем свиньи, таким образом, гистидин может быть заменимой аминокислотой для крупного рогатого скота, но незаменимой для свиней [8].
Показана активность гистидинолдегидрогеназы в печени, почках и мышцах крупного рогатого скота, а также свиньи, мыши, домашней птицы и дикой утки, и обсуждалась незаменимость гистидина у этих животных [9]. В этой работе указано, что гистидин может не быть незаменимой аминокислотой как для растущего, так и для взрослого крупного рогатого скота, если образование гистидинола из его предшественников достаточно в органах, содержащих гистидинолдегидрогеназу: печени, почках и мышцах. В то же время отмечено, что образование гистидина у телят возрастает с массой тела и если у растущих телят потребность в гистидине возрастает вплоть до 300 кг массы тела, то при 450 кг образование гистидина в организме превышает потребность в нем [9]. Начальным продуктом синтеза гистидина в этих органах считают фосфорибозилпирофосфат, но при этом заявляют, что именно активность гистидинолдегидрогеназы определяет возможность синтеза гистидина de novo, т.к. этот фермент катализирует конечный шаг в серии реакций в пути биосинтеза гистидина. У всех исследованных видов животных и человека обнаружена гистидинолдегидрогеназа, но с разной активностью. Сделан вывод, согласно которому эта активность и является тем самым показателем, по которому можно судить о незаменимости гистидина для того или иного вида животного, поскольку в одном случае эндогенный биосинтез гистидина может удовлетворять потребность организма в этой аминокислоте, как у здорового взрослого человека и крупного рогатого скота, а в другом не может, как у большинства животных, а также младенцев и людей, страдающих почечной недостаточностью и другими заболеваниями.
Гистидин у больных уремией
В исследовании больных уремией и одного здорового добровольца выявлено, что больные уремией делят неспособность синтезировать гистидин со всеми животными, изученными в этом отношении, а также с новорожденными детьми [17]. Следовательно, для больных уремией гистидин может считаться незаменимой аминокислотой. В работе отмечается снижение концентрации гистидина в плазме крови при уремии, поэтому достижение азотистого равновесия больными уремией возможно только путем добавления гистидина к 8 незаменимым аминокислотам. Более того, введение гистидина в организм при уремии повышает синтез белка в большей степени, чем введение азота в виде мочевины или какой-либо другой заменимой аминокислоты, не говоря уже о том, что введение последних не восстанавливает азотистое равновесие.
Также говорится о том, что, будучи заменимой аминокислотой для здорового взрослого человека, гистидин при уремии ведет себя как незаменимая аминокислота [18]. Кроме того, в работе сообщается, что у больных ревматоидным артритом отсутствие гистидина приводит к агрегации γ-глобулина и воспалению (о последнем будет говориться в дальнейшем). Это наблюдение наводит авторов на мысль, согласно которой потребность в аминокислотах, как и в других питательных веществах, может заметно изменяться при болезненных состояниях. В отношении гистидина определенные болезненные состояния могут быть охарактеризованы неспособностью синтезировать гистидин (возможно, при уремии) или как увеличение распада гистидина. Если гистидин не может синтезироваться, а экзогенного снабжения недостаточно для синтеза белка, может ухудшаться регуляция ферментов и целостность мембран. При гистидиновой недостаточности целостность митохондриальных мембран может быть нарушена, что приводит к снижению продукции АТФ. Активность пируваткиназы и глутаматдегидрогеназы, частично зависящая от гистидина, может снижаться, что приводит к уменьшению гликолиза.
Было отмечено, что гистидин, образуя хелатные комплексы с медью, в физиологических концентрациях сильно ингибирует перекисное окисление липидов, а также окисление белковой части липопротеидов низкой плотности, которое может привести к отложению липидов в стенке артерий [19]. Гистидин является эффективным «мусорщиком» гидроксильных радикалов и синглетного кислорода [20]. В этой работе рассматривается защитное действие гистидина и других свободных аминокислот на ткань миокарда. Работа A.M. Wade et al. целиком посвящена антиоксидантным свойствам гистидина [21]. В ней эти свойства объясняются препятствием гистидина окислительно-восстановительным реакциям ионов железа с синглетным кислородом и непосредственным взаимодействием гистидина с последним, а также говорится о противовоспалительном действии гистидина. Причем это действие гистидина объясняют его способностью убирать синглетный кислород и гидроксильные радикалы. Противовоспалительное действие гистидина рассматривается на примере желудочно-кишечного тракта, центральной нервной, сердечно-сосудистой и респираторной систем.
M. Watanabe et al. [22] проанализировали результаты исследований [17–21]. Они определили гистидин как заменимую аминокислоту у здоровых взрослых людей, а для больных уремией – как условно незаменимую аминокислоту. В работе исследуется связь гистидина плазмы крови как противовоспалительного и антиоксидантного фактора с маркерами воспаления и оксидативного стресса и фактором роста гепатоцитов у больных уремией. Авторы пишут, что причины низких внеклеточной и внутриклеточной концентраций гистидина при уремии неясны, однако предполагают, что это связано с воспалением и оксидативным стрессом, имеющим место при уремии [23]. Введение в организм больных уремией гистидина не только восстанавливает азотистое равновесие, но и оказывает противовоспалительное и антиоксидантное действия [22].
Заключение
Итак, для здоровых взрослых людей гистидин – это заменимая кислота, но становится условно незаменимой при различных болезненных состояниях, в частности при уремии. Считаю, что при уремии человеческий организм не теряет способности синтезировать гистидин, ибо в литературе ничего не говорится об исчезновении или снижении активности гистидинолдегидрогеназы. Содержание гистидина в организме при уремии резко снижается, что может объясняться имеющимися при ней оксидативным стрессом и воспалением, на борьбу с которыми затрачивается значительная часть гистидина, вступающего во взаимодействие с ионами тяжелых металлов и теряющегося для организма. Поэтому при уремии необходимо вводить в организм гистидин, причем не его α-кетоаналог, поскольку установлено, что переаминирование последнего не компенсирует потребности в гистидине больных уремией.
В то же время есть немало публикаций, где гистидин однозначно назван незаменимой аминокислотой без видовой дифференцировки, в т.ч. для здорового взрослого человека. Считаю эти публикации вредными, так как они затушевывают появление незаменимости гистидина у больных уремией, что затрудняет лечебное применение гистидина этими больными. В конце концов, никто не ставит под сомнение заменимость тирозина, который является нормальным продуктом превращения незаменимой аминокислоты фенилаланина (если этого не происходит, то с рождения развивается фенилпировиноградная олигофрения). Однако у больных уремией тирозин также становится условно незаменимой аминокислотой, т.к., по-видимому, будучи, как и гистидин, циклической аминокислотой, расходуется на те же процессы.



