Образование конкрементов после трансплантации почки редкое, но достаточно опасное осложнение. При обструкции мочевых путей камнем в трансплантате могут возникать осложнения, приводящие к обострению пиелонефрита, гидронефрозу, анурии, снижению функции трансплантата, и если не принимать экстренных мер – к гибели последнего [1].
В 1975 г. Rattiazzi et al. впервые описали образование конкрементов в почечном трансплантате [2]. По данным различных авторов, процесс камнеобразования в пересаженной почке выявляется от 0,2 до 5,7% [3–6]. Shoskes et al. сообщили о двух случаях на 1000 почечных трансплантатов (0,2%) [7]. Lancina et al. доложили о 16 случаях нефролитиаза в 794 функционирующих почечных трансплантатах (2%) [8]. Д.В. Перлин проанализировал двадцатипятилетний период наблюдений после выполнения 1024 операций: конкременты трансплантата были у 14 (1,4%) больных. Ни у одного из этих реципиентов не были обнаружены камни в собственных почках. У двух пациентов конкременты образовались на фоне обструкции мочеточника, у одного – в результате длительного внутреннего дренирования трансплантата на фоне некроза мочеточника. У двух больных обнаружены лигатурные камни в области мочеточниково-пузырного анастомоза через 5 и 7 лет после трансплантации. До пересадки почки ни один из больных не страдал мочекаменной болезнью. Авторы указывают, что факторы камнеобразования у больных после трансплантации почки во многом отличаются от причин, объясняющих возникновение мочекаменной болезни у обычных пациентов [9].
В качестве основных причин образования камней в пересаженной почке выделяют вторичный гиперпаратиреоз, третичный гиперпаратиреоз, хроническую почечную недостаточность и связанные с ней обменные нарушения (оксалоз, канальцевый ацидоз, гиперкальциурия и др.), хроническую инфекцию мочевых путей, особенно сопровождающуюся пузырно-мочеточниковым рефлюксом, папиллярный некроз, использование нерассасывающегося шовного материала [10]. Вместе с тем признаки гиперфункции желез имеются у 10–30% всех реципиентов, а нефролитиаз встречается гораздо реже [11]. Гиперкальциемия может быть обусловлена повышенной продукцией трансплантатом 1,25-дигидроксихолекальциферола, увеличивающей абсорбцию кальция. К тому же постоянная стероидная терапия способствует росту клиренса фосфатов, а применение многих антацидных препаратов еще более усугубляет гипофосфатемию [12].
Обструктивные осложнения могут играть существенную роль в камнеобразовании, во-первых, в результате нарушения оттока мочи, во-вторых, в связи с развитием мочевой инфекции. Т. Caldwell и J. Burns отметили взаимосвязь возникновения нефролитиаза после трансплантации с наличием у больного в раннем послеоперационном периоде нефростомы либо катетер-стента. В подтверждение авторы приводят описание двух случаев камнеобразования на фоне длительного дренирования мочеточниковым стентом [13]. J. Haves et al. отметили, что у 9 из 10 наблюдавшихся ими больных с конкрементами применялись нефростома или внутренний стент [14]. По мнению G. Brien et al., большое значение в развитии нефролитиаза принадлежит постоянной бактериурии [15]. В то же время F. Moulinier et al. на основании проведенного спектрофотометрического анализа кристаллов солей с поверхности стентов пришли к выводу, согласно которому у реципиентов после пересадки почки риск инкрустации дренажей значительно ниже, чем у других урологических больных [16].
В исследовании M.S. Rezaee-Zavareh et al. проанализированы 549 реципиентов почек в среднем в течение 55 месяцев. Выявлен 31 (5,3%) больной нефролитиазом в трансплантате. Среди вероятных причин были: инфекция мочевых путей, геперпаратиреоз, гиперкальцийурия, наличие стента в мочевых путях, стеноз уретероцистоанастомоза. Авторы также показали, что возраст, пол, курение и наркомания у доноров и реципиентов не имели статистически значимую связь на образование камней после трансплантации почки [17].
Анализ отечественной и зарубежной литературы показал, что конкременты наиболее часто образуются в трансплантате. Klein et al. описывают 7 случаев образования камней в мочевом пузыре на лигатуре из нерассасывающегося материала на месте шва уретероцистоанастомоза [18]. В исследовании Hyang Kim. из Кореи отмечено, что у 11 из 15 больных камни были найдены в мочевом пузыре (73,3%), а также три пациента имели лигатурные камни на месте выполнения уретероцистонеоанастомоза [19]. Лопаткин и соавт. описали двух (0,19%) больных с образованием лигатурных конкрементов в мочевом пузыре реципиента [20]. Среди обменных нарушений, способствующих камнеобразованию после трансплантации, стоит выделить прежде всего канальцевый ацидоз. Это нарушение может развиваться как в раннем (проксимальный почечноканальцевый ацидоз), так и в позднем (дистальный почечноканальцевый ацидоз) послеоперационных периодах [20, 21]. М. Bewick et al. привели два случая образования конкрементов у реципиентов с первичным оксалозом [22]. Кроме того, конкремент может быть привнесен реципиенту с донорской почкой [23].
В отечественной литературе мы не нашли описания лечения больного с конкрементом в трансплантате, полученным с донорской почкой. Приводим собственное наблюдение.
П а ц и е н т к а Т. 1975 г.р. поступила в отделение 20.06.2016 0(I) с дигнозом: гипоплазия почек, множественные кисты почек, хронический тубулоинтерстициальный нефрит с исходом в нефросклероз, ХБП-V, вторичная артериальная гипертензия 2-й стадии, риск 3. Хроническая цитомегаловирусная инфекция, стадия ремиссии. Состояние после аллотрансплантации трупной почки от 14.04.2016, камень лоханки трансплантата, пиелонефрит трансплантата.
Из анамнеза известно, что больной 14.04.2016 выполнена аллотрансплантация трупной почки слева. Донор: мужчина 45 лет, погиб в результате черепно-мозговой травмы. Совпадение по групповой принадлежности полное, по системе HLA (лейкоциторной ангтигенной совместимости) по локусу А2, В35, DR4. Функция трансплантата немедленная. Установлен мочеточниковый стент № 8. На третий послеоперационный день креатинин сыворотки крови 0,09 ммоль/л, мочевина сыворотки крови 11 ммоль/л. Гипергликемии нет. Мочи за сутки до 3,5 л. Получает трехкомпонентную иммуносупрессивную терапию: преднизолон, мофетила микофенолат, Такролимус по схеме.
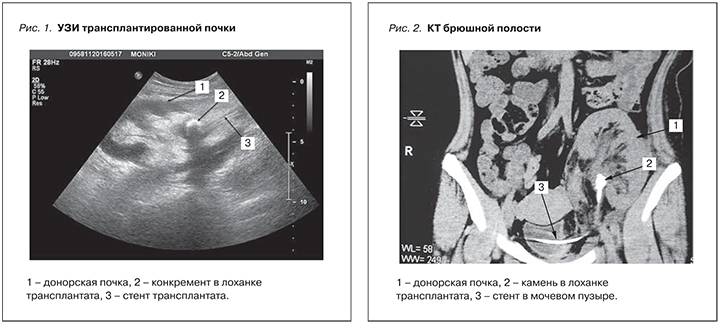
При динамическом наблюдении на третий день после операции при УЗИ трансплантированной почки выявлен камень лоханки трансплантата размером 14×15 мм. Размер трансплантата – 11,0×6,5×5,5 см. Чашечно-лоханочная система не расширена и не деформирована. В проекции лоханки визуализируется стент. Мочеточник – 1,0 см (рис. 1).
При компьютерной томографии (КТ) выявляется камень в лоханке трансплантированной почки. Стент проходит по мочеточнику трансплантата и определяется в мочевом пузыре (рис. 2).
С учетом раннего выявления конкремента в лоханке трансплантированной почки предположено, что трансплантат был уже с конкрементом пересаженной почки.
При исследовании мочи на флору и чувствительность выявлены Klebsiela pneumonia 5×105 КОЕ, чувствительный к цефтазидиму, имипинему, доксициклину, офлоксацину, ципрофлоксацину, и Candida crusei 104 KOE.
Больной назначены имипинем, антифунгальная терапия (анидулафунгин).
Общий анализ крови: гемоглобин 142,8 г/л, гематокрит 0,42%, эритроциты 5,18×1012/л, тромбоциты 222×109/л, лейкоциты 6,01×109/л, лимфоциты 1,3×109/л.
Биохимия крови: общий белок 74 г/л, альбумин 44 г/л, билирубин общий 6,4 мкмоль/л, креатинин 96 ммоль/л, мочевина 5,2 ммоль/л, щелочная фосфатаза 93 ЕД/л, мочевая кислота 293 мкмоль/л.
Анализ мочи: относительная плотность 1,024, реакция 5,00, белок 01 г/л, лейкоциты 3–4–5 в поле зрения, эритроциты не обнаружены, бактерий нет, дрожжеподобные грибы – большое количество, соли: оксалаты кальция – немного.
Коагулограмма: протромбиновое время 11,6 с, МНО 1,0, фибриноген 2,89 г/л, протромбиновое антивность по Квику 99%.
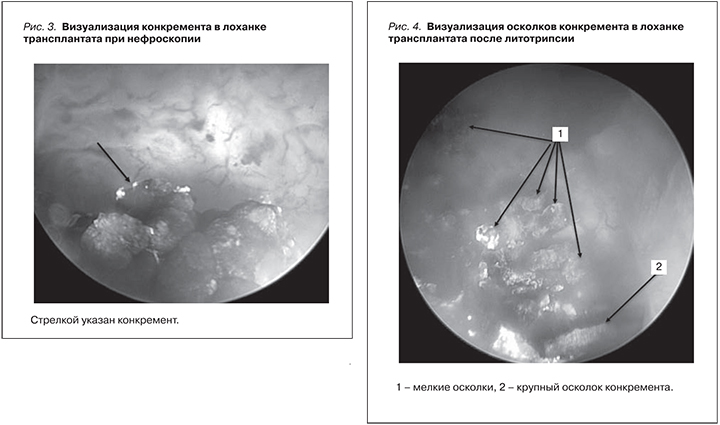
21.06.2016 выполнена чрескожная рентгенэндоскопическая нефролитотрипсия почечного трансплантата. Описание операции: в положении на спине под УЗИ и рентгенконтролем произведена пункция нижней чашечки аллотрансплантированной почки в евой подвздошной области. В лоханку почки установлена струна-проводник. По струне сформирован чрескожный рабочий ход телескопическими бужами Alkien. Установлен тубус нефроскопа № 26 Ch. При нефроскопии в лоханке трансплантированной почки определяется камень диаметром до 15 мм (рис. 3).
Произведено контактное дробление конкремента аппаратом «Литокласт-Мастер» в УЗИ-варианте: мощность 70%, частота 70 Гц, время 65 с с одновременной аспирацией осколков. Осколки удалены по тубусу нефроскопа (рис. 4).
При рентгенологическом и визуальном контроле осколков конкремента не выявлено, кровотечение незначительное, затеков контрастного вещества нет. По тубусу нефроскопа в лоханку трансплантированной почки установлена дренажная трубка 14 Ch типа «Малеко».
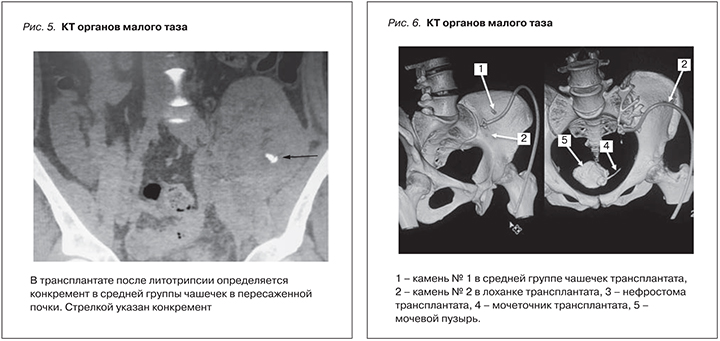
22.06.2016 выполнена компьютерная томография органов малого таза. Донорская почка визуализируется в левой подвздошной области с визуализацией нефростомической трубки. В чашечках верхней группы почки определяется микролит. В одной из чашечек средней группы определяется конкремент размером 7,6×6 мм. Еще один конкремент размером 4,1×3 мм визуализируется в просвете верхних отделов мочеточника (рис. 5).
После введения контрастного вещества через нефростому отмечается контрастирование чашечек и лоханки донорской почки, а также поступление контрастного препарата в просвет мочеточника, который прослеживается на всем протяжении (до мочевого пузыря) равномерным диаметром до 10 мм, не расширен. Визуализируется два конкремента в лоханке пересаженной почки (рис. 6).
24.06.2016 удалена нефростома. Мочеиспускание самостоятельное, адекватное. Мочи за сутки до 1500 мл.
Больной предложена повторная чрескожная нефролитотрипсия почечного трансплантата, от которой больная воздержалась. Больная выписана домой. Назначены нефролитолитические препараты.
Биохимия крови: креатинин 0,1 мкммоль/л, мочевина 5,9 ммоль/л. Клубочковая фильтрация 64,4 мл/мин. Реабсорбция 97,06 мл/мин. Креатинин мочи 5,4 ммоль/л.
Клинический анализ крови: гемоглобин 125 г/л, гематокрит 036%, лейкоциты 9,5×109, тромбоциты 162×109. Посев мочи на флору: роста нет.
Через два месяца после литотрипсии больная отметила в течение недели периодические задержки мочеиспускания, умеренное «жжение» при выделении мочи. Больной произведена коррекция нефролитической терапии. После чего патологические симптомы прекратились. Выполнено контрольное ультразвуковое исследование трансплантата: размеры 11,5×6,3×4,3 см, чашечно-лоханочная система не расширена и не деформирована. Отмечается конкремент в средней чашечке размером 7,6×4,1 мм.
Патологических образований вокруг трансплантированной почки нет. Мочеточник не визуализируется. От повторной литотрипсии больная отказалась.
Креатинин крови 0,09 мкммоль/л, мочевина крови 11 ммоль/л. Мочи за сутки до 1300,0 мл. При исследовании мочи на флору и чувствительность роста нет.
Раннее обнаружение конкремента в трансплантате через трое суток после операции у вышеописанной больной указывает на наличие камня в почке у донора. При эксплантации почек камень не был диагностирован и орган вместе с конкрементом был пересажен пациенту. Конкремент не вызывал нарушения оттока мочи по мочевым путям трансплантата. Тем не менее для профилактики возможных осложнений в виде постоянной бактериурии и нарушения пассажа мочи решено выполнить нефролитотрипсию.
Обнаружение камней в пересаженной почке является обязательным показанием к их удалению, т.к. наличие камня в пересаженной почке постоянно поддерживает мочевую инфекцию, может вызывать обструкцию мочевых путей и приводить к снижению функции трансплантата, а в ряде случаев – и к его гибели. Первоначально позиция в отношении камней, обнаруженных в мочевых путях пересаженной почки, в случае их бессимптомного существования была преимущественно выжидательной и ограничивалась ультразвуковым контролем.
В настоящее время по мере накопления опыта лечения подобных больных подход к проблеме камнеобразования в пересаженной почке изменился в сторону более ранней ликвидации этого осложнения [24].
Выбор адекватного метода лечения уролитиаза у пациентов с пересаженной почкой осложнен прежде всего полиэтиологичностью заболевания, локализацией трансплантата, сопутствующими изменениями в ткани трансплантата, паранефральной клетчатке, проводимой иммуносупрессивной терапией, состоянием мочеточника, локализацией устья в нетипичном месте. Лечебное воздействие должно предполагать минимальное количество побочных эффектов, осложнений, а результат – стремиться к состоянию stone free (свобода от конкрементов), т.к. наличие резидуальных фрагментов влечет за собой риск обструктивных осложнений, последствия от которых могут быть более значимыми, чем у пациентов с собственными почками [25]. До недавнего времени при обнаружении в пересаженной почке камня, нарушающего отток мочи, обычно применялись открытые оперативные вмешательства: нефростомия, пиелолитотомия [26]. Эти операции, как правило, связаны с большим риском для трансплантата и самого больного, поскольку их выполнение затруднено из-за выраженного рубцового-спаечного процесса вокруг пересаженной почки, вероятности возникновения кровотечения, пиелонефрита, уросепсиса, гибели трансплантата [27].
Первоначально лечебная тактика в отношении камней, обнаруженных в мочевых путях пересаженной почки, была в случае их бессимптомного течения только выжидательной и ограничивалась более частым УЗИ-контролем. Однако по мере накопления опыта и появления в клинической практике новых методов лечения подход к проблеме камней у больных после пересадки почки изменился в сторону более ранней ликвидации этого осложнения. Современная позиция относительно этой проблемы заключается в следующем: поскольку наличие камня может вызывать обструкцию мочевых путей и приводить к снижению функции трансплантата, а в ряде случаев – и к его гибели, считается необходимым удаление камней из пересаженной почки даже при их бессимптомном течении. Кроме того, присутствие камней поддерживает мочевую инфекцию, что также оказывает влияние на функцию трансплантата.
В настоящее время обнаружение камней в пересаженной почке служит обязательным показанием к их удалению из-за риска ухудшения функции трансплантата и развития хронической мочевой инфекции. Если ранее риск открытого оперативного вмешательства здесь значительно превышал таковой осложнений, связанных с нефролитиазом, то современные методы лечения позволяют удалять либо растворять камни наиболее эффективными и малотравматичными способами [20].
Впервые пиелолитотомия на пересаженной почке была выполнена в 1977 г., до последнего времени большинство камней трансплантата удалялось традиционными хирургическими способами. В 1982 г. появилось сообщение о чрескожном удалении камня из пересаженной почки [28]. По мнению авторов, предпочтительно избегать открытого оперативного вмешательства из-за риска инфицирования и снижения репаративной способности тканей у больных иммуносупрессией [24]. Возможности современной медицинской аппаратуры позволяют ликвидировать многие урологические осложнения, возникшие после пересадки почки, малоинвазивным методом, без травматичных открытых операций, что позволило практически полностью отказаться от открытых операций. В настоящее время в хирургическом лечении конкрементов в трансплантированной почке и мочеточнике используются дистанционная ударно-волновая литотрипсия (ДЛТ), чрескожная перкутанная нефролитотрипсия (ЧПНЛ), гораздо реже трансуретральная уретеролитотрипсия, экстракция и открытые оперативные вмешательства [29]. ДЛТ успешно применяется при камнях почек и мочеточников размером до 2,5 см [30]. Однако если при относительно небольших камнях (до 1,5 см максимального линейного размера) она показана в виде монотерапии, то при более крупных конкрементах ее необходимо сочетать с катетеризацией почки, установкой внутреннего стента или (реже) чрескожной пункционной нефростомы (ЧПНС).
В 2003 г. испанскими докторами опубликовано исследование эффективности ДЛТ на основании результатов лечения 15 больных. Авторы оценивали статистическую зависимость эффективности ДЛТ от размера конкремента, локализации, количества камней. В данном исследовании у 40% больных были множественные камни в трансплантате, у 53% – в мочеточнике, преимущественно в области мочеточниково-пузырного анастомоза, и у 13% (2 пациента) – в мочевом пузыре. Размеры конкрементов варьировались от 7,9 до 15,8 мм. В 53% случаев до выполнения ДЛТ была установлена чрескожная нефростома в связи с обструктивными осложнениями. Эффективность лечения, оцененная по полному избавлению пациента от камня, составила 87% (13 пациентов). Авторы заключают, что лучший эффект литотрипсии отмечается при одиночном камне, размере конкремента до 13 мм и его локализации в нижнем отделе мочеточника [31]. H. Klingler et al. на основании собственного исследования, включившего 19 пациентов, считают, что ДЛТ показано при размере конкремента от 5 до 15 мм, а если диаметр камня составляет более 15 мм, рекомендуется выполнение ЧПНЛ либо ретроградной уретеролитотрипсии [6]. В настоящее время с развитием рентгенэндоскопического оборудования и аппаратов для контактной литотрипсии показания к проведению ЧПНЛ расширяются, а ее эффективность увеличивается. Данная тенденция прослеживается и в лечении нефролитиаза у больных с трансплантированной почкой.
Многоцентровое исследование, проведенное в 2003 г. в США, показало, что эндоскопические вмешательства на трансплантате превалируют над ДЛТ [32]. J. Hulbert et al. в 1985 г. впервые сообщили об успешно выполненной ЧПНЛ в трансплантате [33]. Z. He at al. в 2007 г. описали результаты лечения 7 больных с конкрементами в почечном трансплантате. Размер конкрементов составлял от 4 до 45 мм. Авторы применили миниатюрный нефросокоп. Всеми больными достигнут хороший результат без каких-либо осложнений [34]. M. Rifaioglu et al. в 2008 г. привели результаты лечения 15 реципиентов почечного трансплантата. Всем больным выполнена ЧПНЛ с 1997 по 2007 г. Сроки после трансплантации составили от 2 недель до 15 лет. Размер конкрементов варьировался от 6 мм до 4 см. У 9 больных конкремент располагался в лоханке либо в лоханочно-мочеточниковом сегменте, у 6 пациентов – в мочеточнике: у 2 – в проксимальном отделе, у 2 – в средней части и у 2 – в нижней трети. В период наблюдения 21,9 месяца рецидива нефролитиаза не отмечено ни у одного больного. Авторы заключают, что ЧПНЛ на трансплантате имеет свои особенности в отличие от подобных вмешательств в отношении пациентов с собственными почками. Сложности могут быть обусловлены взаимоотношением трансплантата с органами брюшной полости, фиброзными изменениями в паранефральной клетчатке, что затрудняет дилатацию свищевого хода, изменением оси почки [35].
Как видно из описания приведенного случая, применение чрескожной перкутанной нефролитотрипсии (ЧПНЛ) не привело к полному удалению конкремента. В трансплантате осталось два конкремента. Один – размером 3,4×2,0 мм в чашечно-лоханочной системе трансплантата, второй – 5,6×2,3 мм в средней чашечке. Первый камень самостоятельно отошел через 14 суток после ЧПНЛ. Второй, по данным УЗИ трансплантата, остается в средней чашечке. В настоящее время, несмотря на наличие конкремента в трансплантате, у больной никаких патологических симптомов не возникает. Посев мочи стерилен. Ухудшения в работе трансплантата не отмечено. В дальнейшем больная от повторного проведения сеанса нефролитотрипсии отказалась. Была назначена консервативная терапия и ежемесячное УЗИ трансплантата. В случае возникновения патологической ситуации в трансплантате из-за наличия в нем конкремента будет предпринята попытка повторной ЧПНЛ.
Ряд исследователей считают возможным динамическое наблюдение за больными, у которых в трансплантате выявлены конкременты, не превышающие 5 мм и не нарушающие отток мочи [36].
Попытки ретроградного извлечения камней редко сопровождаются успехом в связи с плохой доступностью артифициального устья даже для гибких уретероскопов. Тем не менее существуют работы, в которых приводятся хорошие результаты лечения. J. del Pizzo et al. приводят результаты 14 ретроградных уретероскопий у реципиентов почечного трансплантата, при этом 4 больным выполнялась уретеролитоэкстракция. Только у 1 больного возникло осложнение в виде перфорации мочеточника [37]. A. Basiri и соавт. описывают результаты ретроградной уретероскопии у 28 больных. Шести пациентам произведена манипуляция в связи с наличием резидуальных конкрементов в мочеточнике после ДЛТ, четверым была успешна произведена уретеролитоэкстракция [38].
Анализ литературы показал, что в большинстве случаев для достижения эффекта необходимо несколько сеансов ДЛТ: в среднем 2 на одного больного. Половине больных литотрипсия осуществляется на фоне дренирования трансплантата нефростомой. В то же время в литературе достаточно много публикаций, в которых ЧПНЛ и антеградные эндоурологические манипуляции рекомендуются как наиболее эффективные методы лечения нефролитиаза у реципиентов почечного трансплантата независимо от размера конкремента и его локализации. Данный вариант лечения позволяет одномоментно избавлять больного от конкремента, а пребывание в стационаре при неосложненном течении послеоперационного периода меньше, чем при использовании экстракорпоральных методов лечения.
У описываемой больной конкремент в трансплантате, привнесенный с донорской почкой, подлежит удалению теми же методами, что и камни, возникшие после трансплантации через определенный промежуток времени. Разница состоит в том, что у нашей больной не следует искать основания образования конкремента и стараться ликвидировать ее. Тогда как камни в трансплантате, возникшие через временной интервал, имеют определенную причину. Ликвидация этой причины – гарантия того, что конкременты в дальнейшем образовываться не будут.
Таким образом, обнаружение камней в пересаженной почке служит обязательным показанием к их удалению из-за риска ухудшения функции трансплантата и развития хронической мочевой инфекции. Если ранее риск открытого оперативного вмешательства здесь значительно превышал риск осложнений, связанных с нефролитиазом, то современные методы лечения позволяют удалять камни наиболее эффективными и малотравматичными способами и достигать результата со значительно меньшим риском для пораженного органа и организма больного в целом.



