Введение
Одним из осложнений заместительной почечной терапии является развитие белково-энергетической недостаточности (БЭН). По данным различных зарубежных исследований, распространенность БЭН среди гемодиализных пациентов варьируется от 15 до 75% и имеет тенденцию к нарастанию при увеличении длительности данного вида лечения [1]. БЭН является независимым предиктором заболеваемости и смертности пациентов данной когорты [1, 2]. Так, по данным S.S. Kang и соавт., ее наличие увеличивает риск смерти на 27% [2].
К основным причинам развития БЭН относят снижение потребления основных нутриентов вследствие различных факторов, что приводит к развитию БЭН у пациентов, получающих лечение программным гемодиализом (ГД), метаболическим нарушениям, свойственным самой терминальной почечной недостаточности (в частности, увеличение уровня «потенциальных уремических токсинов», в норме выводящихся почками), а также влиянию факторов, связанных с процедурой ГД [3–5]. Среди «потенциальных уремических токсинов» особый интерес в связи с развитием БЭН у пациентов на ГД представляет гормон миостатин. Миостатин – член семейства трансформирующего фактора роста-β с молекулярной массой 25 кДа, источником которого являются скелетная мускулатура, миокард и жировая ткань [6, 7]. Миостатин является физиологическим антагонистом инсулиноподобного фактора роста-1 (ИФР-1), одна из основных функций миостатина заключается в индуцировании апоптоза миоцитов и ингибировании дифференциации миобластов в миоциты, также миостатин способствует распаду мышечного белка путем активации убиквитин-протеасомного пути и каспазы-3 [8, 9].
Уровень циркулирующего миостатина закономерно повышается по мере снижения скорости клубочковой фильтрации и клиренса креатинина и достигает своего максимума у пациентов на ГД [10]. Причина этого не вполне ясна, хотя известно, что фактор некроза опухоли α (ФНО-α) стимулирует экспрессию миостатина, а на ГД происходит нарастание уровня циркулирующих провоспалительных цитокинов [10]. Также увеличению продукции миостатина на фоне ГД способствуют сочетание низкой физической активности, прогрессирование воспалительного процесса и сопутствующий окислительный стресс, накопление уремических токсинов, метаболический ацидоз [P9]. Данные о повышении уровня миостатина у пациентов на ГД и знания о его основных биологических функциях привели к мнению, что повышение уровня миостатина, наблюдаемое у гемодиализных пациентов, является одним из причинных факторов развития БЭН у пациентов этой группы [9, 10].
Цель исследования
Оценить связь между уровнем миостатина в сыворотке крови с показателями БЭН у пациентов, получающих лечение программным ГД.
Материал и методы
Обследованы 645 пациентов, получающих лечение ГД, среди них 300 мужчин и 345 женщин. Средний возраст на момент начала исследования составил 56,8±12,8 года (средний возраст женщин – 58,4±12,7 года, средний возраст мужчин – 54,9±12,8 года; p<0,001). Все пациенты получали лечение бикарбонатным ГД на аппаратах «искусственная почка» с использованием воды, подвергнутой глубокой очистке методом реверсивного осмоса, капиллярных диализаторов с площадью 1,7–2,1 м2. Сеансы ГД проводили 3 раза в неделю по 4,0–5,5 часов, средняя длительность заместительной почечной терапии составила 8,4±5,3 года. Критерий включения в исследование: хроническая болезнь почек С5д. Критерии исключения: длительность ГД-терапии менее 1 года, госпитализация по любому поводу или признаки острого инфекционного процесса в течение последних 3 месяцев, наличие сахарного диабета. Основным заболеванием, приведшим к терминальной почечной недостаточности, являлся первичный гломерулонефрит (51,4%).
Всем пациентам было проведено традиционное клинико- лабораторное обследование. По результатам лабораторного обследования группа в целом характеризовалась предельно допустимым уровнем показателей белкового обмена: общий белок в сыворотке крови – 67,9±4,6 г/л (у женщин – 68,6±4,1, у мужчин – 66,1±4,7 г/л; p<0,01), альбумин в сыворотке крови – 37,5±3,4 г/л (у женщин – 37,8±3,7, у мужчин – 35,6±4,2 г/л; p<0,01), преальбумин в сыворотке крови – 32,4±1,2 мг/ дл (у женщин – 32,9±1,5, у мужчин – 31,4±1,4 мг/дл; p<0,01), начальное снижение уровня трансферрина в сыворотке крови – 1,94±0,37 г/л (у женщин – 1,94±0,51, у мужчин – 1,93±0,42 г/л; p=0,272), нормальный уровень общего холестерина в сыворотке крови – 4,5±1,2 ммоль/л (у женщин – 4,7±1,2, у мужчин – 4,4±1,0 ммоль/л; p<0,001), значительно повышенный уровень С-реактивного белка (СРБ) в сыворотке крови – 7,7±4,2 мг/л (у женщин – 6,8±3,1, у мужчин – 8,1±4,2 мг/л; p<0,01). По данным клинического анализа крови, группа в целом характеризовалась наличием анемии легкой степени тяжести: гемоглобин у женщин – 110,4±14,7 г/л, у мужчин – 113,2±15,1 г/л (p=0,222); нормальный уровень лимфоцитов крови – 1,79±0,39×109/л (у женщин – 1,78±0,57×109/л, у мужчин – 1,79±0,42×109/л; p=0,197)). Доза диализа (spKt/V) – 1,61±0,11 у.е. (у женщин – 1,62±0,32, у мужчин – 1,57±0,11 у.е.; p<0,001) соответствовала представлению об адекватности ГД. Уровень креатинина сыворотки крови до ГД – 843,8±185,3 мкмоль/л (у женщин – 824,1± 137,4, у мужчин – 912,6±175,9 мкмоль/л; p<0,001), мочевины сыворотки крови до ГД – 24,7±5,7 ммоль/л (у женщин – 24,2±5,1, у мужчин – 24,9±4,9 ммоль/л; p=0,778). Показатели кислотно-основного состояния свидетельствовали о наличии умеренного метаболического ацидоза (pH крови – 7,34±0,03, ВЕ, ммоль/л, – -5,31±0,44).
Всем пациентам была проведена диагностика БЭН в соответствии с рекомендациями ISRNM (International Society of Renal Nutrition and Metabolism). Методика включает определение уровней общего холестерина, преальбумина и альбумина в сыворотке крови, измерение индекса массы тела (ИМТ), определение ряда показателей калиперометрии (кожно-жировая складка над трицепсом, окружность мышц плеча) и измерение жировой и мышечной масс тела методом биомпедансометрии (БИМ). Для оценки компонентного состава тела пациента использовали 8-точечную тактильную тетраполярную мультичастотную БИМ на аппарате «InBody» (Южная Корея) с диапазоном частот 1–1000 кГц по 10 измерений для каждой из 6 частот по каждому из 5 сегментов тела (правая и левая руки, правая и левая ноги, туловище); калиперометрию с использованием электронного цифрового калипера «Твес КЭЦ-100-1-Д» (РФ). Нормальными показателями считали содержание жира в организме 10–23% от общей массы тела, окружность мышц плеча –23–25,5 см у мужчин и 21–23 см у женщин. Определение уровня миостатина: для определения концентрации миостатина в сыворотке крови человека методом конкурентного иммуноферментного анализа был использован набор «Myostatin ELISA» (Immunodiagnostik, Германия). Референсные значения для миостатина составили 11–44 нг/мл. Также в сыворотке крови определяли уровень СРБ методом иммунотурбидиметрии (референсные значения 0–1 мг/л).
Статистический анализ полученных результатов проводили с использованием общепринятых параметрических и непараметрических методов. Для расчетов использовали пакет прикладных статистических программ “Statistica Ver. 8.0” (StatSoft, Inc., США). Центральные тенденции при нормальном распределении признака оценивали по величине средних значений и среднеквадратического отклонения (М±σ); при асимметричном – по медиане и квартилям. Статистическую значимость межгрупповых различий количественных переменных определяли с помощью дисперсионного анализа (ANOVA), критерия Манна–Уитни или Уилкоксона, бинарных переменных – с помощью χ2-критерия. Для оценки взаимосвязи двух переменных использовали корреляционный анализ с расчетом непараметрического коэффициента корреляции Спирмена (Rs). Нулевую гипотезу (ошибка первого рода) отвергали при p<0,05.
Результаты
Распространенность БЭН составила 24,9% (160 пациентов), при этом у мужчин и женщин данный синдром выявляли с одинаковой частотой: 24,6% (74) и 24,9% (86) соответственно (χ2=3,099; р=0,212). Связи между возрастом пациентов и распространенностью БЭН не получено (Rs=0,03;1 р=0,427), в то же время установлено, что распространенность БЭН возрастает с увеличением длительности ГД (Rs=0,184; р=0,0001).
Повышенные уровни миостатина были определены у 305 (47,2%) пациентов, при этом у мужчин повышение уровня миостатина встречалось статистически значимо чаще, чем у женщин: 161 (53,7%) и 144 (41,7%) соответственно (χ2=9,158; р=0,002). Распределение показателя было несимметричным (критерий Шапиро–Уилка, W=0,611; p=0,01). Средняя концентрация миостатина в сыворотке крови у мужчин составила 55,1±24,0, у женщин – 48,3±22,0 нг/мл. В ходе исследования достоверной взаимосвязи адекватности дозы ГД (spKt/V) и уровня миостатина выявлено не было, что подтверждается, в частности, величиной коэффициента корреляции Спирмена (Rs=0,063; р=0,106). При этом не было выявлено связи между уровнем миостатина и длительностью диализного лечения (Rs=0,056; р=0,151). Средние значения миостатина у пациентов без признаков БЭН составили 31,2±16,2 нг/мл, а у пациентов с БЭН − 76,7±25,5 нг/мл (p<0,0001). При проведении однофакторного логистического регрессионного анализа, в который в качестве зависимой переменной включена БЭН, а в качестве независимой переменной уровень миостатина в сыворотке крови, получены результаты, представленные в табл. 1.
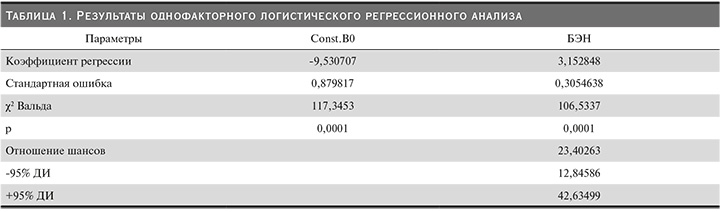
Высокий уровень миостатина в сыворотке крови увеличивает вероятность развития БЭН (по методу ISRNM) в 23,4 раза (χ2=189,87; р=0,0001). Число случаев БЭН у пациентов с нормальным уровнем ФНО-α в сыворотке крови составило 5 из 340, число случаев БЭН с повышенным уровнем миостатина в сыворотке крови составило 155 из 305. Следовательно, синдром БЭН развился практически у каждого второго обследованного пациента с повышенным уровнем миостатина в сыворотке крови.
Характер изменения основных показателей нутриционного статуса в зависимости от уровня миостатина в сыворотке крови представлен в табл. 2.
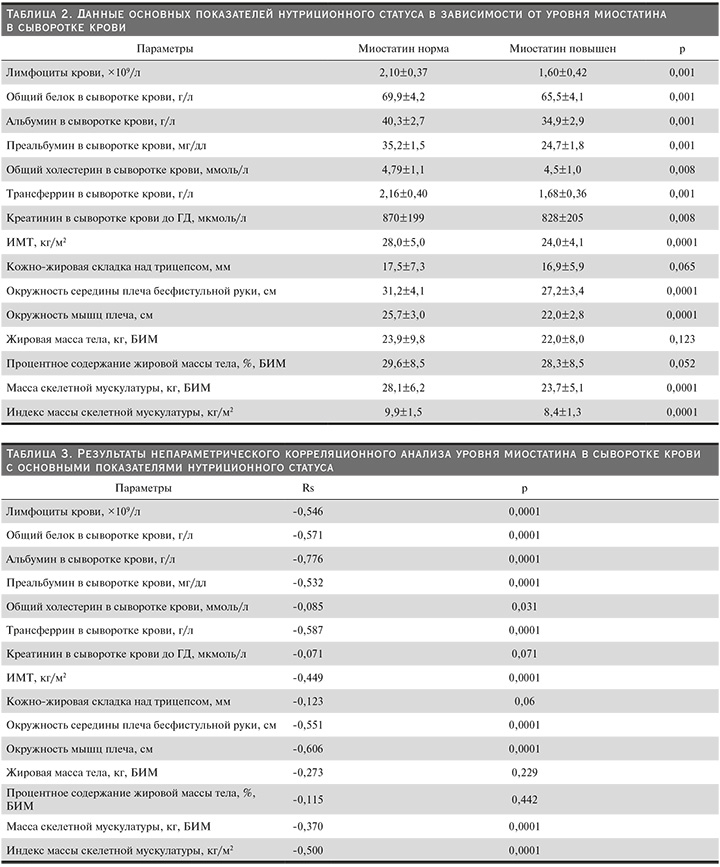
У пациентов с повышенным уровнем миостатина были выявлены статистически значимо более низкие значения показателей БЭН (ИМТ, индекс массы скелетной мускулатуры, а также общий белок, альбумин, преальбумин, общий холестерин, трансферрин и число лимфоцитов крови), чем у пациентов с нормальным уровнем миостатина. При этом статистически значимого изменения показателей жировой массы тела в зависимости от уровня миостатина выявлено не было.
При проведении непараметрического корреляционного анализа уровня миостатина в сыворотке крови с основными показателями нутриционного статуса получены результаты, представленные в табл. 3.
Результаты непараметрического корреляционного анализа выявили значимые отрицательные связи между уровнем миостатина в сыворотке крови и основными показателями нутриционного статуса. При этом значимых связей между уровнем миостатина в сыворотке крови и показателями жировой массы тела выявлено не было.
При проведении непараметрического корреляционного анализа связи между уровнями СРБ и миостатина в сыворотке крови выявлено не было (Rs=-0,172; p=0,106).
Далее был проведен множественный пошаговый регрессионный анализ, в котором в качестве зависимой переменной использовали миостатин в сыворотке крови, а в качестве независимых – основные показатели нутриционного статуса, представленные в табл. 3. В результате была получена следующая модель:
Миостатин=230,6–4,065×альбумин в сыворотке крови, г/л –1,553×окружность мышц плеча, см+0,568×масса скелетной мускулатуры, кг+0,005×креатинин в сыворотке крови до ГД, мкмоль/л – 0,716×индекс массы тела, кг/м2 R2=0,640, F=192,16; p=0,0001.
Обсуждение
Распространенность БЭН среди пациентов, получающих лечение программным ГД, согласно данным мета-анализа J.J. Carrero и соавт. [1], варьируется в диапазоне 28–54%. В нашем исследовании мы осознанно выбрали классификацию диагностики БЭН, предложенную ISRNM, чтобы иметь возможность сравнить распространенность БЭН у обследуемой нами группы гемодиализных пациентов с зарубежными исследованиями. Полученная в данном исследовании распространенность БЭН у пациентов, получающих лечение программным ГД по методу ISRNM, составила 24,9%, что свидетельствует о среднем уровне распространения БЭН. При этом получены данные, свидетельствующие о том, что распространенность БЭН у гемодиализных пациентов возрастает с увеличением длительности ГД (Rs=0,184; р=0,0001), но не зависит от возраста пациента (Rs=0,031; р=0,427).
Повышенные уровни миостатина были определены у 305 (47,2%) пациентов. При этом у мужчин повышение уровня миостатина встречалось статистически значимо чаще, чем у женщин: 161 (53,7%) и 144 (41,7%) соответственно (χ2=9,158; р=0,002). В ходе исследования достоверной взаимосвязи адекватности дозы ГД (spKt/V) и уровнем миостатина выявлено не было, что подтверждается, в частности, величиной коэффициента корреляции Спирмена (Rs=0,063; р=0,106). При этом не было выявлено связи между уровнем миостатина и длительностью ГД (Rs=0,056; р=0,151). Средние значения миостатина у пациентов без признаков БЭН составили 31,2±16,2, у пациентов с БЭН − 76,7±25,5 нг/мл (p<0,0001). Данные однофакторного логистического регрессионного анализа показали, что высокий уровень миостатина в сыворотке крови увеличивает вероятность развития БЭН (по методу ISRNM) в 23,4 раза (χ2=189,87; р=0,0001).
У пациентов с повышенным уровнем миостатина были выявлены статистически значимо более низкие значения основных показателей БЭН (ИМТ, индекс массы скелетной мускулатуры, а также общий белок, альбумин, преальбумин, общий холестерин, трансферрин и число лимфоцитов крови), чем у пациентов с нормальным уровнем миостатина. При этом статистически значимого изменения показателей жировой массы тела (жировая масса тела, процентное содержание жировой массы тела, кожно-жировая складка над трицепсом) в зависимости от уровня миостатина выявлено не было. Схожие данные получены в результате корреляционного анализа миостатина в сыворотке крови с основными показателями нутриционного статуса.
Таким образом, полученные нами результаты корреляционного анализа и множественного пошагового регрессионного анализа выявили, что уровень миостатина наиболее тесно взаимосвязан с показателями мышечной массы тела и при этом не имеет связи с показателями жировой массы тела.
Отрицательное влияние миостатина на мышечную ткань у пациентов на программном ГД может быть объяснено его основными физиологическими функциями [11]:
1. Миостатин, взаимодействуя со своим рецептором (рецептор активина II типа B – ActRIIB) на поверхности мышечных клеток, приводит к активации и фосфорилированию транскрипционных факторов Smad-2 и Smad-3. Затем Smad-2, -3 транспортируются в ядро, где модулируют транскрипцию E3-убиквитинлигаз, таких как атрогин-1 (также известный как MAFbx) и Muscle Ring-Finger Protein-1 (MuRF-1), что усиливает распад мышечных белков через убиквитин-протеасомную систему.
2. Миостатин индуцирует апоптоз миоцитов и ингибирует дифференциацию миобластов в миоциты.
3. Миостатин, являясь физиологическим антагонистом ИФР-1, в высоких концентрациях блокирует сигнальный путь ИФР-1/протеинкиназы β (ИФР-1/Akt), отвечающий за запуск синтеза мышечного белка и рекрутирование мышечных клеток- сателлитов.
Таким образом, представляется важным поиск путей терапевтического воздействия на уровень миостатина в сыворотке крови у пациентов на ГД с целью профилактики отрицательного влияния повышенного уровня миостатина на основные показатели БЭН, преимущественно показатели состояния мышечной ткани.
Заключение
Распространенность БЭН у пациентов, получающих лечение программным ГД, по методу ISRNM составила 24,9%. Повышение уровня миостатина в сыворотке крови является важным патогенетическим звеном в развитии БЭН у пациентов, получающих лечение программным ГД, преимущественно за счет отрицательного влияния на мышечную ткань пациента.



