Введение
Тройная иммуносупрессивная схема терапии ингибиторами кальциневрина, антиметаболитами и глюкокортикостероидами является общепризнанной для реципиентов почечного трансплантата [1]. Трансплантация почки снижает риск смерти и улучшает качество жизни диализных больных [2]. За последние 20 лет трансплантация почки улучшилась, а число реципиентов значительно возросло благодаря применению ингибиторов кальциневрина [3]. Однако различное влияние циклоспорина (ЦсА) и такролимуса (ТЛ) на долгосрочный прогноз пациентов до сих пор обсуждается [4].
Материалы и методы
Проводя собственное 30-летнее (с 1989 по 2018 г.) ретроспективное исследование среди реципиентов почечного трансплантата (РПТ), мы выявили статистически значимые различия по уровню расчетной скорости клубочковой фильтрации (рСКФ) мл/мин/1,73 м2, вычисленной по формуле MDRD [5], Ме (95% ДИ) 41 [28–56] vs 48 [36–60], р=0,002, между двумя группами пациентов, получавших ЦсА или ТЛ соответственно за период с 2007 по 2012 г. (табл. 1).

Те же пациенты достоверно различались по возрасту, полу и выживаемости. Пациенты, получавшие ТЛ, были моложе, среди них было больше мужчин и выживаемость была лучше (табл. 2).
Поэтому мы решили использовать мета-анализ, чтобы сравнить воздействие ЦсА и ТЛ на СКФ и выживаемость, нивелируя значение возраста и пола реципиентов.
В электронных базах данных PubMed, MEDLINE, Scopus и в Кокрановской библиотеке был проведен поиск подходящих исследований, опубликованных до 2022 г., в которых проводилось сравнение поддерживающей иммуносупрессии на основе ТЛ и ЦсА в экспериментальной и контрольной группах соответственно. Стратегия поиска включала следующие термины: аллотрансплантация почки, ингибиторы кальциневрина, ЦсА, ТЛ, СКФ, рСКФ, смертность РПТ.
В мета-анализ включались рандомизированные контролируемые и ретроспективные исследования, сравнивавшие эффекты ЦсА и ТЛ у РПТ. За влиянием ингибиторов кальциневрина на функцию почечного трансплантата и выживаемость пациентов наблюдали в течение года или более после аллотрансплантации почки. Первичным результатом исследований была выживаемость пациента, вторичным результатом была функция почечного трансплантата, определяемая по клиренсу креатинина, СКФ (мл/мин) или рСКФ (мл/мин/1,73 м2). В обзор были включены работы, которые соответствовали условиям отчетности для систематических обзоров и метаанализа (PRISMA) [6].
Из каждого исследования была извлечена следующая информация: имена авторов, название журнала, страна, место, продолжительность наблюдения, общее число включенных РПТ, их характеристики (возраст, пол), лабораторные (креатинин), клинические (СКФ, рСКФ) данные и результаты исследования (выживаемость) отдельно для группы ЦсА и ТЛ. Два автора (Н. и М.) независимо друг от друга проверили электронные заголовки, аннотации и полные тексты статей. Разногласия были разрешены путем консенсуса с третьим автором (З.). Качество включенных исследований оценивали с использованием шкалы NOS (Newcastle–Ottawa Scale – форма оценки качества Ньюкасл–Оттава для когортных исследований) [7] и руководства Caucus Blue [8].
Непрерывные переменные выражали как средние различия (СР) и 95% доверительный интервал (ДИ), а дихотомические переменные выражали как отношение (ОШ) и 95% ДИ. Метаанализ пропорций проводился по методу Мантела–Ханзела с использованием преобразования Фримана–Туки для вычисления взвешенной суммарной доли по модели фиксированных и случайных эффектов. Если в первоначальных исследованиях наблюдалась значительная неоднородность, использовалась модель случайных эффектов. В противном случае использовалась модель с фиксированными эффектами. Гетерогенность модели оценивали с использованием p-значения Q-теста Кокрейна [9] и индекса I2. Индекс I2 выше 75% указывает на неоднородность от средней до высокой [10]. Для проверки систематической ошибки публикации мы применяли метод линейной регрессии Эггера и метод ранговой корреляции Бегга с использованием тау Кендалла в качестве меры ассоциации [11]. Потенциальная систематическая ошибка публикации представлена в виде воронкообразного графика.
Результаты
На рис. 1 показана блок-схема выбора исследования. В общей сложности 678 исследований были получены с использованием наших критериев поиска. После исключения дублирующих ссылок и нерелевантных исследований 163 статьи прошли полнотекстовый обзор и 16 из них были включены в окончательный мета-анализ [12–27].

Блок-схема скрининга показана на рис. 1, общие данные и характеристика исследований показаны в табл. 3. Пять исследований проводились в течение 1 года [12, 13, 15, 23, 27], по 1 исследованию в течение 2 и 4 лет [16, 24], 3 исследования проводились в течение 5 лет [17–19], по 2 исследования в течение 6 и 7 лет [20, 21, 25, 26] и по 1 в течение 10 и 13 лет [14, 22]. Объединенные основные результаты мета-анализа приведены в табл. 4.
В 13 анализируемых исследованиях вместе с собственным из 17 включенных общее число реципиентов составило 11 376, в экспериментальной группе 6084 и в контрольной – 5292 [12–19, 22, 23, 25–27]. Объединенные результаты в фиксированной модели показали, что реципиенты в экспериментальной группе были моложе (CР=0,078, 95%ДИ от -0,117до 0,0426; р=0,001), однако в случайной модели это не подтвердилось и возраст пациентов между группами не различался (СР=0,07, 95% ДИ от -0,144 до 0,00421; р=0,064, табл. 4 и рис. 2). Пациенты, получавшие ТЛ и наблюдавшиеся в Московском нефрологическом центре ГКБ № 52 ДЗМ, были моложе (СР=0,324, 95% ДИ от -0,516 до -0,131) по сравнению с большинством из других исследований (табл. 4 и рис. 2). Данные мета-анализа были слабогетерогенными: I2 – 52,07%, 95% ДИ от 11,84 до 73,94%; Q-тест, p= 0,012. Системная ошибка публикации не была выявлена. Результаты представлены на рис. 3.
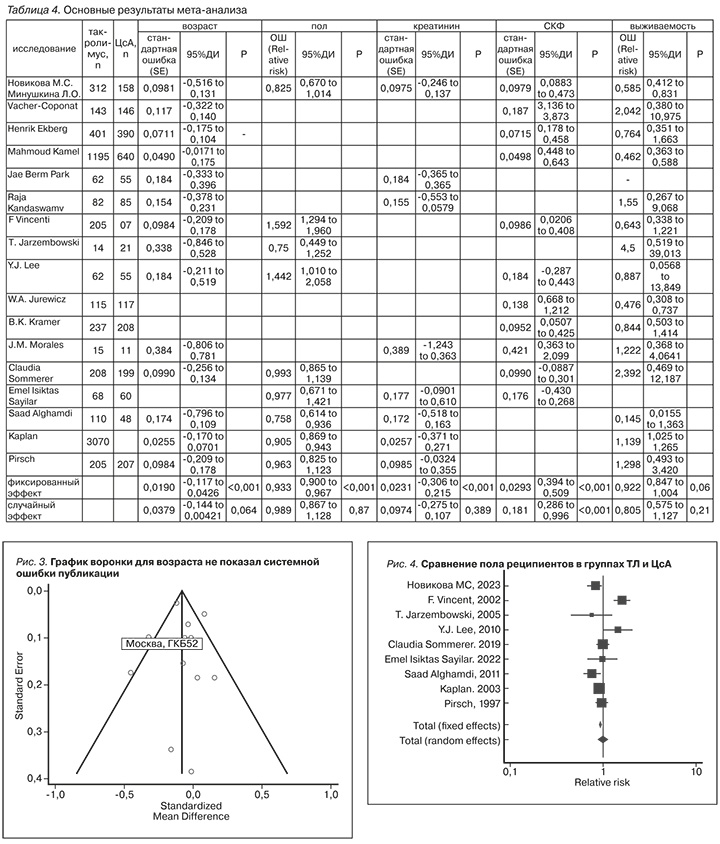
В 8 анализируемых исследованиях вместе с собственным из 17 включенных общее число реципиентов составило в контрольной группе 4254, в экспериментальной – 4025, среди них мужчин было 2405 и 2458 соответственно [17–19, 23–27]. Объединенные результаты показали, что не было существенной разницы по гендерным различиям между группами (ОШ=0,99, 95%ДИ от 0,867 до 1,128; р=0,87, табл. 4 и рис. 4). Данные мета-анализа были гетерогенными: I2=80%, 95% ДИ от 62,86 до 89,29, Q-тест; p<0,0001, однако систематической ошибки отбора данных выявлено не было (рис. 5).
В 7 анализируемых исследованиях вместе с собственным из 17 включенных общее число реципиентов составило 7618, в экспериментальной группе 3924 и в контрольной – 3694 [15, 16, 22, 24–27]. Объединенные результаты в фиксированной модели показали, что креатинин через год и более после трансплантации был ниже для иммуносупрессивных схем на основе ТЛ, чем для иммуносупрессивных схем на основе ЦсА (CР=0,26, 95% ДИ от 0,306 до -0,215; р<0,001). Однако это различие в случайной модели не подтвердилось (СР=0,084, 95% ДИ от 0,275 дo 0,107; р 0,389 (??), табл. 4 и рис. 6).
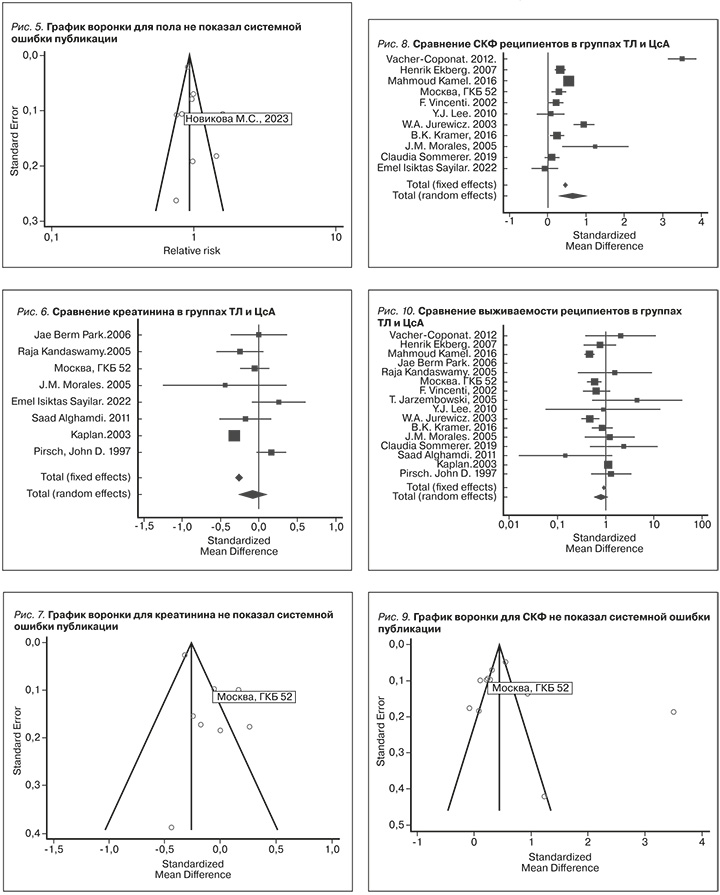
Данные мета-анализа были гетерогенными: I2=82,24%, 95% ДИ от 66,24 дo 90,66, Q-тест; p<0,0001, но систематической ошибки отбора данных выявлено не было. Результаты представлены на рис. 7.
В 10 анализируемых исследованиях вместе с собственным из 17 включенных общее число реципиентов составило 5152, в экспериментальной группе 2961 и в контрольной – 2191 [12–14, 17, 19–24]. Объединенные результаты в фиксированной модели показали, что СКФ через год и более после трансплантации была значительно выше для иммуносупрессивных схем на основе ТЛ, чем для ЦсА (CР=0,451, 95% ДИ от 0,39 до 0,5; р<0,001). Это различие подтвердилось и в случайной модели (СР=0,641, 95% ДИ от 0,286 до 0,996; р<0,001, табл. 4 и рис. 8).
Данные мета-анализа были значительно гетерогенными: I2=96,96%, 95% ДИ от 95,8 дo 97,79, Q-тест; p<0,0001, однако систематической ошибки отбора данных выявлено не было. Результаты представлены на рис. 9.
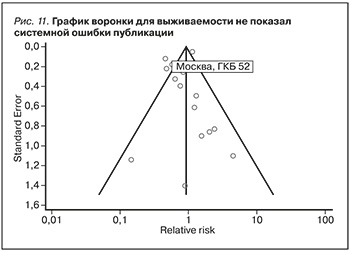
Во всех 17 анализируемых исследованиях общее число выживших реципиентов составило в экспериментальной группе 436 и в контрольной – 5617, число умерших составило 869 и 832 соответственно. ТЛ не превосходил ЦсА в улучшении выживаемости пациентов через год и более после трансплантации почки (ОШ=0,8, 95% ДИ от 0,57 дo 1,127; р=0,2). Результаты представлены в табл. 4 и на рис. 10. Данные мета-анализа были гетерогенными: I2=80,51%, 95% ДИ от 68,76 дo 87,85, Q-тест; p<0,0001, однако систематической ошибки отбора данных выявлено не было (рис. 11).
Обсуждение
В настоящее время трансплантация почки является лучшим вариантом лечения для большинства пациентов с почечной недостаточностью. По сравнению с непрерывным диализом трансплантация улучшает качество жизни и снижает смертность пациентов [28]. Хотя использование иммуносупрессивных препаратов позволяет достигать >95% годовой выживаемости трансплантата, его долгосрочная выживаемость остается не такой многообещающей [29].
Основными неимунными факторами, определяющими выживаемость, являются возраст и пол реципиента [30, 31]. Возраст и пол также являются обязательными переменными для определения рСКФ и клиренса креатинина по формуле Кокрофта–Голта [32]. Клиренс креатинина, полученый в результате проведения пробы Реберга, в отличие от расчетных методов определения СКФ не учитывает показателей возраста и пола [33]. В материалах и методах мы ретроспективно показали, что рСКФ была выше и выживаемость лучше у более молодых пациентов, получавших ТЛ, по сравнению с группой ЦсА. Кроме этого среди них было больше мужчин (табл. 1, 2). Похожие храктеристки реципиентов встречались в работах F. Vincenti и соавт. и Claudia Sommerer и соавт., и результаты по выживаемости и рСКФ в них были близки к нашим [17, 23]. Отсутствие существенных возрастных и гендерных различий между экспериментальной и контрольной группами (рис. 2, 4 ) может отчасти объяснить отсутствие разницы по долгосрочной выживаемости реципиентов в данном мета-анализе (рис. 10), которая была неоднородной: I2=80,51%; р<0,0001. Однако тест Бегга (р=0,125) и тест Эггера (р=0,437) исключают наличие систематической ошибки в данном случае (рис. 11).
Отсутствие существенных возрастных и гендерных различий между экспериментальной и контрольной группами имеет большое значение и для полученного результата по СКФ в связи с тем, что в исследованиях, включенных в мета-анализ, определяли как клиренс креатинина, так и рСКФ.
В исследованиях M. Kamel и соавт. и W. A. Jurewicz и соавт. метод определения СКФ (мл/мин) (по клиренсу креатинина или формуле Кокрофта–Голта) не был указан [14, 20].
J. M. Morales и соавт. определяли клиренс креатинина [22].
H. Ekberg и соавт. [13] и B.K. Kramer и соавт. [21] определяли СКФ по формуле Кокрофта–Голта [32]. В исследованиях Vacher–Coponat и соавт. и F. Vincenti и соавт. применяли рСКФ (мл/мин/1,73 м2) без указания конкретной формулы [12, 17].
E. I. Sayilar и соавт. [24] определяли рСКФ по уравнению креатинина 2009 г., представленному Совместной организацией по эпидемиологии хронических заболеваний почек (CKDEPI) [34], C. Sommerer и соавт. [23] определяли рСКФ по формуле Нанкивелла [35], Y. J. Lee и соавт. [19] определяли рСКФ по формуле MDRD [5].
В исследованиях, выполненных J. B. Park, R. Kandaswamy, Jarzembowski, Alghamdi, Kaplan, Pircsh, были сведения только по сывороточному креатинину без данных по СКФ [15, 16, 18, 25–27].
В нашем мета-анализе СКФ была выше в экспериментальной группе по сравнению с контрольной. Для СКФ была выявлена значительная неоднородность I2=96,96%; p< 0,0001. Однако тест Бегга (р=0,815) и тест Эггера (p=0,456) не предполагают наличия систематической ошибки в данном случае (рис. 9).
В связи с полученными результатами данного мета-анализа по СКФ можно было бы ожидать похожее положительное влияние ТЛ на креатинин по сравнению с ЦсА. Однако достоверных различий по креатинину между группами получено не было (рис. 6). Различия в определении исходных СКФ и калибровке креатинина, вероятно, могут объяснить неоднородность полученных результатов в данном мета-анализе. Эти факторы должны учитываться исследователями и клиницистами при интерпретации оценок СКФ у РПТ [36].
До принятия общепризнанной концепции хронической болезни почек [37] применение рСКФ и клиренса креатинина в качестве долгосрочного прогностического показателя среди РПТ вызывало сомнения [38]. Результаты исследований, включенные в этот мета-анализ, демонстрируют обратное.
H. Ekberg и соавт. показали, что выживаемость почечного трансплантата была лучше у тех пациентов, у которых СКФ была выше [13]. M. Kamel и соавт. показали лучшую 3и 5-летнюю выживаемость трансплантата по сравнению с пациентами, у которых СКФ была ниже (88 и 84% по сравнению с 79 и 70%; p<0,001 соответственно) [14]. F. Vincenti и соавт. показали увеличение выживаемости трансплантата через 5 лет в группе лечения ТЛ, в которой рСКФ была выше (65,4 против 42,6% для пациентов в группе лечения ЦсА с более низкой СКФ; p=0,013) [17]. W. A. Jurewicz и соавт. показали, что пациенты, получавшие ТЛ, имели бóльшую СКФ и значительно лучше выживали (6-летняя выживаемость трансплантата 81 против 60%; p=0,0496). Важно отметить, что превосходящая функция почек у них была связана с низким сердечно-сосудистым риском по сравнению с группой контроля [20]. B. K. Kramer и соавт. показали, что через 2 года после трансплантации лучшая функция почек, измеренная по концентрации креатинина в сыворотке (136,9 против 161,6 мкмоль/л; p<0,01), была связана с меньшей частотой встречаемости комбинированной конечной точки, состоявшей из потери трансплантата, смерти пациента и подтвержденного биопсией острого отторжения (42,8 против 25,9%; p<0,001) [21].
В многовариантных моделях снижение рСКФ было достоверно связано с увеличением числа госпитализаций: снижение рСКФ на каждые 10 мл/мин/1,73 м2 приводило к увеличению частоты госпитализаций на 11% (p<0,001). Более низкая рСКФ через 6 мес. после трансплантации была связана с увеличением числа поздних госпитализаций среди взрослых РПТ [39]. Снижение рСКФ на 30% между 1-м и 3-м годами после трансплантации почки тесно связано с экспоненциально возрастающим риском отторжения трансплантата и смерти (ОШ=2,20, 95% ДИ от 1,87 до 2,60) [40].
Заключение
Таким образом, многими исследователями показано, что рСКФ можно рассматривать в качестве прогностического показателя долгосрочной выживаемости реципиента и почечного трансплантата.
В связи с этим в настоящее время актуальна разработка прогоностической модели долгосрочной выживаемости реципиента и почечного трансплантата, основанной на единой рСКФ [36, 41] и направленной на раннюю стратификацию риска для РПТ по аналогии с существующей общепринятой концепцией хронической болезни почек [37].



