Введение
Атипичный гемолитико-уремический синдром (аГУС) – хроническое системное заболевание, основу которого составляет изъян активации системы комплемента, ведущий к массивному тромбообразованию в сосудах микроциркуляторного русла (комплемент-опосредованная тромботическая микроангиопатия – ТМА) [1–3]. Предполагается, что имеющиеся мутации генов, кодирующих регуляторные белки, приводят к нарушению защиты эндотелиальных клеток от активации комплемента. В результате на поверхности эгдотелия образуется большое количество МАК (мембраноатакующий комплекс), повреждающих эндотелий и приводящих к повышенному тромбообразованию. Отсюда и следует классическая триада аГУС – тромбоцитопения потребления, неиммунная гемолитическая анемия и как слетствие – острое повреждение почек [2]. Генерализованный характер ТМА при аГУС обусловливает развитие экстраренальных признаков болезни, связанных с поражением микроциркуляторного русла различных органов и систем, в т.ч. головного мозга, сердца, легких, желудочнокишечного тракта. Внепочечные проявления заболевания наблюдаются у 20% пациентов, из которых почти две трети имеют более одного экстраренального признака [1, 3].
Заболевание имеет в своей основе генетическую природу, однако в настоящее время установлено, что генетические аномалии комплемента являются не причиной, а фактором, предрасполагающим к развитию ТМА. Для реализации этой предрасположенности требуются дополнительные факторы. Наиболее распространенными из них являются инфекции, аутоиммунные заболевания, злокачественные новообразования, беременность и роды, трансплантация костного мозга и сóлидных органов, некоторые лекарственные препараты. Почти у половины больных аГУС триггерные факторы идентифицировать не удается [1–3, 6].
Ниже приводится клинический случай развития клиниколабораторных проявлений ТМА после перенесенной аллогенной трансплантации трупной почки.
Клинический случай
Пациентка И. 27 лет, амбулаторная карта № 126734. С 2016 г. регистрировались протеинурия до 1 г/сут. с «пустым» мочевым осадком, эпизоды повышения артериального давления. Трактовалась как хронический гломерулонефрит. От выполнения нефробиопсии пациентка категорически отказалась, патогенетическую терапию не получала. Функция почек прогрессивно снижалась, появилась и постепенно нарастала анемия. Обращало на себя внимание злокачественное течение артекриальной гипертензии (АГ), резистентной к многокомпонентной антигипертензивной терапии. На протяжении всего периода наблюдения уровень тромбоцитов оставался в пределах референтных значений, анемия расценивалась как проявление хронической болезни почек. В январе 2022 г. в связи с критически высокой азотемией, развитием анасарки экстренно начата заместительная почечная терапия методом гемодиализа.
В ходе наблюдения в диализном центре достигнуты целевые уровни гемоглобина, уровень тромбоцитов сохранялся в пределах референтных значений, сохранялся злокачественный характер АГ на фоне многокомпонентной антигипертензивной терапии, адекватного объема ультрафильтрации.
Операция аллотрансплантации почки от посмертного иммуносовместимого донора выполнена 26.07.2022. Периоперационная кровопотеря оценивалась в 700 мл. Функция трансплантата отсроченная. Ранний послеоперационный период осложнился развитием рефлюкс-пиелонефрита трансплантата, ассоциированного с ростом Pseudomonas aeroginosae, а также формированием гематомы ложа трансплантата. Лабораторно отмечалась анемия тяжелой степени – гемоглобин 59 г/л, гематокрит 19%, тромбоцитопения до 108×109/л, лейкоцитоз 31×109/л, С-реактивный белок (СРБ) 71 мг/л, прокальцитонин (ПКТ) 14 нг/мл, азотемия по креатинину 433 мкмоль/л, по мочевине 42 ммоль/л. Удален стент мочеточника трансплантата, начата антибактериальная терапия согласно чувствительности. С целью снижения иммуносупрессии уменьшена доза мофетила микофенолата до 1 г/сут., снижена концентрация такролимуса в сыворотке до минимально допустимой – 6 нг/мл, постепенно снижена доза глюкокортикостероидов (преднизолон) до 5 мг/сут.
На фоне проводимой терапии – положительный клиниколабораторный эффект в виде нормализации температуры тела, снижения провоспалительных лабораторных маркеров, нарастания уровня тромбоцитов до 330×109/л, снижения азотемии по креатинину до 260 мкмоль/л, мочевины до 10 ммоль/л. По данным ультразвукового исследования: гематома ложа трансплантата сохраняется в прежнем объеме, организуется согласно срокам года. Пациентка выписана для амбулаторного наблюдения 30.09.2022, иммуносупрессивная терапия в объеме: такролимус, с целевыми значениями концентрации в сыворотке 8–12 нг/мл, преднизолон 10 мг/сут., микофенолата мофетил 1500 мг/сут.
Плановый лабораторный контроль выполнен 03.10.2022: гемоглобин 86 г/л, тромбоциты 462×109/л, азотемия по креатинину 485 мкмоль/л, по мочевине 19 ммоль/л. Состояние пациентки расценено как острое отторжение трансплантата (клеточное?). С целью купирования острого отторжения инициирована пульс-терапия преднизолоном ex juvantibus. Диагностическая биопсия трансплантата выполнена 04.10.2022. Шестого октября 2022 г. возникла фебрильная лихорадка до 39 ºС, лабораторно: нарастание провоспалительных маркеров, бактериологическое исследование крови от 06.10.2022 – рост Klebsiela pneumonia, Pseudomonas aeruginosa, штаммы полирезистентные. По результатам магнитно-резонансной томографии (МРТ) органов малого таза: по задней поверхности почки с распространением на нижне-переднюю поверхность почки подкапсульная хроническая гематома неоднородной структуры ~размером (верт.хфронт.хсаг.) 10,9х7,4х3,4 см (прежний размер – 11,7х8,2х5,0 см от 06.08.2022, 9,4х10,91х8,81х5,72см от 03.08.2022); в проекции верхнего полюса почки по латеральной поверхности определяется клиновидная зона ~размером 3,2х2,8 см, аналогичная зона прослеживается в нижнем полюсе почки ~размером 1,5х0,8 см – более вероятно зоны инфаркта. По ходу левых подвздошных сосудов в левых отделах малого таза сохраняются хронические гематомы максимальным размером 8,0x2,0 см. Состояние пациентки расценено как сепсис на фоне иммуносупрессивной терапии, в качестве источника инфекции расценена подкапсульная гематома трансплантата. Седьмого октября 2022 г. выполнены трансплантатэктомия, ревизия и санация ложа трансплантата, отменена иммуносупрессивная терапия, назначена комбинированная антибактериальная терапия. На фоне проведенного лечения состояние пациентки с положительной динамикой в виде снижения уровня провоспалительных маркеров (СРБ, ПКТ), в бактериальном исследовании крови от 11.10.2022 роста нет, однако сохранялись эпизоды фебрильной лихорадки, обращала на себя внимание анемия тяжелой степени, панцитопения. Продолжалась антибактериальная терапия, выполнялись гемотрансфузии эритроцитарной (ЭР) взвеси.
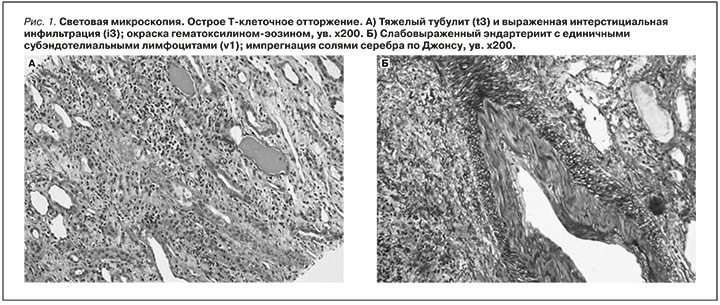
Десятого октября 2022 г. получен результат гистологического заключения материала биопсии почечного трансплантата. Выполнено стандартное исследование биопсии почечного трансплантата: светооптическим методом на парафиновых срезах с использованием окрасок гематоксилином-эозином, PAS-реакции, окраски трихромом по Массону, импрегнации солями серебра по Джонсу; иммунофлуоресцентным методом на свежезамороженных срезах с использованием FITC-коньюгированных антител к иммуноглобулину А (IgA), IgG, IgM, C3, C1q, фибрину, легким цепям kappa и lambda; иммуногистохимическим иммунопероксидазным методом с использованием антител к C4d-компоненту системы комплемента и Polyoma-SV40. Выявлены диффузный тяжелый тубулит с острым канальцевым некрозом и густая интерстициальная инфильтрация, представленная лимфоцитами, плазматическими клетками, нейтрофильными лейкоцитами и единичными эозинофильными лейкоцитами (рис. 1-А). В срезе единственной представленной артерии среднего калибра определялся слабовыраженный эндартериит в виде незначительного субэндотелиального отека и немногочисленных субэндотелиальных лимфоцитов (рис. 1-Б). Отмечено очаговое резкое утолщение стенок отдельных артериол и артерий мелкого калибра за счет выраженного субэндотелиального отека, с субтотальной обтурацией их просвета (рис. 2 А, Б). Клубочки без патологии. Признаков хронизации нет, а именно гломерулосклероза, тубулоинтерстициального фиброза и артериолосклероза. Иммунофлуоресцентное и иммуногистохимическое исследования не выявили специфической экспрессии.

По результатам исследования вынесено гистологическое заключение о сочетанном поражении ткани трансплантата:
1) Острое Т-клеточное отторжение, Banff II-A с незначительным эндартериитом (v1), выраженным тубулитом (t3), выраженной интерстициальной инфильтрацией (i3) острым канальцевым некрозом без признаков хронизации.
2) Очаговая острая обтурирующая микроангиопатия трансплантата (очаговая ТМА) с фокальным резким субэндотелиальным отеком и субтотальной обтурацией просветов отдельных артериол.
К гистологическому заключению патологом был сделан комментарий с диагностическим суждением о том, что с учетом неверифицированного первичного заболевания почек с утратой функции в молодом возрасте, анамнеза высокой АГ и гистологической картины очаговой ТМА возможно первичное заболевание из группы аГУС и его рецидив в трансплантате. С учетом гистологического заключения и высказанного патологом в комментариях к нему предположения об аГУС как об основной причине утраты функции собственной почки, а также того факта, что аГУС яляется по сути диагнозом исключения пациентка была дообследована в рамках дифференциального диагноза ТМА. Отмечалось незначительное повышение уровня лактатдегидрогеназы (ЛДГ) до 308 ЕД/л, прицельно исследована структура популяции эритроцитов, выявлен шизоцитоз 1–2%. Непрямая реакция Кумбса отрицательная. Выполнен иммуноферментный анализ на шига-токсин – отрицательно. Выполнялась диагностика антифосфолипиндного синдрома (АФС) – результаты тестов на антинуклеарный фактор, антитела к β-2 гликопротеиду, антитела к кардиолипину Ig M/Ig G отрицательные, что снижает вероятность наличия первичного и вторичного АФС. Выполнялось исследование системы комплемента: уровень С3 незначительно ниже референтных значений, С4 в пределах референтных значений; выполнялась диагностика ADAMTS-13 в плазме – 75,7%, что исключает диагноз тромботической тромбоцитопенической пурпуры, антитела к фактору Н 2,6 ЕД/мл (N<32), снижает вероятность приобретенного (антительного варианта) аГУС.
В ноябре 2022 г. в клинической картине на первый план выступила неврологическая симптоматика: на фоне относительного благополучия появились эпизоды генерализованных судорог.
Второго ноября 2022 г. пациентке выполнена МРТ головного мозга, при которой выявлены:
- подострая субдуральная гематома в левой теменной области на фоне субарахноидального кровоизлияния. Достоверно нельзя исключать присоединение воспалительных изменений по типу менинго-энцефалита
- правосторонняя срединная дислокация.
Выполнена люмбальная пункция: получено 4 мл спинномозговой жидкости мутно-розового цвета. Ликвор вытекал под повышенным давлением 90 капель в минуту. Цитологическое исследование ликвора: цвет – розовый, мутная, цитоз – 4,7×106/л, эритроциты в большом количестве, белок ликвора – 0,3 г/л. Исключен инфекционный генез судорожного синдрома.
Начата противосудорожная терапия препаратом левитирацетам в дозе 1000 мг/сут. с постепенным увеличением дозы до 1500 мг/сут. На фоне монотерапии сохранялись судорожные эпизоды до 10 раз за 24 часа, к терапии добавлен фенобарбитал 0,3 г/сут. При повторении эпилептических приступов с целью купирования вводился раствор тиопентала натрия.
Длительное время клинически превалировала следующая неврологическая симптоматика: серии судорожных припадков ежедневно до 6–7 эпизодов в сутки на фоне базисной противосудорожной терапии. Купировались введением раствора тиопентала натрия в больших дозах.
Лабораторно обращала на себя внимание сохраняющаяся анемия, коагулопатия, тромбоцитопения. Проводилась гемокомпонентная терапия: трансфузии ЭР-взвеси, криопреципитата, свежезамороженной плазмы.
С учетом анамнеза заболевания (неверифицированный гломерулонефрит, злокачественная АГ, триада ТМА после трансплантации почки), исключения возможных других первичных (тромботическая тромбоцитопеническая пурпура, ЅТЕС-гемолитико-уремический синдром) и вторичных TMA состояние пациентки расценено как рецидив аГУС после перенесенной трансплантации почки.
В связи с тем, что предполагаемая польза от проведения таргетной терапии аГУС превышала риск от возможных побочных эффектов, было принято решение о начале лечения препаратом Элизария (экулизумаб) по схеме: 900 мг в/в 4 недели, на 5-й неделе – 1200 мг, в последующем – 1200 мг в/в 1 раз в 2 недели, на фоне антибактериальной профилактики менингококковой инфекции, вплоть до появления возможности вакцинации.
С 23.11.2022 начата таргетная терапия. На фоне терапии уже после первого введения отмечалась положительная клиниколабораторная динамика в виде улучшения общего состояния, регресса генерализованных судорожных припадков – тонические и клонические судороги купированы полностью на фоне снижения дозы базисной противосудорожной терапии, снизилась выраженность АГ. Лабораторно: повышение уровня тромбоцитов (до 286х109/л), гемоглобина (до 93 г/л), снижение уровня ЛДГ (до 196 ЕД/л).
Пациентка выписана 27.12.2022 для продолжения таргетной терапии и проведения сеансов заместительной почечной терапии амбулаторно в диализном центре. Запланировано выполнение генетического скрининга панели заболевания
«Атипичный гемолитико-уремический синдром» с целью определения необходимой длительности таргетной терапии и прогноза заболевания.
Обсуждение
В представленном наблюдении имеет место анамнез злокачественной АГ и неверифицированное заболевание, приведшее к терминальной стадии хронической болезни почек. Симптомы, характерные для аГУС: анемия, снижение уровня тромбоцитов и острое почечное повреждение трансплантата, развились у пациентки в раннем послеоперационном периоде. Однако неспецифичные симптомы были расценены как последствие кровопотери значимого объема во время операции с последующим формированием гематомы ложа трансплантата и отсроченной функцией трансплантата. Обсуждение диагноза ТМА стало возможным в первую очередь благодаря результатам морфологического исследования ткани трансплантата и было затруднено на фоне развития послеоперационных осложнений и текущего септического состояния.
Данное наблюдение иллюстрирует сложность диагностики аГУС, а также вероятность благоприятного исхода при условии своевременно установленного диагноза и незамедлительного начала адекватной терапии. Особенностью таргетной терапии экулизумабом является возможность улучшения функции вовлеченного органа или полного регресса органных поражений, в данном примере – головного мозга.
Заключение
В последние годы распространенность аГУС значительно возросла и диагноз все чаще встречается в практике врачейнефрологов. Вероятнее всего, это связано со все более глубоким пониманием патогенеза патологии и расширением возможностей в диангостике заболевания, а также с увеличением интереса к заболеванию в медицинском сообществе, более широким распространением темы в медицинской литературе. Однако, несмотря на простейшие и банальные клинические признаки (тромбоцитопения и гемолитическая анемия), диагностика аГУС все еще представляется трудной в связи с отсутствием патогномоничных признаков и является диагнозом исключения.



