Введение
Общепризнанно, что при метаболическом синдроме различные варианты поражения органов-мишеней, как правило, развиваются параллельно, а темп их формирования бывает особенно быстрым [1]. Среди вариантов поражения органовмишеней при метаболическом синдроме в настоящее время
называют также неалкогольную жировую болезнь печени (НАЖБП), спектр клинико-лабораторных проявлений которой варьируетcя от выявляемого при ультразвуковом исследовании стеатоза до неалкогольного стеатогепатита (НАСГ) [2]. С точки зрения оптимизации диагностики и лечения НАЖБП при метаболическом синдроме особое значение имеет детализация ее взаимосвязей с вовлечением других органов. Ориентируясь на результаты клинических и экспериментальных исследований, можно утверждать существование при метаболическом синдроме четкого параллелизма между НАЖБП и хронической болезнью почек (ХБП). Так, в популяционном исследовании, включившем 10 337 здоровых мужчин – жителей Южной Кореи, показано, что у пациентов с НАЖБП, характеризующейся стойким подъемом сывороточной активности γ-ГТ, риск ХБП возрастает в 2,31 раза; на статистическую достоверность этой связи не оказывали влияния возраст, триглицеридемия и сывороточная концентрация ЛОНП [4]. В другом исследовании [5] было показано, что при сахарном диабете 2 типа частота ХБП при наличии НАЖБП возрастает более чем в 1,5 раза и; более того, НАЖБП является независимой детерминантой ХБП, увеличивая частоту ее возникновения на 87 % (р = 0,02).
Наличие ассоциации между НАЖБП и ХБП, описываемой как взаимосвязью их частот, так и показателями, характеризующими риск, позволяет предполагать единство механизмов их развития при метаболическом синдроме. Среди этих механизмов уже на ранних стадиях органного поражения, очевидно, особое значение имеют эффекты медиаторов, продуцируемых клетками жировой ткани (адипокинов), индуцирующих дисфункцию эндотелия, дезадаптивную тканевую гипертрофию и фиброз [6]. Пара лептин–адипонектин – адипокины, являющиеся физиологическими антагонистами: при абдоминальном ожирении гиперпродукция лептина, сочетающаяся с резистентностью к нему периферических тканей, сопряжена с недостаточностью обладающего протективными свойствами адипонектина, что приводит к нарастанию обменных расстройств, в частности инсулинорезистентности, и ускорению органного ремоделирования [7, 8]. Изучение взаимосвязей между плазменной концентрацией лептина, адипонектинемией и формированием ХБП у больных НАЖБП, ставшее целью настоящего исследования, в связи с этим может позволить приблизиться к пониманию механизмов развития поражения органов-мишеней при метаболическом синдроме и оптимизировать соответствующие профилактические стратегии.
Материал и методы
В исследование были включены 86 больных (64 мужчины, 22 женщины) метаболическим синдромом, диагностированным на основании критериев Всероссийского научного общества кардиологов (2009) [9], имеющих НАЖБП (ультразвуковые признаки стеатоза печени, в т. ч. в сочетании с подъемом
сывороточной активности печеночных трансаминаз, гамма-глутамилтранспептидазы (Г-ГТ) и/или щелочной фосфатазы в отсутствие маркеров вирусных гепатитов и иных причин поражения печени). У всех пациентов было констатировано соответствующее общепринятым диагностическим критериям
(окружность талии > 94 cм у мужчин и > 80 cм у женщин [9]) абдоминальное ожирение. Средний возраст обследованных составлял 44,0 ± 11,0 года.
Наряду с общеклиническим обследованием у всех пациентов целенаправленно определяли наличие и степень выраженности общепризнанных факторов риска (Российское медицинское общество по артериальной гипертонии (2010) [10]). АД измеряли общепринятым методом; определяли индекс массы тела (ИМТ) и окружность талии; оценивали сывороточную концентрацию общего холестерина, холестерина липопротеидов низкой (ХС ЛПНП), очень низкой (ХС ЛПОНП) и высокой (ХС ЛПВП) плотности, триглицеридов, рассчитывали индекс атерогенности. Наличие и степень выраженности инсулинорезистентности, а также связанных с ней нарушений углеводного обмена определяли по тощаковой гликемии, сывороточной концентрации С-пептида, кроме того, рассчитывали HOMA-индекс.
Иммуноферментным методом определяли плазменную концентрацию адипокинов – лептина и адипонектина. Признаки поражения органов-мишеней регистрировали на базе рекомендации Российского медицинского общества по артериальной гипертензии (2010) [10]: гипертрофию левого желудочка диагностировали на основании определений индекса Соколова–Lyon и индекса массы миокарда левого желудочка, атеросклеротическое поражение сонных артерий – по увеличению измеряемой с помощью ультразвукового исследования толщины комплекса интима-медиа общей сонной артерии (ТИМ ОСА) и/или при обнаружении в ее стенке атеросклеротической бляшки; альбуминурию оценивали качественным (микраль-тест) и количественным методами, скорость клубочковой фильтрации рассчитывали по формуле MDRD.
Статистическую обработку результатов осуществляли с помощью программы STATISTICA 8.0. Для описания исследуемых показателей рассчитывали среднее значение и стандартное отклонение (для признаков с нормальным распределением); медиану и межквартильный интервал – для признаков
с асимметричным распределением. Для сравнения групп использовали параметрические и непараметрические методы. Различия между сравниваемыми группами считали статистически достоверными при p < 0,05.
Результаты и обсуждение
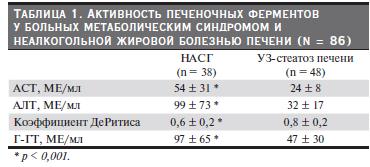
Все обследованные больные были разделены на две группы в зависимости от стадии НАЖБП: у 48 из них был констатирован бессимптомный, выявляемый только при ультразвуковом исследовании стеатоз печени; 38 демонстрировали признаки неалкогольного стеатогепатита. Ориентируясь на сопоставление сывороточной активности печеночных ферментов, пациенты, имевшие НАСГ, демонстрировали достоверно большие их величины (табл. 1). Коэффициент ДеРитиса при НАСГ,
напротив, оказался достоверно меньшим.
Сопоставление частоты ХБП и НАСГ в зависимости от числа признаков поражения органов-мишеней (табл. 2) показало, что частота ХБП достигает максимума при наличии ≥ 3 признаков. НАСГ чаще всего наблюдался также в группе пациентов, имевших ≥3 признаков поражения органов-мишеней; различия с группами, имевшими 1 и 2 признака поражения органов-мишеней, оказались статистически достоверными. При наличии 2 и ≥ 3 признаков поражения органов-мишеней отмечено достоверное нарастание мочевой экскреции альбумина. Величины плазменной концентрации адипонектина и лептина в зависимости от числа признаков поражения органов-мишеней достоверно не различались, однако уже в группе с 2 признаками поражения органов-мишеней было констатировано достоверное нарастание соотношения лептинемия/адипонектинемия, величина которого достигла максимума у пациентов с ≥ 3 признаками поражения органов-мишеней. У этих больных соотношение лептинемия/адипонектинемия достоверно превышало таковое в группе с 2 признаками поражения органов-мишеней.
ХБП была выявлена у 32 (37,2 %) обследованных больных метаболическим синдромом и НАСГ. У 26 из них выявлена микроальбуминурия, у 6 экскреция альбумина с мочой составила > 300 мг/сут. ХБП III cтадии (расчетная скорость клубочковой фильтрации < 60 мл/мин/м2) выявлена у 5 больных; все они демонстрировали признаки НАСГ. Как видно из табл. 3, больные метаболическим синдромом и НАЖБП, имевшие ХБП, демонстрировали существенно более выраженную инсулинорезистентность: величины тощаковой инсулинемии, HOMA-индекса, а также плазменной концентрации С-пептида в этой группе оказались достоверно выше, чем у пациентов с НАЖБП, не имевших ХБП. Кроме того, в группе больных
метаболическим синдромом, НАЖБП и ХБП удалось констатировать достоверно более высокие величины концентрации лептина в плазме крови.
Таблица 2. Частота ХБП и НАСГ, альбуминурия и плазменная концентрация адипокинов у больных метаболическим синдромом с неалкогольной жировой болезнью печени (N=86).
Проведенный корреляционный анализ (табл. 4) показал, что плазменная концентрация лептина прямо коррелировала с ИМТ, систолическим АД, адипонектинемией и альбуминурией. Была констатирована прямая корреляция адипонектинемии с лептинемией, сывороточной концентрацией ХС ЛПВП и
коэффициентом ДеРитиса, обратная – с индексом атерогенности и ТИМ ОСА.
Таким образом, у больных метаболическим синдромом и НАЖБП по мере увеличения числа признаков поражения органов-мишеней увеличивается частота обнаружения ХБП и НАСГ; одновременно нарастает альбуминурия. Ассоциация НАЖБП с альбуминурией продемонстрирована также и в других клинических исследованиях. При обследовании 1361 пациента с сахарным диабетом 2 типа и предиабетом было установлено [11], что наличие НАЖБП сопряжено с большей частотой микроальбуминурии (19 против 6,3 % без НАЖБП при предиабете, р = 0,001; 32,6 против 4,5 % без НАЖБП при сахарном диабете 2 типа р < 0,001). Кроме того, НАЖБП была ассоциирована с большей величиной соотношения альбумин/креатинин при предиабете (27,7 ± 63,9 против 14,6 ± 52,0 мкг/мг в группе без НАЖБП, р = 0,051); различие в величине этого показателя оказалось статистически высокодостоверным в группе больных сахарным диабетом 2 типа (44,7 ± 76,4 против 11,4 ± 21,4 мкг/мг в группе без НАЖБП, p < 0,001). НАЖБП была сопряжена с увеличением частоты микроальбуминурии в 3,66 раза (р = 0,013) при предиабете, в 5,47 раза (р = 0,048) при сахарном диабете. У обследованных нами пациентов с метаболическим синдромом и НАЖБП в группе с максимальной частотой обнаружения НАСГ оказалась наибольшей экскреция альбумина с мочой.
По мере увеличения частоты обнаружения НАСГ и величины альбуминурии у обследованных нами больных метаболическим синдромом с НАЖБП отмечено достоверное увеличение соотношения лептин/адипонектин, свидетельствующее о том, что рост продукции ткань-деструктивного адипокина лептина не сопровождается адекватным приростом плазменной концентрации обладающего протективными свойствами адипокина адипонектина. Продемонстрировано, что рост соотношения
лептин/адипонектин ассоциирован с увеличением количества висцерального жира, частоты метаболического синдрома [12] и выраженности инсулинорезистентности [13].
Недостаточность эффектов адипонектина и гиперпродукция лептина предопределяют нарастание инсулинорезистентности, достигшей наибольшей выраженности в группе больных НАЖБП с ХБП, демонстрирующих максимальные величины тощаковой концентрации инсулина, С-пептида и HOMA-
индекса. Очевидно, что выраженность инсулинорезистентности у них во многом обусловлена избытком лептина [7], плазменная концентрация которого в группе больных НАЖБП и ХБП оказалась максимальной. Значение лептина в нарастании резистентности периферических тканей к инсулину оказывается тем выраженнее, что по мере прогрессирования НАЖБП и формирования у этих больных ХБП постепенно снижается плазменная концентрация адипонектина (в пользу этого свидетельствует обнаруженное нами достоверное снижение соотношения лептинемия/адипонектинемия) и истощаются его ткань-протективные эффекты. Необходимо отметить, что лептин во многом проявляет свойства, аналогичные имеющимся у избытка инсулина, таким образом вступая с ним в синергизм, в частности индуцируя экспрессию тканями-мишенями профиброгенных хемокинов (например, трансформирующего фактора роста-бета (ТФР-β) и тем самым запуская процессы тканевого фиброза). Участие лептина в развитии фиброза почечной ткани в настоящее время не вызывает сомнения [14], и именно последствиями гиперадипонектинемии, как и недостатком адипонектина, можно с патогенетических позиций во многом объяснить установленную в эпидемиологических исследованиях [15, 16] роль ожирения как общепопуляционного фактора риска ХБП. Установлено также, что лептин непосредственно усиливает фиброгенез в печеночной ткани и при НАЖБП. Так, K. Ikejima et al. (2005) [17] на экспериментальных крысах с генетически детерминированным ожирением продемонстрировали, что лептин обусловливает нарастание экспрессии мРНК ТФР-β Купферовскими клетками и синусоидальными эндотелиоцитами, а также тормозит индуцируемую тромбоцитарным фактором роста пролиферацию печеночных звездчатых клеток. Таким образом, прогрессирование НАЖБП и ХБП при метаболическом синдроме во многом определяется фиброгенными эффектами лептина и избытка инсулина.
Таблица 3. Результаты сопоставления маркеров инсулинорезистентности и плазменной концентрации адипокинов в группах больных метаболическим синдромом НАЖБП в зависимости от наличия ХБП.
Таблица 4. Корреляционные взаимосвязи плазменной концентрации адипокинов с метаболическими параметрами и признаками поражения органов-мишеней у больных метаболическим синдромом и НАЖБП (N=86).
Наряду с этим другим общим механизмом развития НАЖБП и ХБП при метаболическом синдроме может являться индуцируемая лептином и инсулином дисфункция эндотелия, в качестве локально-почечного маркера которой может выступать нарастающая альбуминурия. Продемонстрировано [18], что при абдоминальном ожирении гиперлептинемия сопряжена с микроальбуминурией. Установлены также и
четкие ассоциации НАЖБП с глобальными нарушениями эндотелиальной функции: так, обследование 250 детей, страдающих ожирением, показало, что наличие НАЖБП у них сопряжено с увеличением частоты обнаружения отражающих эндотелиальную дисфункцию нарушений поток-зависимой
вазодилатации в 2,25 раза [19]. У больных артериальной гипертензией расстройство поток-зависимой вазодилатации и инсулинорезистентность также оказались максимально выраженными именно при наличии НАЖБП [20]. Таким образом, можно утверждать, что наличие НАЖБП при метаболическом синдроме всегда сочетается с наиболее выраженной эндотелиальной дисфункцией, во многом предопределяющей интенсивность ремоделирования других органов-мишеней, в т. ч. почек.
Нельзя исключать, что связанные с гиперлептинемией и инсулинорезистентностью, а также с недостаточностью эффектов адипонектина нарушения функции печеночного эндотелия играют роль и в прогрессировании НАЖБП, однако их оценка, очевидно, требует разработки специальных
лабораторных методов обследования.
Взаимосвязи между НАЖБП и ХБП, установленные в настоящем исследовании при обследовании больных метаболическим синдромом, могут во многом быть объяснены дисбалансом антагонистичных адипокинов – лептина и адипонектина – и связанным с этим дисбалансом нарастанием инсулинорезистентности. Ориентируясь на нарастание выполненного нами корреляционного анализа, плазменная концентрация лептина нарастает по мере увеличения массы тела; параллельно с гиперлептинемией увеличивается и инсулинорезистентность, а также альбуминурия. Кроме того, гиперлептинемия ассоциирована с нарастанием АД: гипертензивное действие лептина сегодня подтверждено и на общепопуляционном уровне. В одном из этапов популяционного исследования Copenhagen City Heart Study [21], включившем 620 женщин и 300 мужчин, исходно нормотензивных, прирост плазменной концентрации лептина на одно стандартное отклонение был ассоциирован с увеличением вероятности развития артериальной гипертензии в 1,28 раза (р < 0,005). Плазменная концентрация адипонектина прямо коррелировала с уровнем в плазме крови ХС ЛПВП, соответственно, обратная корреляция ее была отмечена с индеком атерогенности ТИМ ОСА. Полученные нами данные согласуются с общепринятыми представлениями об антиатерогенных свойствах адипонектина и его способности противостоять нарастанию обменных расстройств, в частности инсулинорезистентности при метаболическом синдроме [8]. Выявленная в нашем исследовании прямая корелляция между адипонектинемией и коэффициентом ДеРитиса свидетельствует в пользу того, что адипонектин оказывает тормозящее действие на прогрессирование НАЖБП; при развитии НАСГ его плазменная концентрация и экспрессия печеночной тканью достоверно снижаются [22]. Дисбаланс между лептином и адипонектином, таким образом, можно считать одним из важных механизмов формирования органных поражений, в т. ч. ХБП и НАЖБП, при метаболическом синдроме.
Результаты выполненного нами исследования свидетельствуют о том, что при метаболическом синдроме признаки НАЖБП и ХБП связаны между собой: НАСГ сопряжен с достоверным нарастанием альбуминурии. Ассоциация НАЖБП и ХБП при метаболическом синдроме объясняется единством механизмов их развития и прогрессирования, среди которых особое значение имеют гиперлептинемия, недостаточность эффектов адипонектина и связанное с ними нарастание инсулинорезистентности. С этой точки зрения все больные метаболическим синдромом и НАЖБП должны быть обследованы на наличие признаков ХБП (альбуминурия, креатининемия, расчетная скорость клубочковой фильтрации),
динамика которых может рассматриваться как показатель эффективности интегральных терапевтических воздействий, например препаратов, использующихся для лечения ожирения
(орлистат), пероральных сахароснижающих (метформин), антигиперлипидемических (статины, фенофибрат), а также некоторых антигипертензивных, например блокаторов рецепторов ангиотензина II.
Исследование выполнено в рамках Гранта Президента РФ для государственной поддержки молодых российских ученых, кандидатов наук (конкурс – МК-2010), договор № 02.120.11.8327-МК от 28.06.2010 по теме “Факторы развития и прогрессирования нефропатий у больных ожирением”.



