Введение
Сахарный диабет (СД) – серьезная медикосоциальная проблема здравоохранения всех стран. Согласно последней редакции Атласа диабета Международной диабетической федерации (IDF Diabetes Atlas), опубликованного в 2021 г., за последние 20 лет заболеваемость СД удвоилась и число пациентов с СД достигло 10,5% мировой популяции в возрасте от 20 до 79 лет, составив на сегодняшний день 537 млн человек. По прогнозам исследователей, к 2030 г. с СД будут жить 11,3% населения Земли [1]. Причем прирост заболеваемости идет опережающими темпами, поскольку всего за год до этого тот же Атлас диабета констатировал распространенность СД, равную 9,3% населения, и прогнозировал ее повышение к 2030 г. до 10,2% [2]. Возможно, ухудшение связано с продолжающейся пандемией Covid-19 и постковидным синдромом, неблагоприятно влиявшими на состояние здоровья населения в целом. Российский национальный регистр эндокринопатий свидетельствует, что на 01.01.2019 3,03% населения страны страдали СД2. Впрочем реальная распространенность СД2 при экстраполяции результатов кросс-секционного исследования NATION, вероятно, превышает 5% общей популяции [3]. Ежегодно в России выявляется до 379 новых случаев ХБП на 10 тыс. пациентов с СД2, при этом абсолютное ежегодное число новых случаев ХБП 5-й ст. в 2013–2017 гг. составило от 745 до 1887 [4]. Следует отметить, что средняя годовая стоимость лечения одного пациента с СД2 составляет 279 609 руб., на прямые медицинские затраты приходится 105 337 руб., из них 57% – на лечение осложнений СД, в т.ч. диабетической нефропатии (ДН) [5]. Переход пациента на программный гемодиализ (ПГД) многократно увеличивает расходы. ДН становится главной причиной терминальной стадии ХБП (ТХБП) во многих странах и доля пациентов с СД на диализе достигает в Западной Европе и США 30–40% [6]. К сожалению, в отечественной литературе сведения о числе пациентов с СД на заместительной почечной терапии ограниченны, но даже по данным на 2013 г. таких пациентов было 19% среди начинающих лечение ПГД [7]. У пациентов СД младше 55 лет, перешедших на ГД, смертность выше в 14 раз по сравнению с лицами общей популяции того же возраста. ТХБП так же увеличивает риск смерти в 7 раз в возрастной категории 55–64 года и в 6 раз в группе 65–74 лет. [8]. В дополнение к ранее известным патогенетическим механизмам развития и прогрессирования ДН (нарушение внутрипочечной гемодинамики, гиперфильтрация, дисфункция ренин-ангиотензин-альдостероновой системы, генетические факторы) в последние годы интенсивно обсуждается вовлеченность провоспалительных цитокинов, особенно фактора некроза опухоли-α (ФНО-α), интерлейкинов-6 и -1 (ИЛ-6 и -1) [9]. Контролируемая воспалительная реакция здорового организма на внешние и внутренние повреждающие стимулы призвана организовывать межклеточное взаимодействие и метаболические процессы таким образом, чтобы максимально быстро избавлять организм от поврежденных клеток и инициировать восстановление тканей. Однако дисрегуляция воспаления при уремии и СД приводит к его хронизации и промотированию многочисленных осложнений, включая атеросклероз, остеопороз, белково-энергетическую недостаточность (БЭН). Причины повышенного синтеза цитокинов иммунокомпетентыми клетками (Т-хелперами) разнообразны и до конца не изучены. Помимо токсического действия гипергликемии имеются данные о дефекте митохондрий и нарушении метаболизма жирных кислот в Т-лимфоцитах пациентов с СД, запускающими процессы синтеза цитокинов [10]. Неменьшим влиянием на прогрессирование сердечно-сосудистых повреждений и увеличение смертности среди пациентов с СД и ХБП обладают конечные продукты гликозилирования (КПГ), накапливающиеся в сосудистой стенке и кардиомиоцитах и ускоряющие образование атеросклеротических бляшек и фиброза сердечной мышцы [11]. У пациентов с СД повышение уровня КПГ закономерно в условиях персистирующей или интермитирующей гипергликемии, но и у пациентов с ХБП без СД уровень КПГ так же повышен вследствие их усиленного образования в условиях оксидативного и карбоксильного стресса и нарушения элиминации почками [12]. Повышение катаболизма белка на фоне персистирующего уремического воспаления и оксидативного стресса вкупе с недостаточным поступлением макронутриентов и калорий приводит к прогрессирующей БЭН, которая наряду с другими осложнениями уремии (анемией, минерально-костными нарушениями) служит независимым фактором, ухудшающим качество жизни и многократно увеличивающим риск смерти пациентов на ПГД [13, 14].
С учетом всего сказанного диетотерапия, направленная на сохранение мышечной массы и обеспечивающая достаточное энергетическое восполнение, должна быть одним из ключевых принципов терапии пациентов на ПГД. Несоблюдение рекомендуемого уровня потребления белка 1,0–1,2 г/кг/сут. и калорийности 30–35 ккал/кг ид. веса/сут. служит предиктором неблагоприятных исходов для пациентов на ПГД [15]. В то же время многие исследователи отмечают, что своевременно и правильно организованное лечебное питание пациентов на ПГД способно существенно улучшать как самочувствие, так и объективные маркеры БЭН [16–19]. Следует отметить, что влияние диетотерапии и индивидуального консультирования на степень хронического уремического воспаления остается недостаточно исследованным и касается в основном исключения «провоспалительных» ингредиентов рациона (полуфабрикатов, простых сахаров, пищевых добавок и пр.) [20].
Также мало работ, прицельно изучающих нарушение питания пациентов с СД на ПГД и возможного антивоспалительного эффекта от восполнения у них в рационе недостатка белка и калорий. По-прежнему в нефрологическом сообществе есть немало скептиков, которые указывают, что в повседневной практике без постоянного и пристального контроля питания со стороны диетолога в условиях дефицита времени и отсутствия или недостаточной приверженности пациентов рекомендациям лечащего врача организовать коррекцию рациона и добиться значимых успехов невозможно, особенно у столь сложных пациентов, какими являются больные СД2.
Цель исследования: оценить возможность и степень коррекции нутриционного статуса сбалансированным питанием за относительно короткий срок в 12 недель и достижимость смягчения хронического воспаления по мере снижения выраженности БЭН.
Материал и методы
Настоящее исследование проводилось среди пациентов с терминальной стадией ХБП, находящихся на программном гемодиализе не менее 1 года. Отобранные из общей диализной популяции пациенты были распределены в две группы с СД2 (СД2+, n=40) и без СД2 (СД2-, n=39), сопоставимые по половозрастным характеристикам (ср. возраст – 64,1 и 62,6 года соответственно; р=0,3). Все обследованные пациенты подписали информированное согласие на участие в исследовании, одобренное этическим комитетом ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава РФ. В исследование не включались пациенты с тяжелыми осложнениями СД2 (трофические язвы, диабетическая стопа), циррозом и фиброзом печени, перенесшие онкологические заболевания в течение 5 предшествовавших лет, злоупотреблявшие лекарственными препаратами или алкоголем (более 2 единиц алкоголя в сутки [1 ЕД=10 мл, или 8 г, чистого этилового спирта]); не способные придерживаться диетических рекомендаций. Диагноз БЭН выставлялся в соответствии с критериями Международного общества питания и метаболизма при ХБП (ISRNM) [21]. Подробная клиническая характеристика пациентов обеих групп представлена в нашей статье, опубликованной в 2020 г. [22]. Все пациенты получили индивидуальные консультации по коррекции рациона в соответствии с данными исходного обследования. Через 6 недель проводились повторные консультации и корректирование рациона на основании полученных данных промежуточного обследования. Итоговое обследование и контроль рациона проводили через 12 недель диетотерапии. В качестве дополнительного источника белка пациентам с низким его потреблением назначался изолят соевого белка (20–30 г/сут.). Протокол клинического исследования представлен в табл. 1.
Статистический анализ полученных данных проведен с использованием общепринятых методов параметрической и непараметрической статистики. Рассчитывали средние величины, стандартные средние ошибки, доверительный интервал, медиану, квартили и стандартное отклонение. Оценка межгрупповых различий проведена с помощью непараметрических критериев Манна–Уитни для несопряженных совокупностей и критерия Вилкоксона для сопряженных совокупностей. Критический уровень достоверности нулевой статистической гипотезы принимался равным 0,05. Статистическая обработка данных выполнялась с использованием стандартных пакетов программ прикладного статистического анализа (Statistica. 10).
Результаты
Динамика антропометрических показателей в процессе исследования представлена в табл. 2.
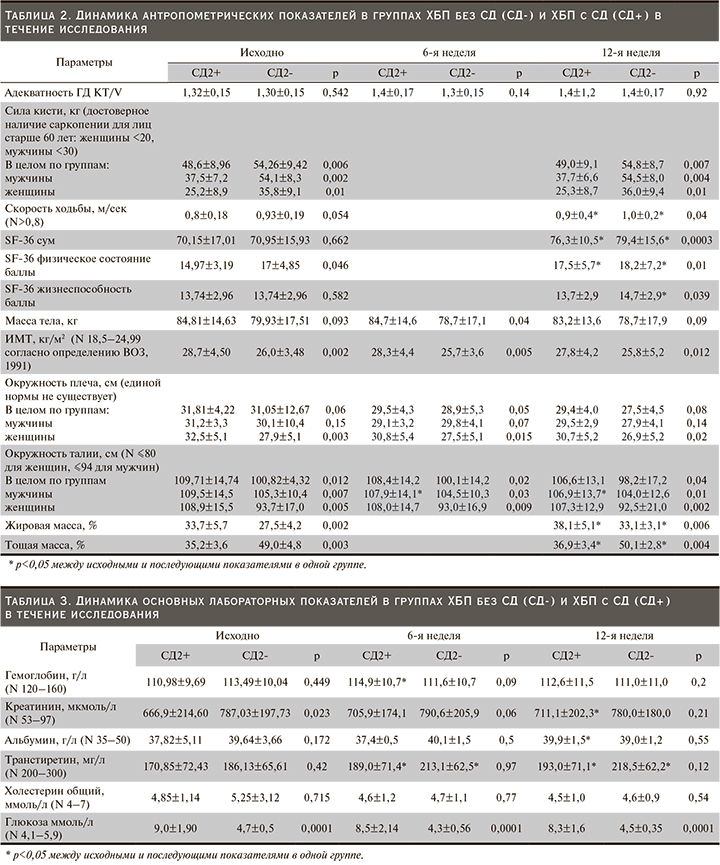
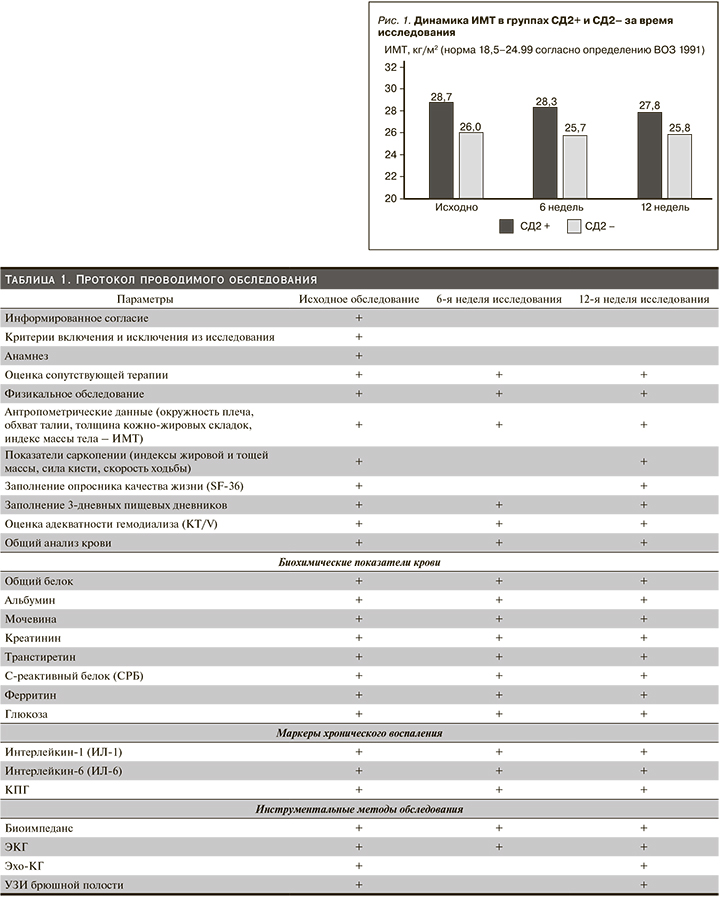
Исходная оценка нутриционного статуса выявила наличие БЭН у 37 (47%) из 79 человек, принимавших участие в исследовании. Частота БЭН в группе СД2- составила 28% (11 пациентов), в группе СД2+ 65% (26 пациентов), что в 2 с лишним раза больше. Наличие не менее 2 критериев БЭН, что расценивалось как риск ее развития, имело место у всех оставшихся пациентов с СД и у 19 (48%) – без СД. Таким образом, не страдали БЭН и не имели факторов риска ее развития только 9 (23%) пациентов без СД. Средний ИМТ в группе СД2+ был достоверно выше, чем в СД2-, но показатели количественного и функционального состояния мышечной массы (сила кисти, % тощей массы, окружность плеча, преддиализный уровень креатинина) – хуже. Снижение мышечной силы косвенно отразилось в достоверной разнице баллов оценки физического состояния в опроснике SF-36 не в пользу пациентов с СД2. Повышение ИМТ в группе СД2+ сочеталось с достоверно большей окружностью талии и % жировой массы. Эта разница между группами сохранялась на протяжении всего исследования (рис. 1).
Эти данные свидетельствуют о более выраженной степени саркопенического ожирения у пациентов СД2+. В течение первых 6 недель после начала диетотерапии существенных изменений в антропометрических параметрах в обеих группах не произошло, за исключением небольшого уменьшения объема талии у мужчин в группе СД2+. Между группами сохранялись прежние достоверные различия. К концу периода наблюдения отмечено достоверное увеличение процента как жировой, так и тощей массы, скорости ходьбы и баллов в разделе физического состояния опросника SF-36 в обеих группах. Дополнительно у мужчин в группе СД2+ отмечено дальнейшее уменьшение окружности талии (в среднем на 3 см за 12 недель), в группе СД2- помимо физического состояния улучшились и характеристики жизнеспособности в опроснике SF-36.
Изменение лабораторных показателей представлено в табл. 3.
Исходный уровень альбумина не различался по группам и формально соответствовал нормальному референсному интервалу 35–45 г/л (37,82±5,11г/л в группе СД2+ и 39,64±3,66 г/л в группе СД2-), однако уровень преальбумина (транстиретина), который более достоверно отражает состояние общего пула белка в организме, был снижен в обеих группах (170,85±72,43 мг/л у пациентов с СД2 и 186,13±65,61 мг/л у пациентов без СД2). Уже через 6 недель после корректировки рациона в обеих группах достоверно повысился уровень транстиретина, и этот положительный тренд сохранился до конца исследования, так что в группе СД2- к 12-й неделе уровень транстиретина достиг нормального значения, в группе СД2+ вплотную приблизился к нижней границе нормы (рис. 2).

Кроме того, в группе СД2+ отмечена достоверная положительная динамика в уровне альбумина (в среднем на 2 г/л к концу исследования) и преддиализного уровня креатинина. Гликемический профиль за время терапии не ухудшился: средние уровни тощаковой глюкозы, гликированного гемоглобина и дозы гипогликемических препаратов у пациентов с СД2 не менялись на протяжении всего исследования. Достоверный прирост уровня гемоглобина к 6-й неделе в группе СД2+ мог не быть напрямую связанным с диетотерапией.
Особого внимания заслуживают изменения маркеров воспаления (табл. 4).
Исходно КПГ и СРБ были повышены в обеих группах без достоверных различий, но уровни ИЛ-1 и ИЛ-6 были выше в группе СД2+, что свидетельствует о более напряженной воспалительной реакции у этих пациентов. К 6-й неделе диетотерапии значимых изменений в уровнях ИЛ-1, -6 и КПГ не произошло, но к 12-й неделе отмечено достоверное снижение этих показателей в обеих группах, причем исчезла межгрупповая разница, за исключением слабого различия в уровне ИЛ-1 не в пользу группы СД2+. Динамика КПГ проиллюстрирована на рис. 3
Исходные уровни потребления нутриентов и калорий, а также их динамика на протяжении исследования представлены в табл. 5.
Трехдневные дневники показали, что средние уровни потребления белка и калорий в группе СД2- соответствовали рекомендованным для диализной популяции (≥1,1 г/кг белка и 30–35 ккал/кг ид. веса/сут.), хотя 9 (23%) пациентов потребляли белка менее 1 г/кг/сут., 10 (25%) – менее 30 ккал/кг/сут. В группе СД2+ средние показатели потребления белка были близки к рекомендованным (1,08 г/кг/сут.), но калорийность рациона была значительно ниже (23,6 ккал/кг/сут.). Число пациентов со сниженным потреблением белка в этой группе составило 17 (42%), со сниженным потреблением калорий – 24 (60%). С каждым пациентом проведено индивидуальное консультирование, разработаны изменения в рационе (в т.ч. назначение соевого изолята пациентам со сниженным аппетитом и значительным недостатком потребляемого белка), призванные довести калорийность питания до 30–35 ккал/кг/сут. и количества белка – до уровня 1,1–1,2 г/кг/сут. Были даны также общие рекомендации с целью повысить приверженность пациентов более здоровой диете (с исключением фаст-фуда, дополнением рациона овощами, крупами и пищевыми волокнами). Уже промежуточные трехдневные пищевые дневники, заполненные на 6-й неделе исследования, продемонстрировали положительные изменения в рационе: калорийность в группе СД2+ нормализовалась, в группе СД2- снизилась (но осталась в рекомендуемых пределах). Повторное консультирование проводилось только тем пациентам в обеих группах, у которых, по данным дневников, сохранялись диспропорции в рационе. Контрольные пищевые дневники, заполненные на 12-й неделе исследования, показали сохранение достигнутого уровня калорийности пищи в группе СД2+ и достоверное увеличение потребления белка, которое стало соответствовать рекомендуемому всем пациентам группы. В группе СД2- потребление белка несколько снизилось (с 1,9 до 1,3 г/кг/сут.), но не вышло за рамки рекомендуемого уровня. В обеих группах повысилось потребление углеводов (за счет сложных углеводов), более выраженное в группе СД2-. Интересно, что увеличение калорийности питания в группе СД2+ не привело к значимому изменению средних значений тощаковой глюкозы.
Обсуждение
Доля пациентов с СД на ПГД неуклонно растет во всем мире [6, 7], отражая, с одной стороны, неблагоприятные тренды заболеваемости СД в общей популяции [1–3], с другой стороны, повышенный риск развития поражения почек и ускоренного прогрессирования ХБП при этой патологии [23]. БЭН у пациентов на гемодиализе широко распространена и имеет мультифакторный генез. Основными патогенетически значимыми причинами ее развития служат хроническое воспаление, кишечный дисбиоз, инсулинорезистентность, метаболический ацидоз, потери аминокислот и белка во время процедур гемодиализа, дефицит витамина D, дисгевзия, гипосмия и некоторые другие. Действуя в комплексе, они приводят к отрицательному азотистому балансу. Как СД, так и ХБП – это состояния, характеризующиеся хроническим оксидативным стрессом и воспалением. Сочетание СД с ХБП увеличивает степень активации хронического воспаления и усугубляет риск развития БЭН. В качестве маркеров выраженности воспалительного процесса и степени оксидативного стресса нами были выбраны КПГ, ИЛ-1 и -6. Известно, что повышенный уровень КПГ сопровождает СД2 даже в условиях сохранной функции почек. В то же время повышенный уровень КПГ определяется при ХБП 3–5-й стадий без наличия СД2 вследствие повышенного образования в условиях уремии и снижения экскреции. Повреждающее действие КПГ частично связано с модификацией макромолекул, в частности матриксных белков (протеогликанов, коллагенов, ламинина, остеокальцина, матрикс-гла-протеина, фибронектина и др.), липидов, нуклеиновых кислот, что приводит к ускоренному старению тканей организма и сосудистой кальцификации, частично – с активацией синтеза цитокинов и свободных радикалов при связывании с соответствующими рецепторами на мембранах клеток [24]. КПГ служат независимым фактором риска смерти и у пациентов с СД и ХБП [12]. Воздействие цитокинов на центральную нервную систему выражается в изменении синтеза и свойств некоторых нейротрансмиттеров, что приводит как к снижению аппетита, так и к изменению метаболизма. У здорового взрослого человека ежедневно синтезируется и подвергается деградации около 300 г белка (4–5 г/кг/сут.) [25]. Даже небольшой, но постоянный белковый и/или энергетический дисбаланс может оказать существенное влияние на тощую массу. Исследования показали, что гемодиализ усиливает катаболизм белка. Восполнение потерь аминокислот c диализатом во время сеанса гемодиализа, которое может достигать 10 г за процедуру, происходит в значительной степени за счет катаболизма белков мышечной ткани [26, 27]. Несмотря на то что на скелетную мускулатуру приходится только 30% от общего обмена белка, именно она служит источником восполнения потерь белка вследствие большей чувствительности процессов обмена к воздействию цитокинов, чем другие ткани [28]. ИЛ-6 играет ключевую роль в регуляции белкового обмена в мышцах, а также в печени. Несмотря на то что бόльшая часть циркулирующего ИЛ-6 секретируется активированными макрофагами и лимфоцитами, адипоциты и скелетные мышцы также являются возможным источником этого цитокина. Общий отток ИЛ-6 из мышц в вену наблюдается во время гемодиализа, что связано с увеличением уровня мРНК ИЛ-6 и экспрессией белка в скелетных мышцах [29]. ИЛ-6 и другие цитокины усиливают протеолиз и противостоят анаболическому воздействию нутриционной поддержки. ИЛ-1 также является одним из ключевых цитокинов, связанных с развитием кахексии у пациентов с ХБП. Более того, ИЛ-1 – медиатор процессов регулирования активности ИЛ-6 и ФНО-α: блокирование его синтеза в экспериментальных исследованиях приводило к снижению уровней всех трех показателей в сыворотке и параллельному улучшению аппетита, набору массы тела у мышей с уремией [30].
Таким образом, мы предположили, что отслеживание динамики уровней КПГ, ИЛ-1 и -6 в сочетании с фиксацией изменений показателей нутриционного статуса и состава рациона пациентов на фоне диетотерапии позволит определить потенциал диетотерапии в регрессе выраженности хронического воспаления и саркопении у пациентов на гемодиализе, в т.ч. с СД2. Ранее возможность снижения маркеров воспаления у пациентов с СД2 без ХБП на фоне диеты или диеты в сочетании с увеличением физической активности была продемонстрирована в рандомизированном клиническом исследовании (РКИ) большой длительности и со значительным числом включенных пациентов [31]. В то же время недавний системный обзор и мета-анализ 11 РКИ, изучавших влияние диетических пищевых волокон на микробиоту, метаболические и воспалительные маркеры пациентов с СД2, не выявили достоверного снижения уровней ИЛ-6 и ФНО-α у этих пациентов по сравнению с контролем, а уровень СРБ даже достоверно повысился на фоне диетотерапии [32]. Крупные исследования или мета-анализы такой же направленности, касающиеся пациентов с СД2 на ПГД, отсутствуют. В отношении пациентов на ПГД без СД2 в последнее время накопилось довольно много результатов исследований, демонстрирующих различные благоприятные эффекты увеличения потребления белка и энергии на показатели нутриционного статуса и исходы заболевания. Так, в большом исследовании Jr. E. Lacson et al. (2012) [33], включившем почти 10,5 тыс. пациентов на ПГД с уровнем альбумина сыворотки менее 3,5 г/дл, разделенных на 2 равные группы (интервенции и контроля), наблюдение в течение года выявило достоверное снижение смертности в группе, получавшей пероральную нутриционную поддержку (дополнительный белок и калории) и достигшую уровня альбумина ≥4,0 г/дл. Обнадеживающие результаты (снижение смертности на 69% в группе нутриционной поддержки по сравнению с контролем) были достигнуты в не менее представительной по числу пациентов работе D.A. Benner et al. (2018) [34]. Z. Asemi et al. (2016) отметили существенное улучшение таких показателей метаболизма, как липидный профиль, толерантность к глюкозе, инсулинорезистентность, параллельного улучшения результатов опросника SGA у пациентов на ПГД, получавших антиоксидантную терапию омега-3 и токоферолом в течение 12 недель, по сравнению с контрольной группой [35]. В исследовании A. Gharekhani et al. (2014) сходная антиоксидантная терапия помимо увеличения уровня преальбумина и альбумина сопровождалась еще и снижением концентраций ИЛ-6, СРБ и ферритина в сыворотке [36]. Но большинство исследований касается конкретной пероральной или парентеральной нутриционной поддрежки во время сеанса ГД, а не корректировки рациона на основе изучения 3-дневных дневников.
Комплексное воздействие на процессы воспаления и состояние мышечной массы изучалось в работах по внедрению принципов средиземноморской диеты у пациентов на ПГД. Такой рацион предполагает сбалансированность по микро- и макронутриентам и калорийности, а также исключает провоспалительные продукты (фаст-фуд, полуфабрикаты и простые сахара). В небольшом исследовании L.M. Lou et al. [37] показано, что переход на принципы средиземноморской диеты позволил улучшить состав потребляемых нутриенов и энергии у пациентов на ПГД по данным 7-дневных пищевых дневников. В обсервационном исследовании влияния средиземноморской диеты на сердечно-сосудистую и общую смертность среди пациентов на ПГД показало незначительное снижение преимущественно сердечно-сосудистой смертности при стабильном нутриционном статусе [38]. В более ранних исследованиях сообщалось, что средиземноморская диета позволяет снижать междиализную прибавку массы тела без отрицательного влияния на нутриционный статус [39]. Эти исследования демонстрируют возможность комплексного подхода к коррекции рациона пациентов на ПГД и его влияние на нутриционный статус. Наша работа показала, что даже относительно непродолжительное, всего 12-недельное, комплексное вмешательство в диетический режим (регулярное диетическое консультирование и мониторинг потребляемых нутриентов и энергии) позволило эффективно скорректировать рацион пациентов на ПТГ в соответствии с международными и национальными рекомендациями. Разумеется, такая коррекция была бы невозможна без регулярного заполнения пациентами пищевых дневников и подробного консультирования участников исследования в отношении полученных данных. Но следует отметить, что большинство пациентов были готовы к такой работе и привержены дававшимся рекомендациям (что идет вразрез с устоявшимся мнением о значительных затратах времени на подобную работу и неприверженности пациентов). Это позволило зарегистрировать достоверные благоприятные изменения в нутриционном статусе, касавшиеся уменьшения антропометрических показателей абдоминального ожирения и улучшения как пропорционального соотношения жировой и тощей массы, так и функционального состояния мышечной ткани, что отразилось и в объективных тестах (скорость ходьбы), и в субъективных оценках пациентов в опроснике SF-36. Эти объективные изменения происходили параллельно достоверному улучшению лабораторных маркеров воспаления (ИЛ-1, -6, КПГ), увеличению уровней альбумина и преальбумина к концу исследования. Стоит особо отметить, что повышение потребления калорий не привело к ухудшению гликемического контроля пациентов с СД. Можно предположить, что в некоторой степени именно боязнь повышения уровня глюкозы заставила пациентов группы СД+ уменьшать калорийность рациона, и это сказалось на худшем состоянии их нутриционного статуса по сравнению с группой СД-.
В целом пациенты группы СД+ получили более выраженный положительный эффект в ходе исследования, что представляется закономерным с учетом более выраженного хронического воспаления и несбалансированности рациона.
Заключение
Нутриционный статус больных ХБП5Д характеризуется склонностью к развитию абдоминального ожирения в сочетании с саркопенией и диапенией. Наличие СД способствует более выраженным изменениям нутриционного статуса и более частому развитию БЭН. Этим неблагоприятным процессам способствуют характерная для пациентов с ХБП инсулинорезистентность, системное воспаление, оксидативный стресс, изменение микробиоты, несбалансированность рациона по макро- и микронутриенам, а также по потреблению калорий. У пациентов с ХБП в сочетании с СД степень воспаления и инсулинорезистентности более выражены и дополнены диабетической невропатией, токсическим действием гипергликемии в отношении митохондрий и энергетического баланса скелетной и кардиальной мышечной ткани. Однако наше исследование доказывает возможность организации диетотерапии и ее эффективность в отношении негативных изменений нутриционного статуса пациентов на ПГД как без СД, так и с СД, достижение достоверного улучшения антропометрических и лабораторных показателей (в т.ч. активности воспаления) в относительно непродолжительные сроки.
Ограничением нашего исследования служат относительно небольшие размеры сравниваемых групп и его продолжительность.



